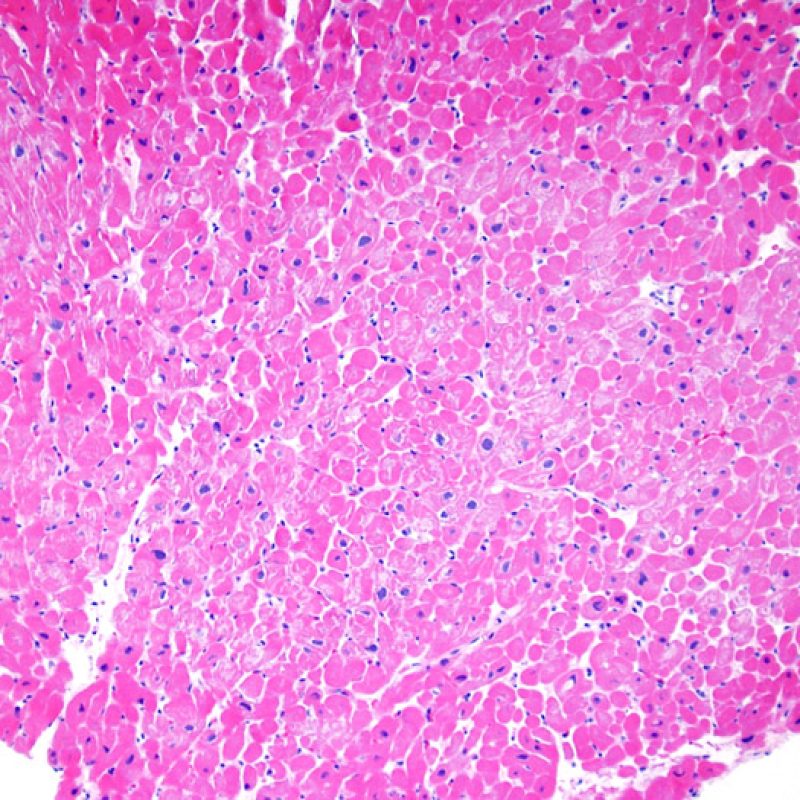
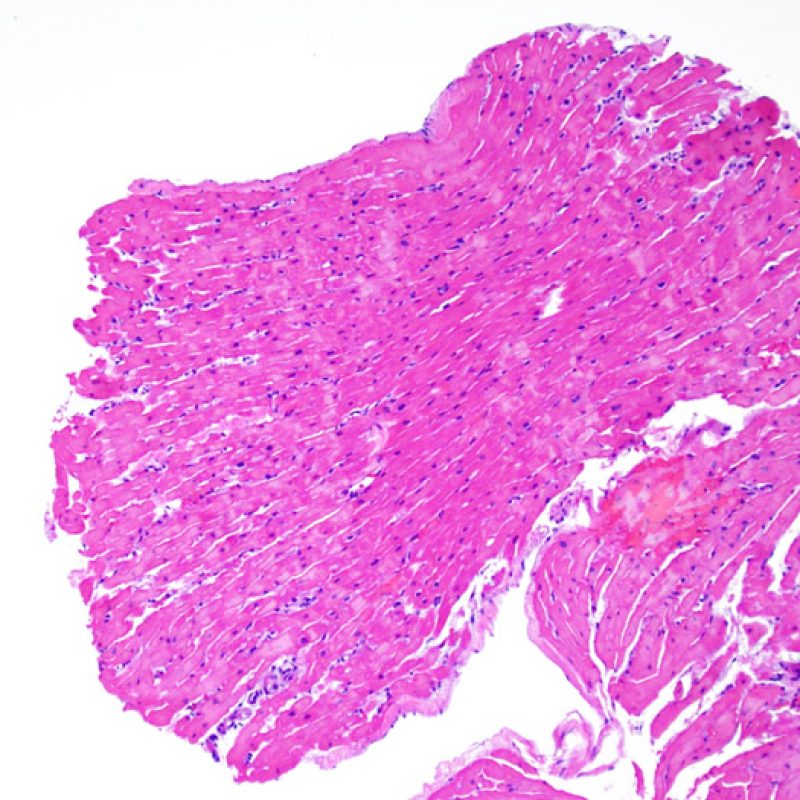
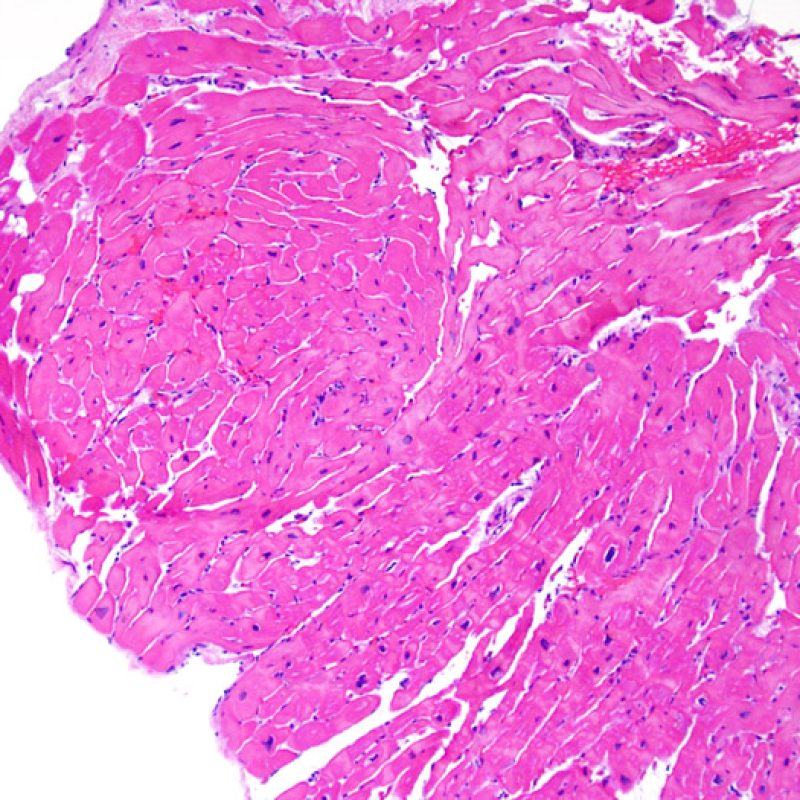
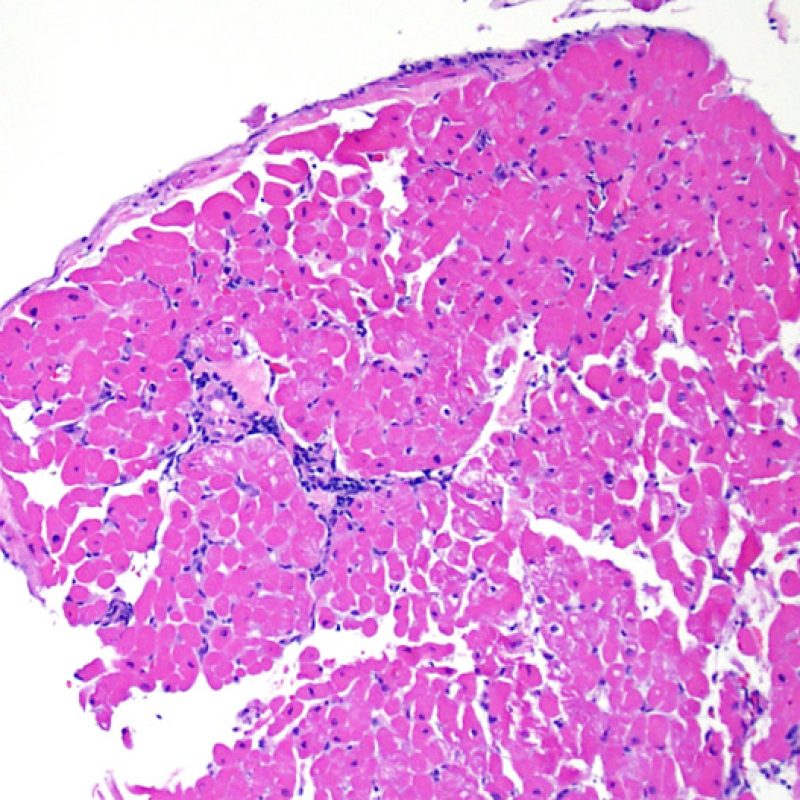
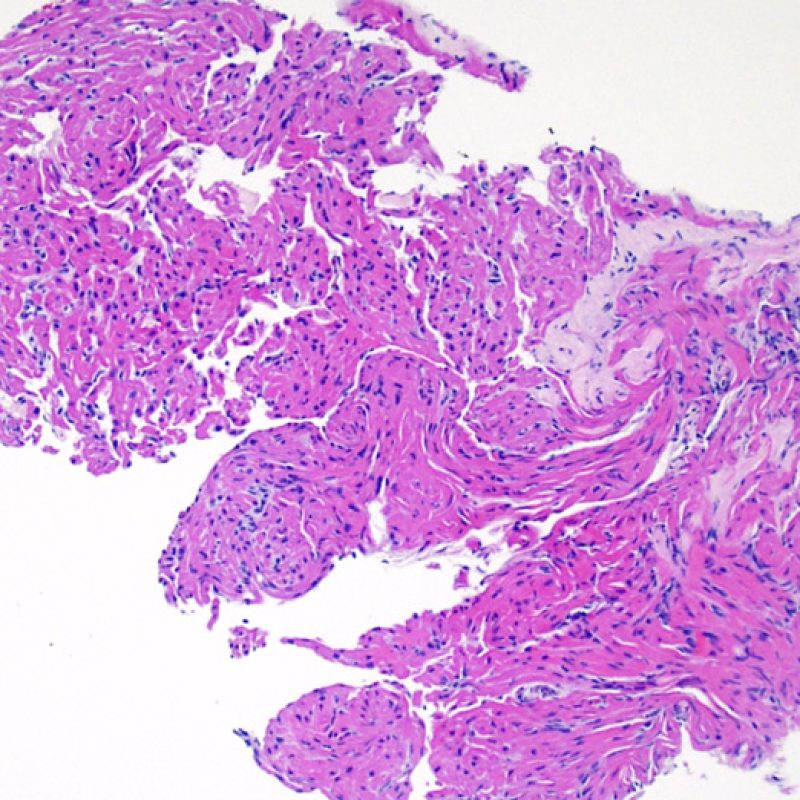
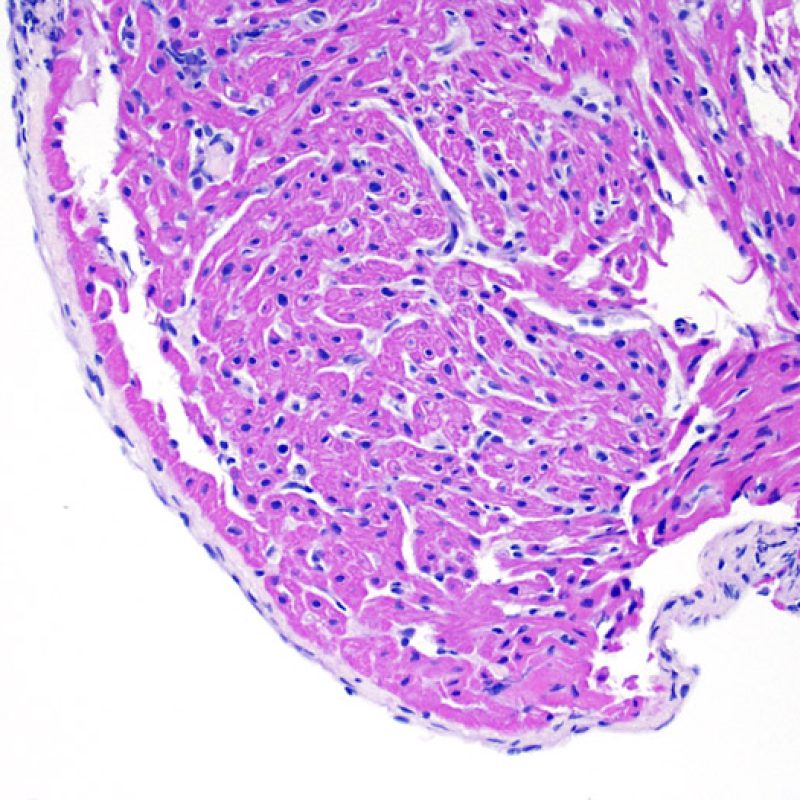
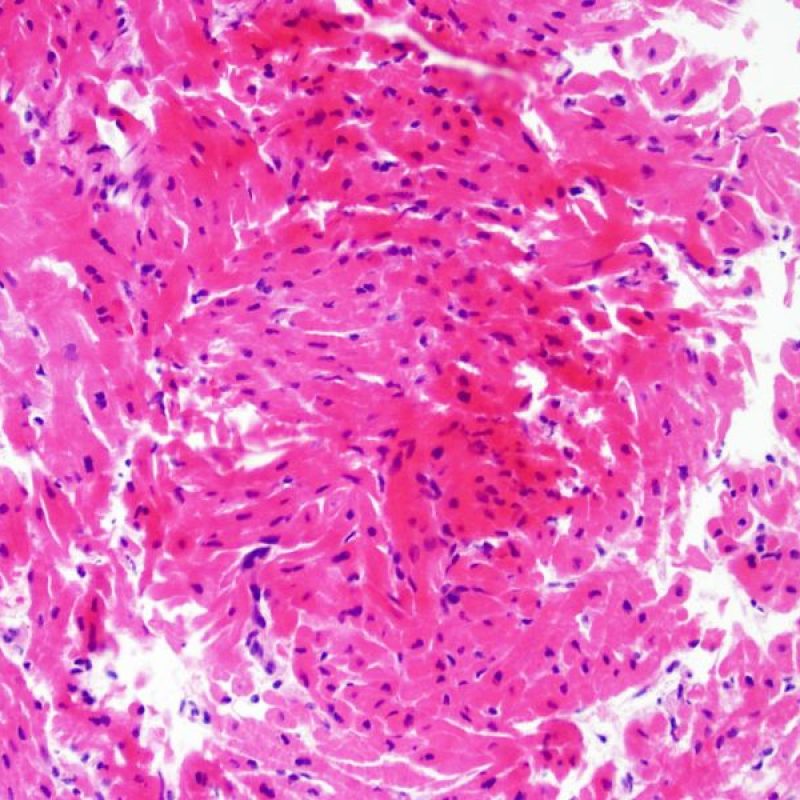
概説
心血管病理学会、欧州心血管病理学会の心内膜心筋生検チュートリアルサイトへようこそ。本サイトは心移植後の急性細胞性拒絶反応の際に認められる組織学的所見について解説しています。病理医が心筋生検標本の組織所見を理解し、正しく解釈できるよう教育することが主たる目的です。
本チュートリアルは、計7個のセクションにより構成されており、心内膜心筋生検のあらゆる側面を網羅しています。画面左側の項目をクリックすると、目的のページへ移動します。また、画像はクリックすることにより、すべて拡大あるいは縮小が可能です。実際の症例に関するクイズもバーチャルスライドを用いて用意されており、急性拒絶反応を他の病理所見と混同せず正確に診断できるかどうか自己評価が可能です。
本サイトは文書の起草とその後の編集という2段階のプロセスを経て作成されています。当サイトに掲載されている内容に関しては、作成委員(メンバーはこちらで参照可能)が全責任を負います。また、抗体関連拒絶反応(antibody-mediated rejection; AMR)に関するチュートリアルサイトは現在作成中であり、その詳細についてはここでは取り扱いません。
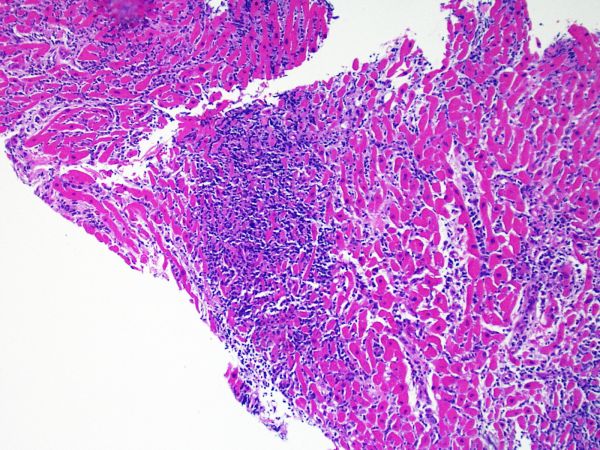
心内膜心筋生検
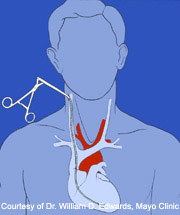
心内膜心筋生検法は、心筋組織を採取するために確立された手技である。通常局所麻酔下に右内頸静脈から生検鉗子を挿入し、三尖弁を通過させ、右心室に到達させる。検体は原則として透視下で心室中隔にて採取される(エコー下で行われる場合もあるが、一般的ではない)。
心筋生検の最も一般的かつ確立された適応は、心臓移植後の拒絶反応(急性細胞性拒絶およびAMR)の診断である。現時点で心筋生検は拒絶反応を確実に診断する唯一の方法であり、移植後数ヶ月間は特に頻回に施行されるが、その後は各移植施設のプロトコールに基づき施行回数は漸減される。

生検標本の作製方法
採取すべき検体数: 国際心肺移植学会(International Society for Heart and Lung Transplantation; ISHLT)は、拒絶反応を適切に評価するために、右室から最低3個の検体を採取するよう推奨しているが、5個採取することにより診断感度がより向上するとの報告もある。採取された検体は別個に収集し、サンプル数を増やす目的で標本に割を入れてはならない。
標本の取り扱い方法: 生検鉗子から取り出した採取検体は、等張食塩水に浸したガーゼの上へ置き、採取後にはできるだけ触れないようにする。ピンセットでの操作も避けるべきである。
組織の処理方法: 移植後の拒絶反応を評価する場合、生検検体は直ちに10%中性緩衝ホルマリンで保存した後、施設のプロトコールに応じてパラフィンに包埋し、薄切した後、染色を行う。AMRの検索のため、施設によっては蛍光抗体法を補助的に行う場合もある。もし蛍光抗体法を行う予定であれば、検体の一つを凍結保存しておく必要がある。
スライドの作成方法: 多くの施設では、3-5μmに薄切された最低3切片のサンプル(ヘマトキシリン・エオジン染色)を載せたスライドを3-4枚作製するが、最大8切片を載せたスライドを作成する施設もある。重要な点は、拒絶反応を適切に評価するためには、最低10切片を観察する必要があるということである。
補助的検査: AMRを検索するため、ヘマトキシリン・エオジン染色に加えてC4dの蛍光抗体法あるいは免疫組織化学法がしばしば補助的に施行される。CD68(組織球マーカー)あるいはC3dを、AMRの検索手段の一部としてルーチンに用いている施設もある。尚、AMRは別のチュートリアルで取り扱う予定である。
検体の評価
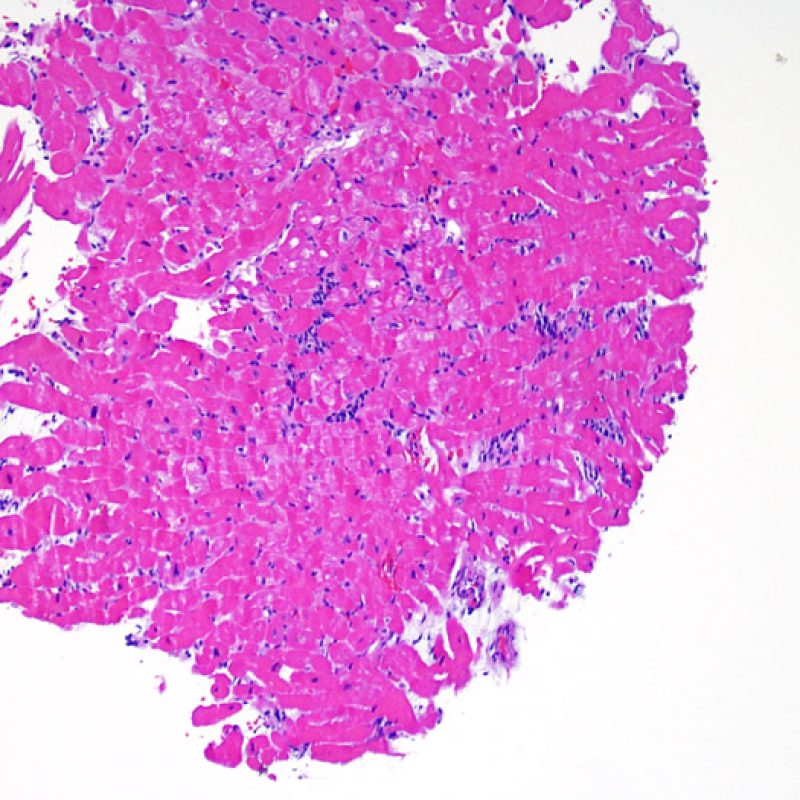
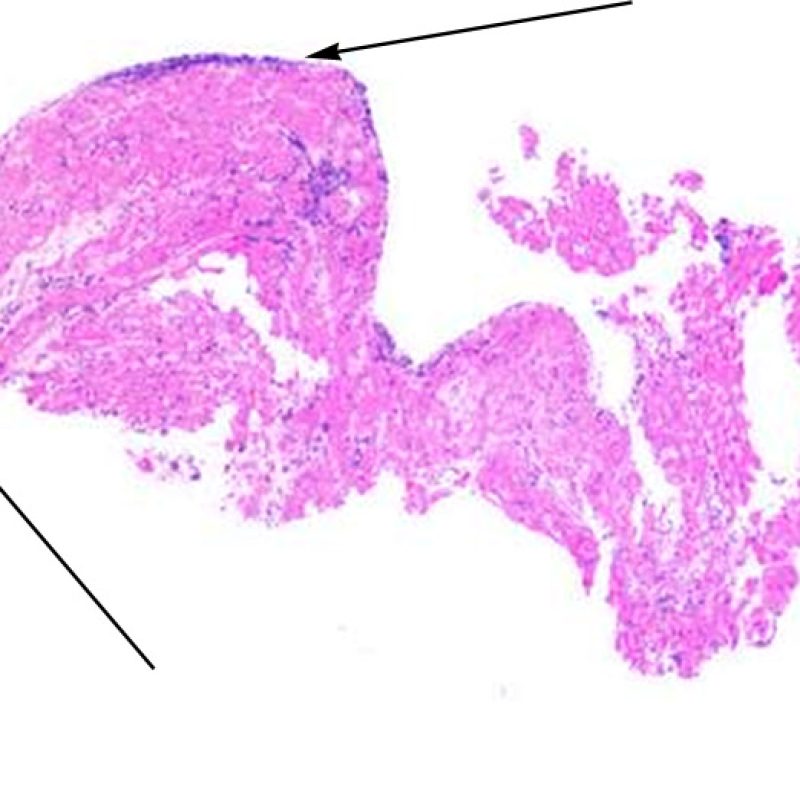
標本に適切な検体として、少なくとも心筋を50%含む組織が最低3個必要である。十分な組織が観察されなかった場合、適切な検体が採取されているか、まずブロックを見直すことが非常に重要である。心移植後の症例は、拒絶の検索のため生検を何度も施行されている場合が多いが、生検鉗子はその構造的な理由により、心室内の同じ領域で繰り返しサンプリングしてしまう傾向にある。このため、線維化や脂肪浸潤などを伴った標本が採取されることがしばしばあり、以前にサンプリングされた部位の肉芽組織や瘢痕組織が観察されることも非常に多い。心筋生検に多くの経験を持つ循環器内科医は、採取検体の色や質感により、心筋を血栓や瘢痕組織と区別することが可能である。
生検標本が不十分な場合どうすべきか:
1.急性細胞性拒絶反応またはAMRが認められた場合には、検体の数に関わらず拒絶反応と評価し、記載するべきである。
2.採取検体が適切な標本としての基準を満たしておらず、かつ拒絶反応が認められない場合、サンプル不足であること、また結果が偽陰性である可能性について記載することができる。

検査結果の報告
治療担当者(通常は循環器内科医)へ効率的に適切な情報を伝えるため、病理報告書は簡潔明瞭に記載し、標準化しなければならない。診断名には拒絶の有無に加え、全体の標本数とその中で拒絶が認められた標本数、Quilty効果の有無、感染症や虚血を示唆する所見が存在したかについても記載することができる。
病理報告書のテンプレートの例はこちら。

診断基準
本セクションでは、国際心肺移植学会(International Society for Heart and Lung Transplantation;ISHLT) により提唱されている急性細胞性拒絶反応の組織学的診断基準(改訂版)を解説する。
概論
1990年、心内膜心筋生検に基づく急性細胞性拒絶反応(acute cellular rejection; ACR)の診断基準が国際心肺移植学会により提唱された。その後この診断基準は2004年に改訂されISHLT-2004、grading は0R、1R、2R、3R の4段階となった。“R”はrevisedを意味し、ISHLT-1990の診断基準(0、1A、1B、2、3A、3B、4)と混同しないよう記載されている。多くの施設ではgrade 0Rや1Rは治療の対照とならず、grade 2Rまたは3Rの拒絶反応に対して免疫抑制剤の増量が行われる。従って、grade 2Rまたは3Rに相当するhigh gradeの病変とlow grade(0Rまたは1R)の病変との鑑別が、病理医の重要な任務となる。

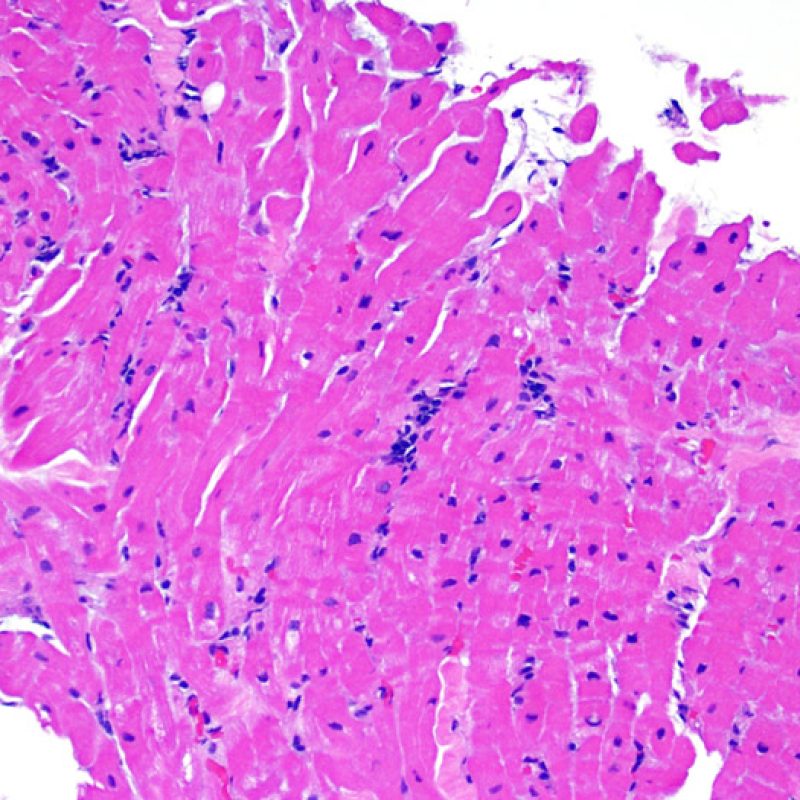
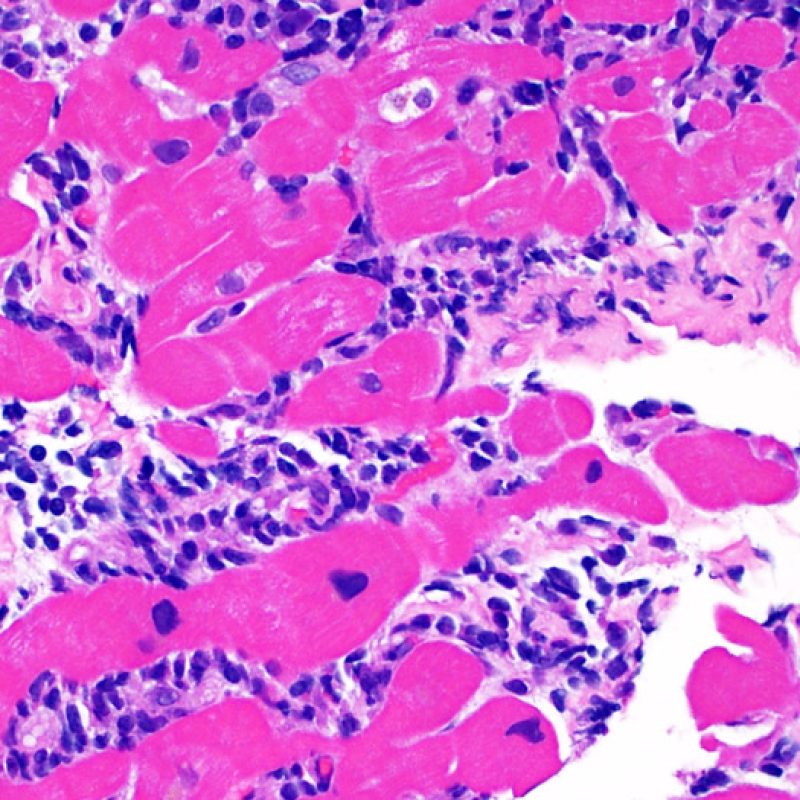
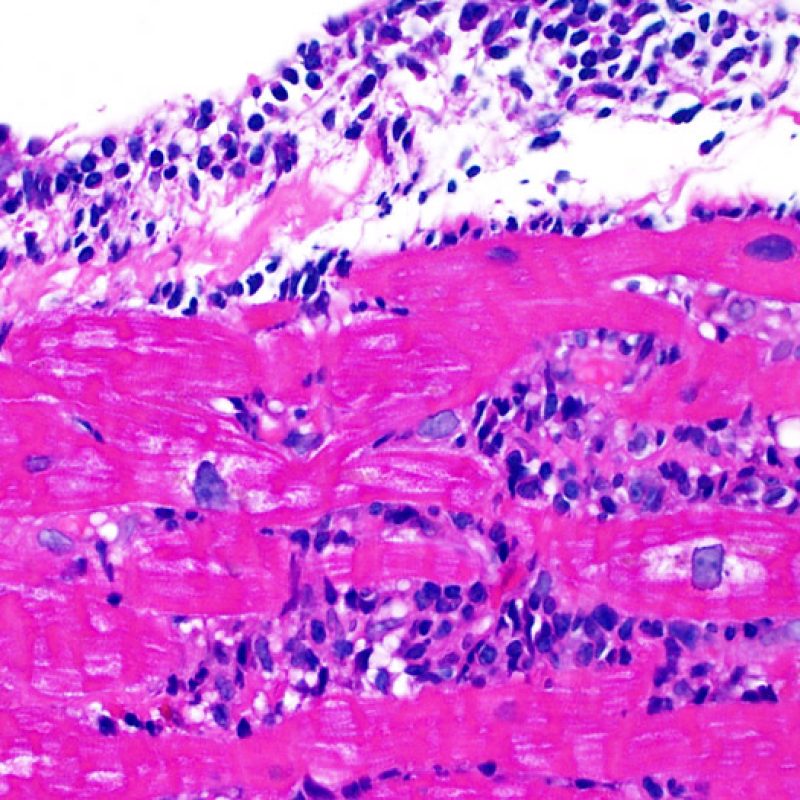
ACRの診断において、リンパ球浸潤および心筋細胞障害の2つが重要な所見である。生検標本には、拒絶反応と紛らわしい所見やアーチファクト、拒絶反応の診断の手がかりとなる所見、他疾患の存在を示唆する所見等、様々な組織像が観察される場合も多いが、生検による拒絶反応の診断は、あくまでも「リンパ球浸潤」と「心筋細胞障害」の2つの所見だけに基づくものであるという認識が重要である。
拒絶反応なし(0R
生検標本にリンパ球浸潤が認められない場合、細胞性拒絶反応がないと判断され、grade 0Rと診断される。原則的に、検体にはほとんど組織学的変化は認められないが、Quilty効果 や 以前の生検による反応性変化等、拒絶反応とは関係のない所見が検体の一部に認められる場合もある。これらは拒絶反応のグレード判定には含まれず、別個に記載する。
軽度拒絶反応(1R)
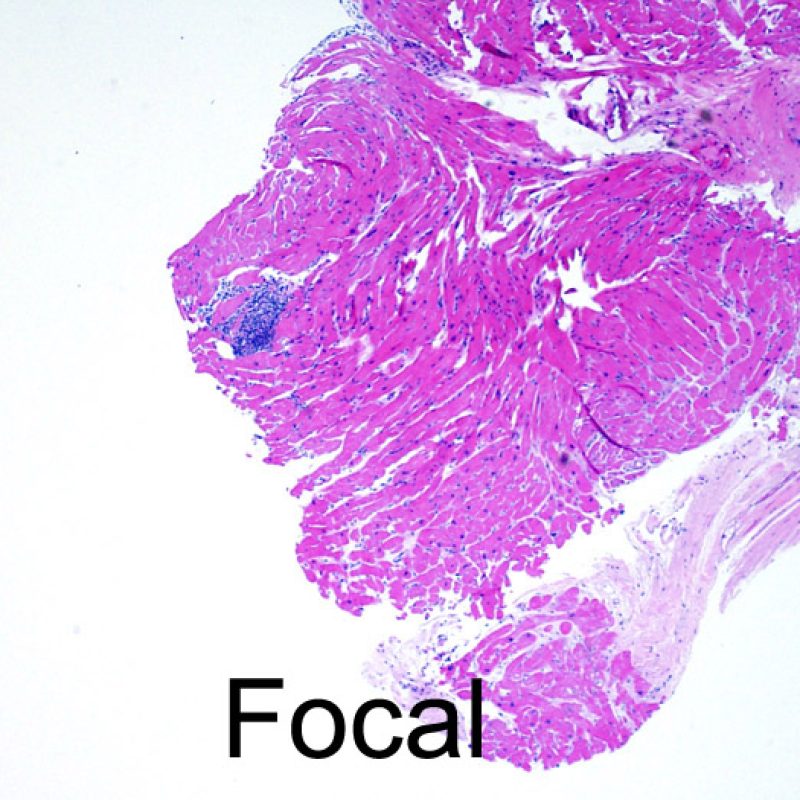
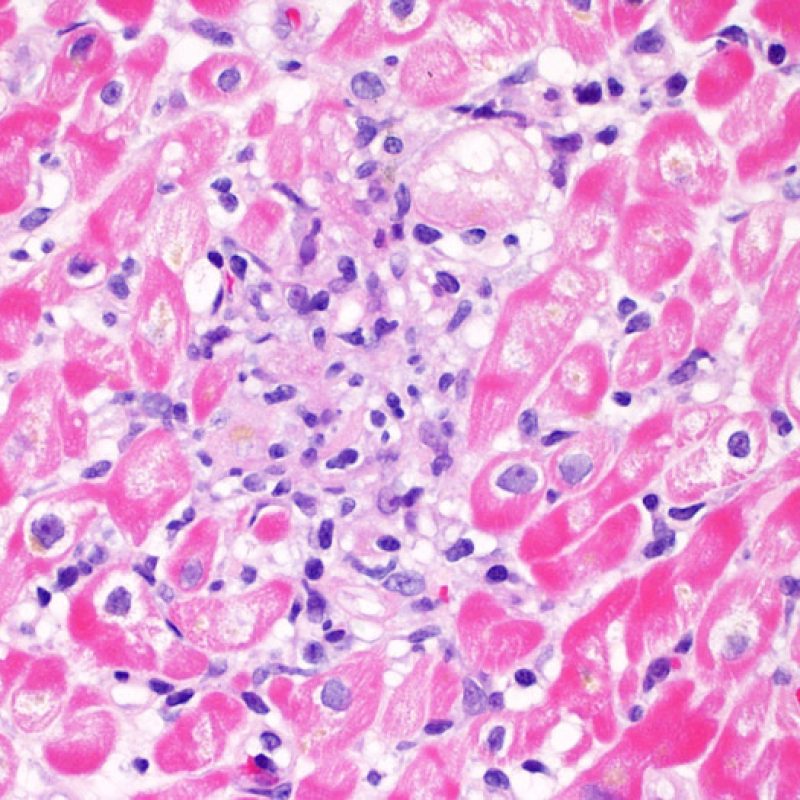
Grade 1Rは、間質あるいは血管周囲へのリンパ球浸潤を認め、かつ心筋細胞障害が局在性(一箇所まで)のものと定義される。この基準は多様なパターンかつ様々な程度のリンパ球浸潤を含むため、生検標本の多くはこの範疇に属する。リンパ球浸潤の程度は、血管周囲にごく少数のリンパ球が認められるものから、広範囲に浸潤が認められるケースまで様々であり、grade2Rと同程度の炎症が認められる場合もあるが、心筋細胞障害がただ一箇所のみであるならばgrade1Rと診断される。通常、grade 1Rの標本に好酸球や好中球は認められない。生検標本上に認められる心筋細胞障害が一箇所だけの場合、採取検体の問題による過小評価の可能性や Quilty 効果 の一部である可能性を考慮する必要があり、その診断は非常に困難となる。このため、Grade 1Rの基準を満たす生検標本にリンパ球の密な集族や局在性の心筋細胞障害が認められた場合には、その旨を臨床医へ報告することが望ましい。
中等度拒絶反応(2R )
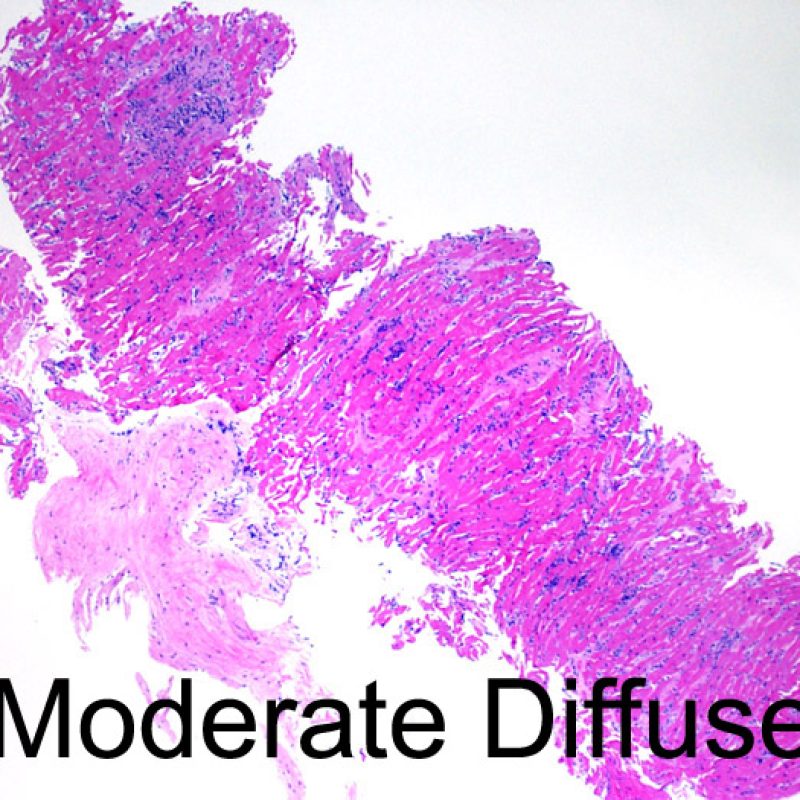
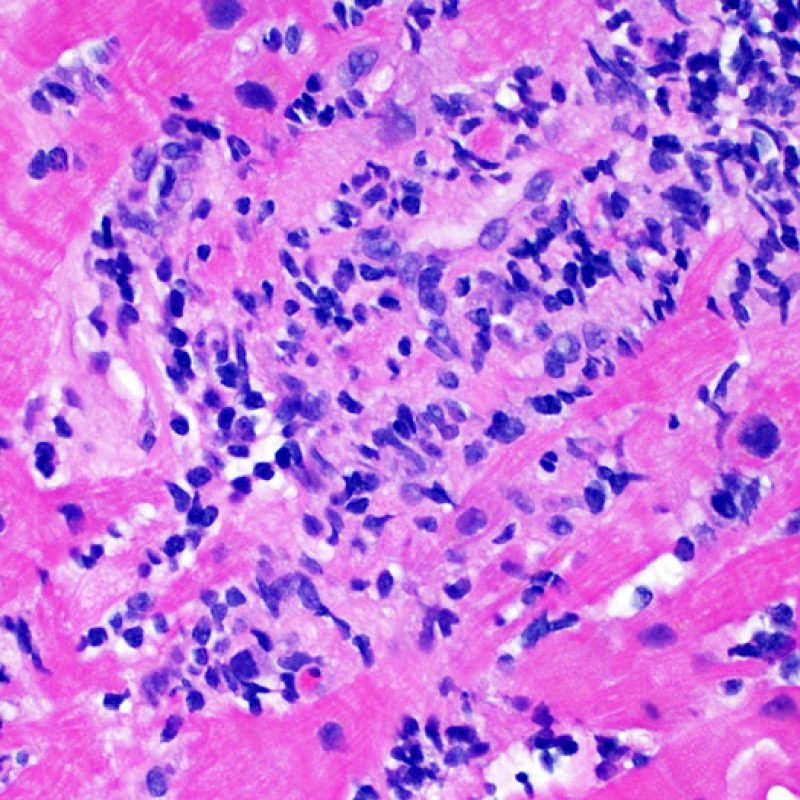
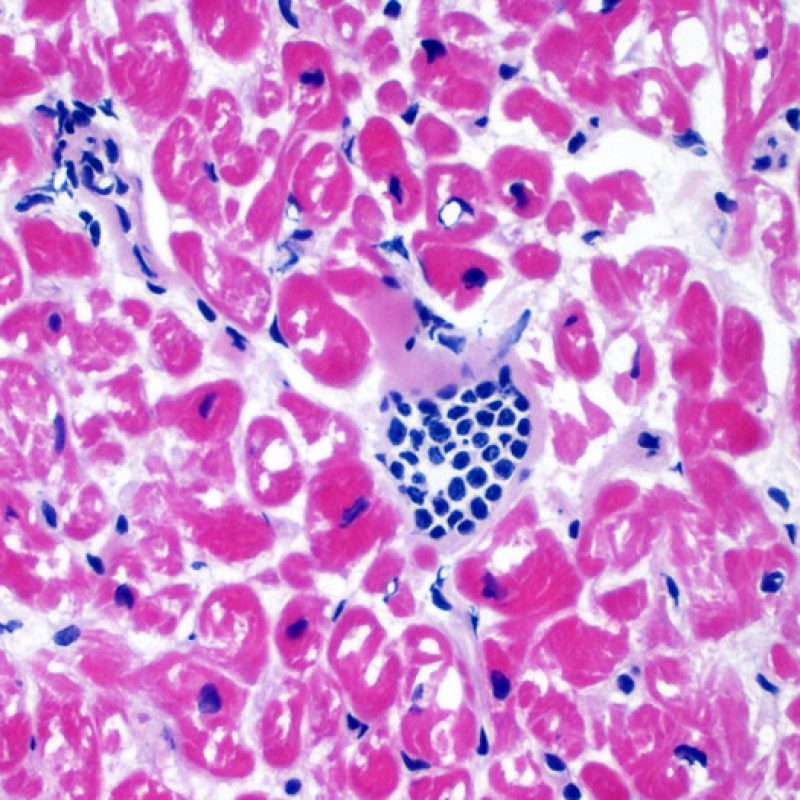
炎症細胞浸潤巣の2箇所以上が心筋細胞障害を伴っている場合、grade2Rと診断される。その異なった浸潤巣は、同一の、または複数の標本において認められるが、異なる深さの薄切面において認められる場合もある。一般的に、心筋細胞障害が2箇所以上認められるケースには、少なくとも中等度以上のリンパ球浸潤が標本全体に認められる場合が多い。逆に、びまん性の炎症細胞浸潤巣が存在しない場合、心筋細胞障害を過大評価している可能性を考慮すべきであり、拒絶反応と紛らわしい病変 との鑑別が必要となる。生検でgrade2R以上の拒絶反応が認められた場合、治療が速やかに開始されるよう、臨床医へ直接結果を報告することが望ましい。
重度拒絶反応(3R )
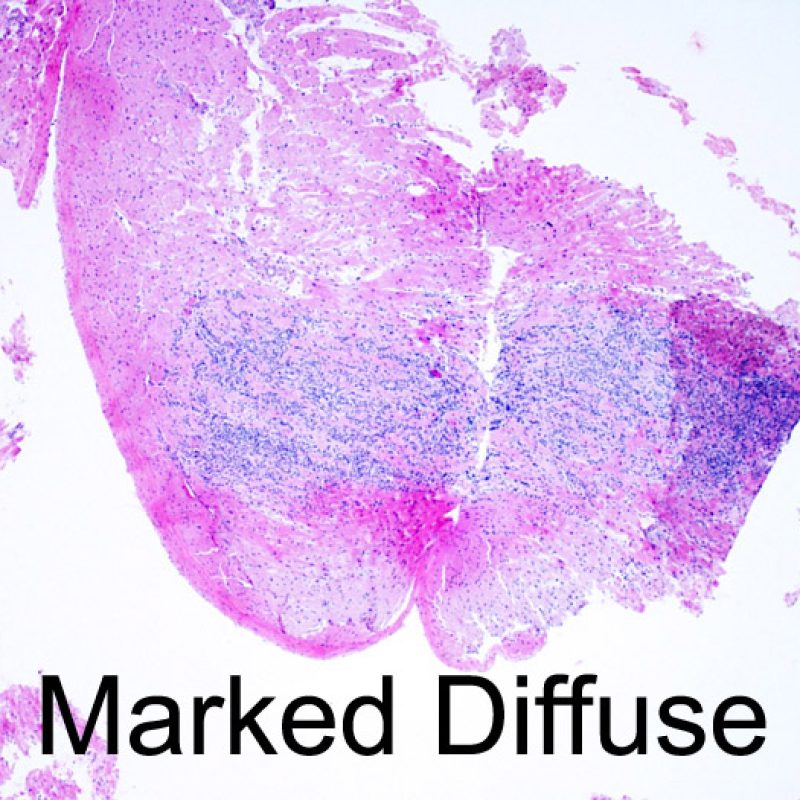
Grade3Rはびまん性の心筋細胞障害を呈し、各々の心筋細胞障害を区別するのは困難である。多数の好酸球や好中球を含む、非常に高度の炎症細胞浸潤が標本全体に認められ、浮腫や出血、血管炎が観察される場合もある。現在の治療プロトコールではgrade 3Rの拒絶反応が生じることは非常に稀であるため、grade3Rが認められた場合には、患者が内服薬を自己中止した可能性が最も高い。通常grade3Rの拒絶反応は心機能の低下を伴うため、迅速に治療が開始されるよう、生検結果を臨床医へ直接報告することが推奨される。
抗体関連拒絶反応
抗体関連拒絶反応(Antibody mediated rejection;AMR、またはhumoral rejection)はACRとは別の拒絶反応である。ただし重度のAMRの場合、組織学的所見がACRと重複する場合もある。光学顕微鏡では、毛細血管内皮細胞の腫大、血管内のマクロファージの集族、間質の浮腫が認められるが、一般的には補体C4dの染色もAMRの検索に併用される。AMRに焦点を絞った別のチュートリアルは、間もなく閲覧可能となる予定である。
1990年基準と2004年基準における相違点
前述のように、ISHLTは過去に2種類の診断基準を提唱している。臨床的予後に違いがないと報告されている1Aと1B 、3Bと4 (1990年基準)は、2004年基準では簡素化され、それぞれ同一グレードにまとめられた。最も議論を呼んだ変更点は、1990年基準のgrade 2(局在性の心筋細胞障害あり)が2004年基準の1 Rに加えられたことである。何故なら、grade 2(1990年基準)とgrade 1R(2004年基準)の症例に対して、免疫抑制剤の増量あるいは経過観察のどちらを治療法として選択するかという点が、各移植施設により異なるためである。従って、生検標本に心筋細胞障害をただ一箇所に認めた場合、直ちに臨床医へ報告すべきか否かの判断は、各施設に委ねられる。
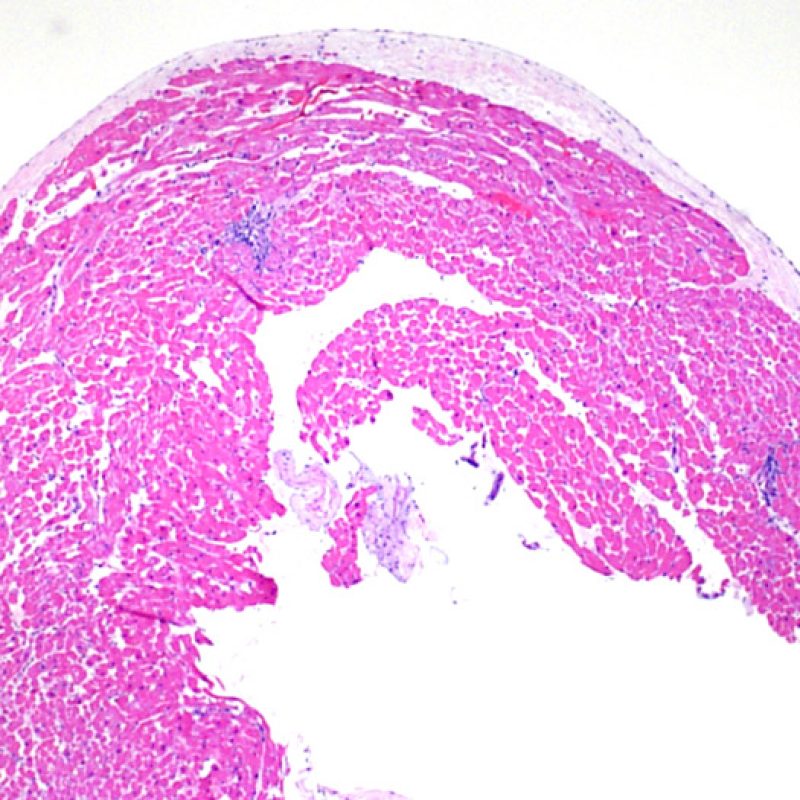
低倍率での観察
本セクションでは、低倍率(2倍~10倍)での観察(細胞密度、間質、心筋細胞、血管など)について解説する。
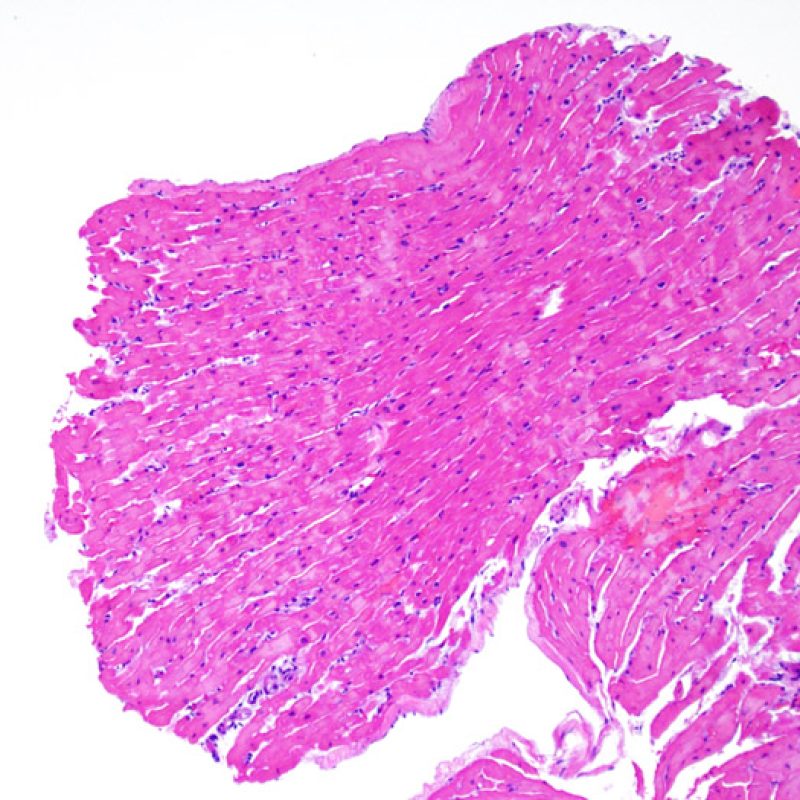
適切な生検標本
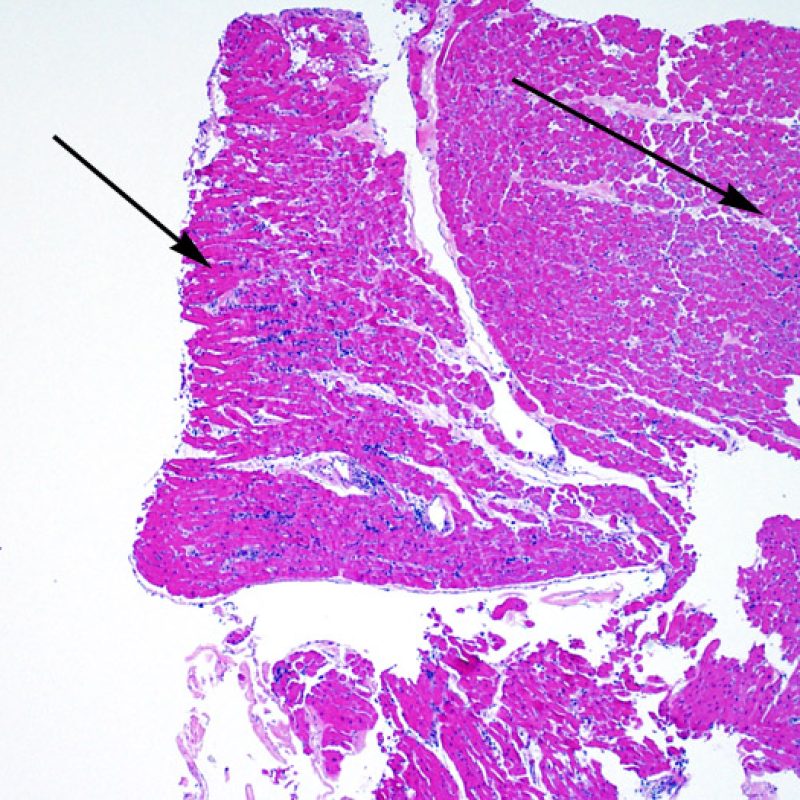
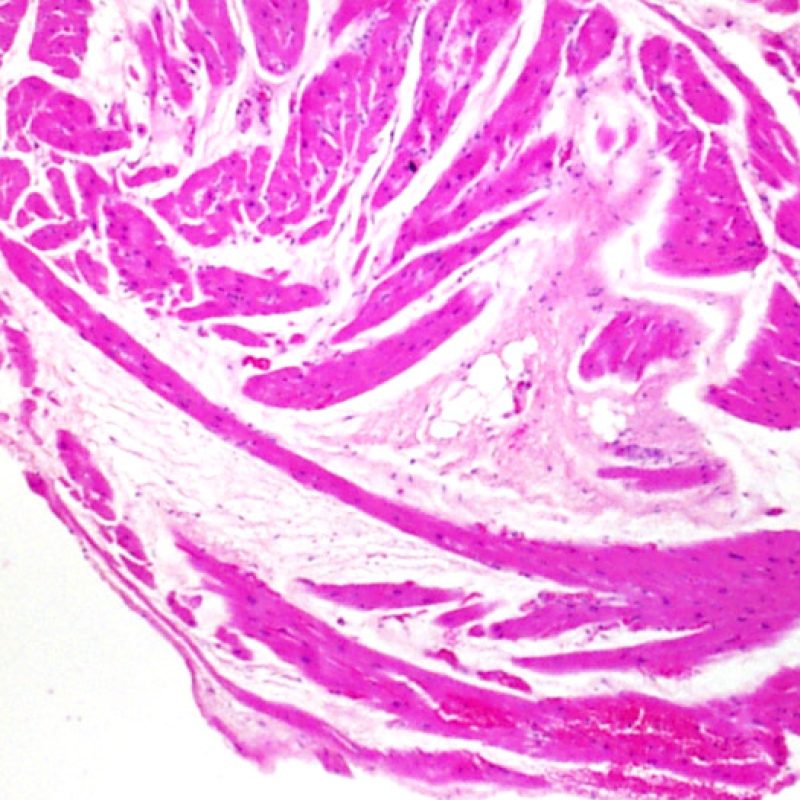
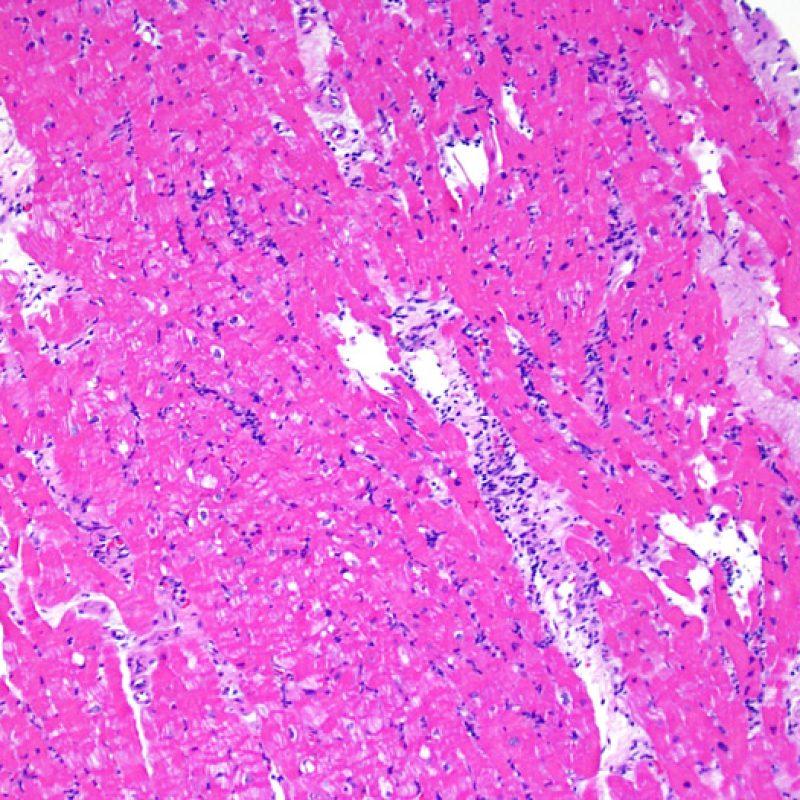
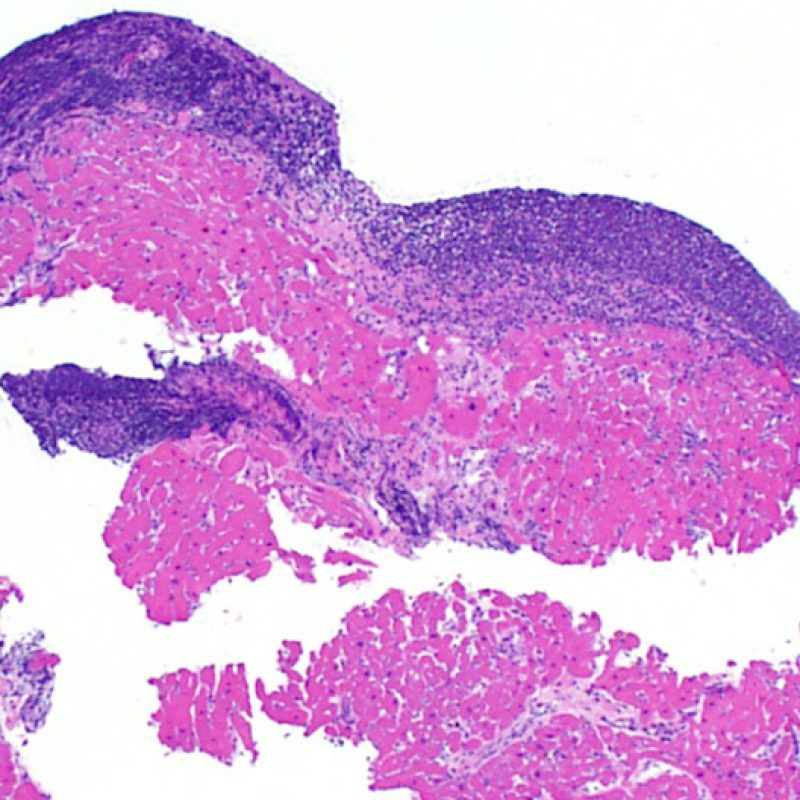
低倍率で最初に観察すべきことは、拒絶の評価に適切な心筋が採取されているかである。心移植後の症例は、拒絶の検索のために生検を何度も施行されている場合が多く、標本の一部あるいは全体に、以前生検を行った部位の組織が含まれる場合がある。例えば、器質化血栓や肉芽組織、線維化(心筋細胞を含まない場合と配列の乱れた心筋細胞を含む場合がある)が認められる場合、その標本は過去に生検を行った部位から採取されている可能性が高い。 適切な評価, のためには最低3個の組織が必要であり、各々の組織が以前の生検による影響のない心筋を、少なくとも50%以上含む必要がある。心筋以外の組織(弁, 腱索, 脂肪組織など)が認められた場合には、その旨も記載する。
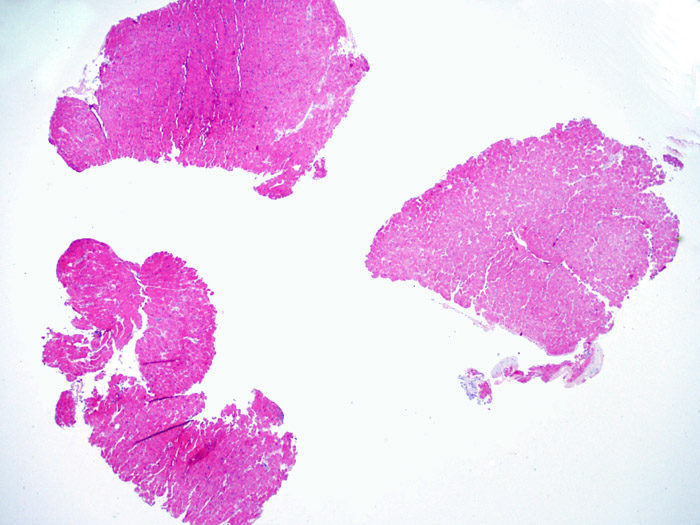
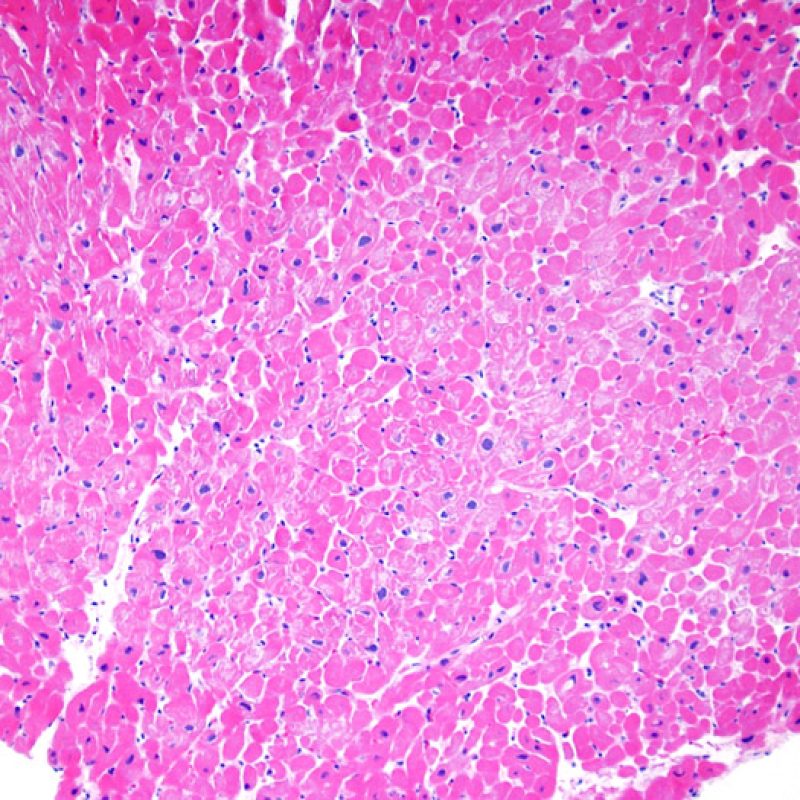
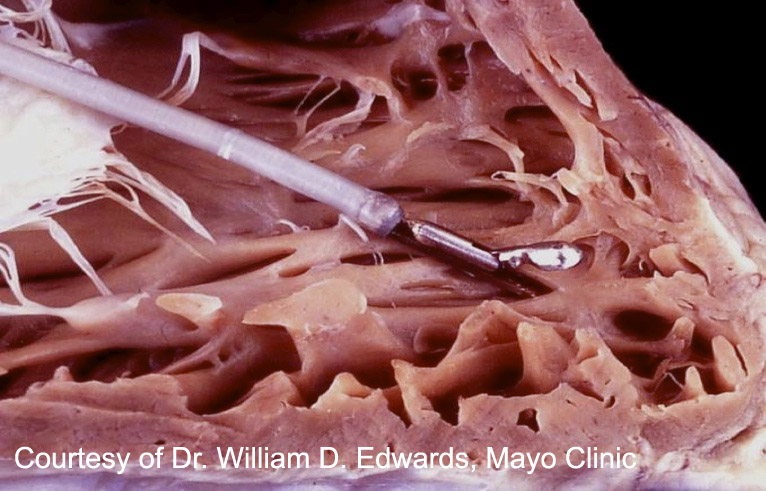
生検標本の細胞密度
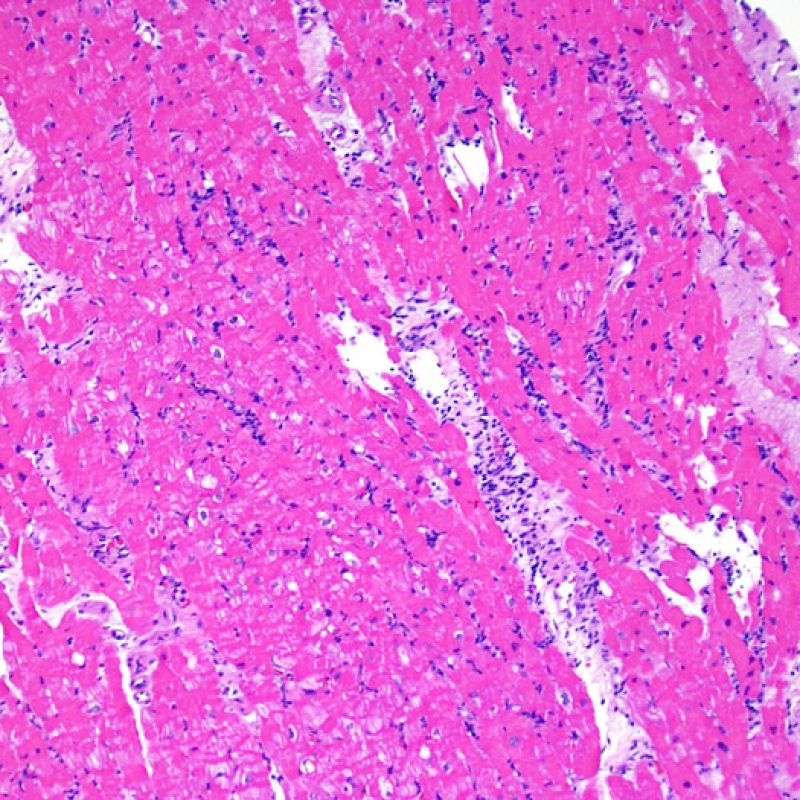
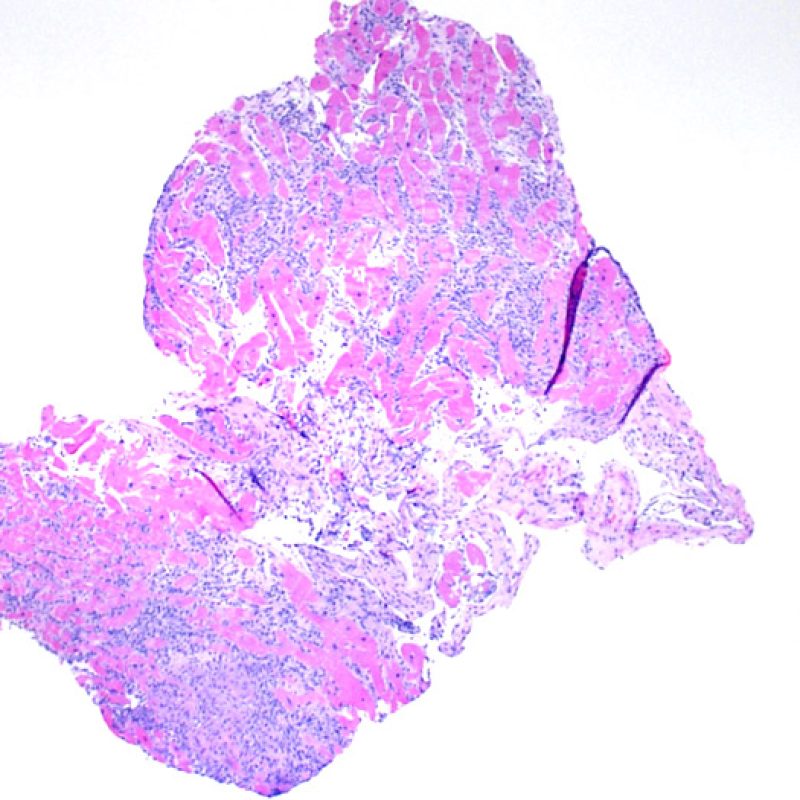
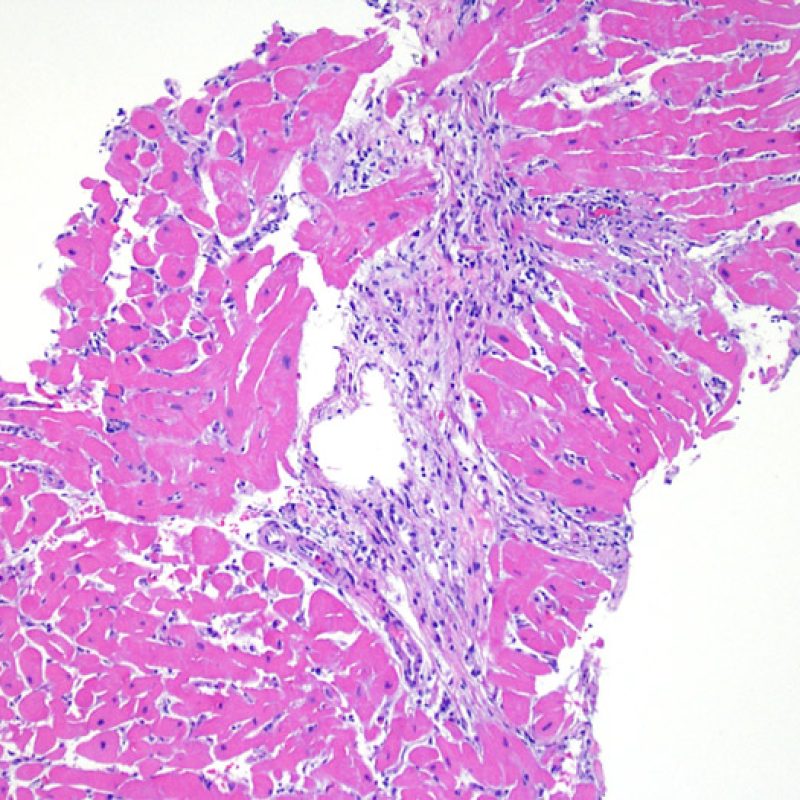
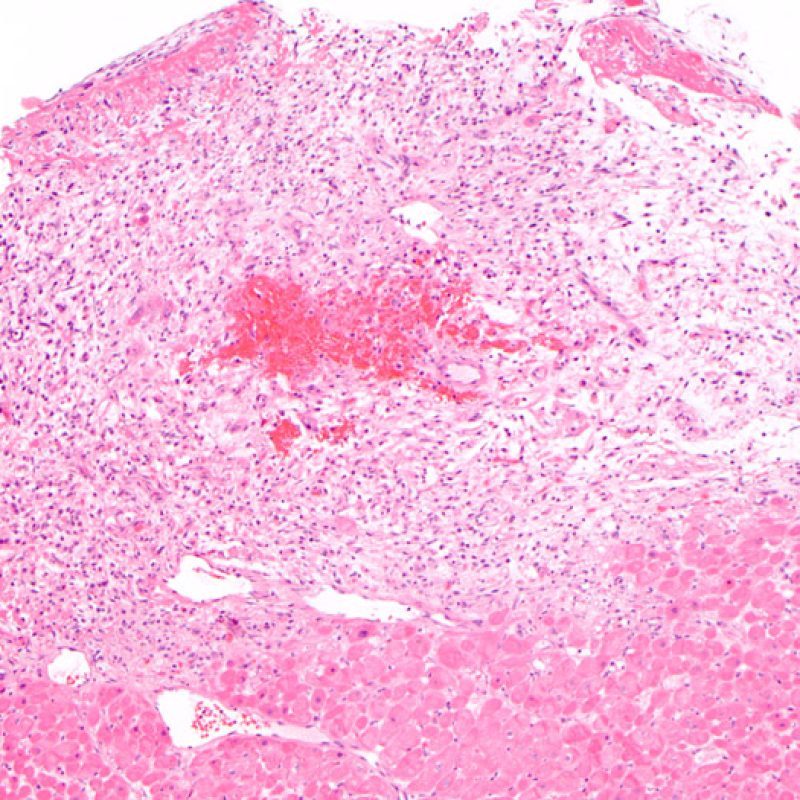
適切な生検標本が採取されていることを確認した後、低倍率で評価すべき主要な点は、1)細胞成分の増加の有無、2)細胞浸潤の部位とパターン、3)細胞浸潤の全体的な印象、4)高倍率で評価すべき部位、すなわち細胞密度が増加している部位の特定である。急性細胞性拒絶反応の際に認められる組織像はさまざまであるが、最も高度な病変部位を同定するには低倍率での観察が適している。正確な診断のためには、組織の深さを何段階か変えて標本を作製して評価することが重要である。
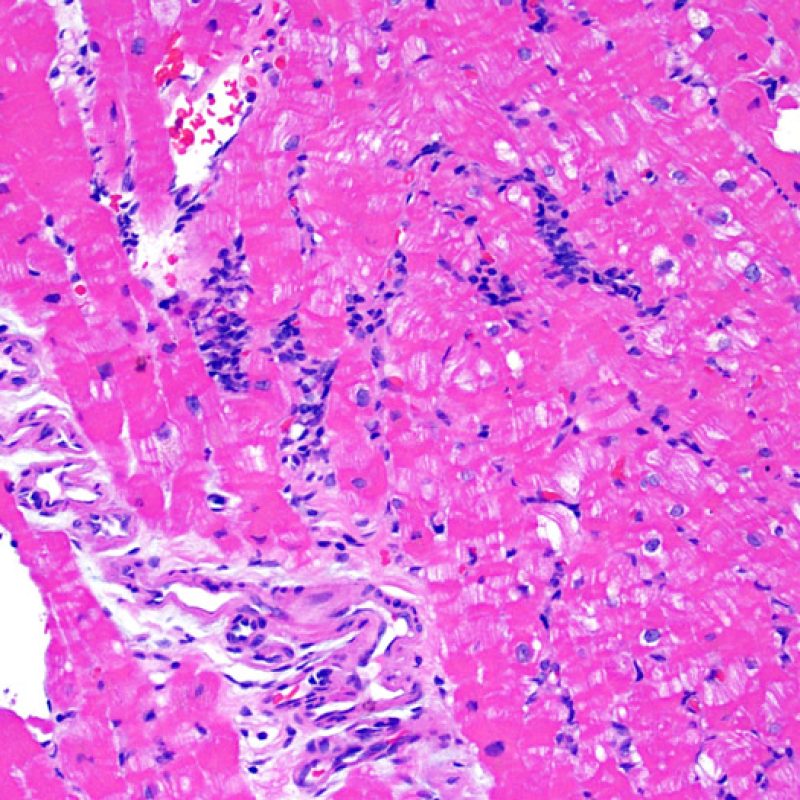
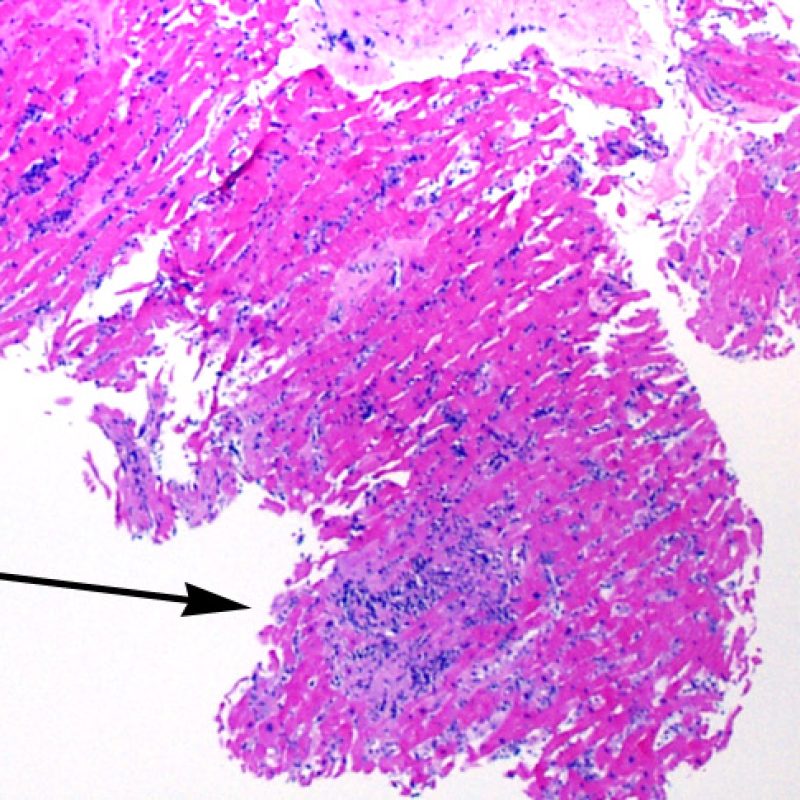
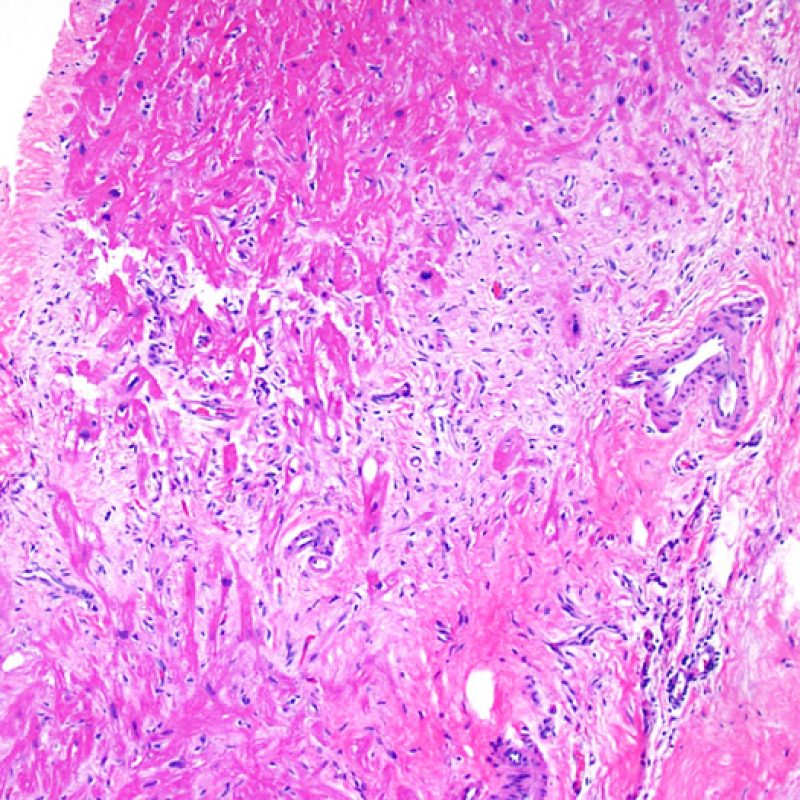
生検標本における細胞密度の増加は、通常容易に同定可能である。炎症細胞浸潤は局在性あるいはびまん性の分布パターンを示すが、炎症が血管周囲性であるのか、あるいは心筋細胞間に金網状(“chicken wire fence”pattern)にびまん性に入り込むパターンであるのかについても、低倍率で評価可能である。ただし、他の多くの形態学的特徴の評価と同様に、これらの所見は主観的な評価に基づく場合も多い。
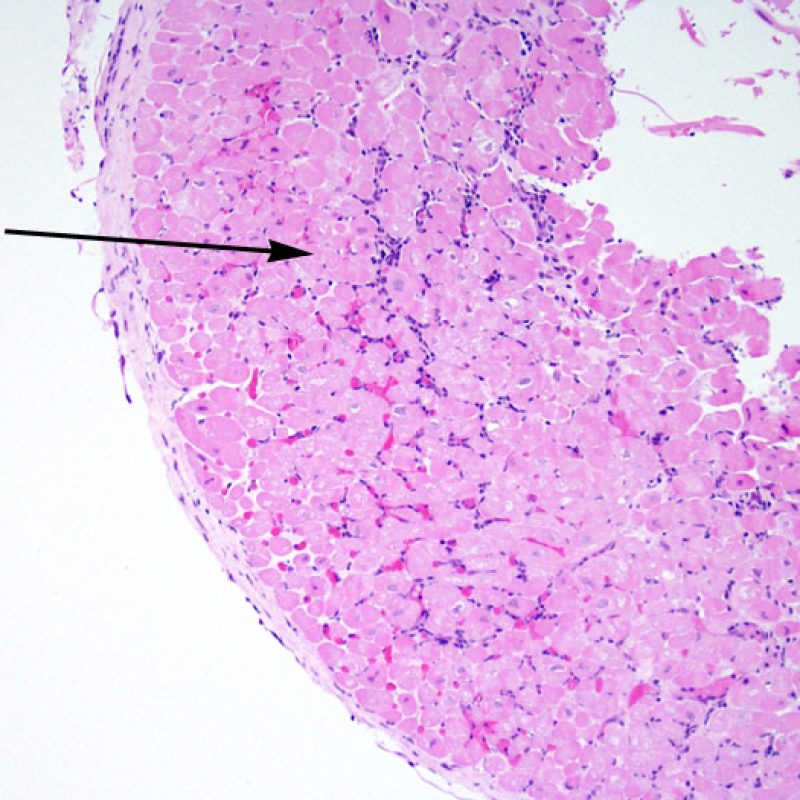
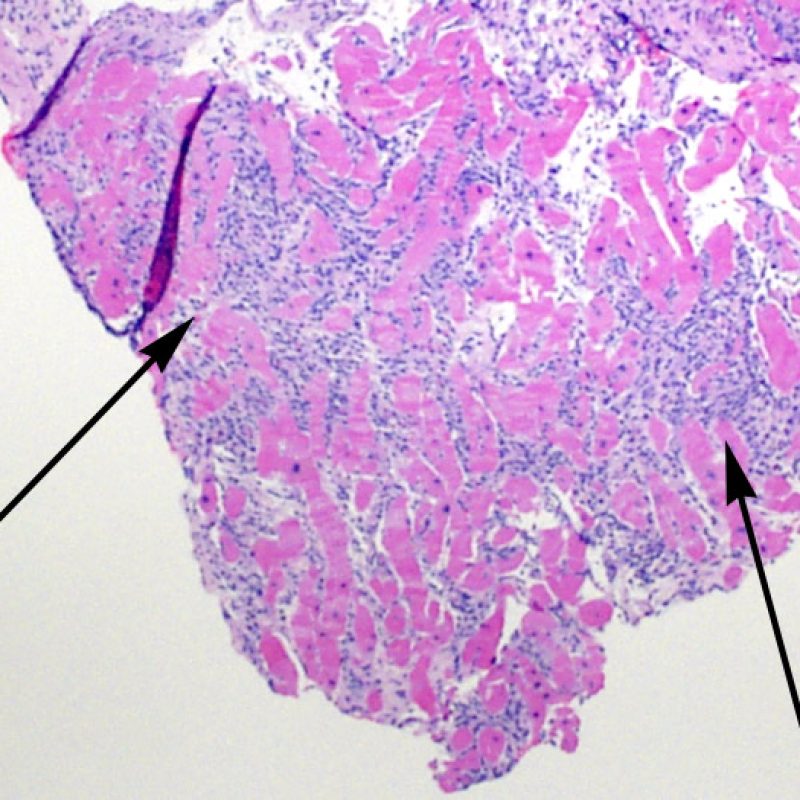
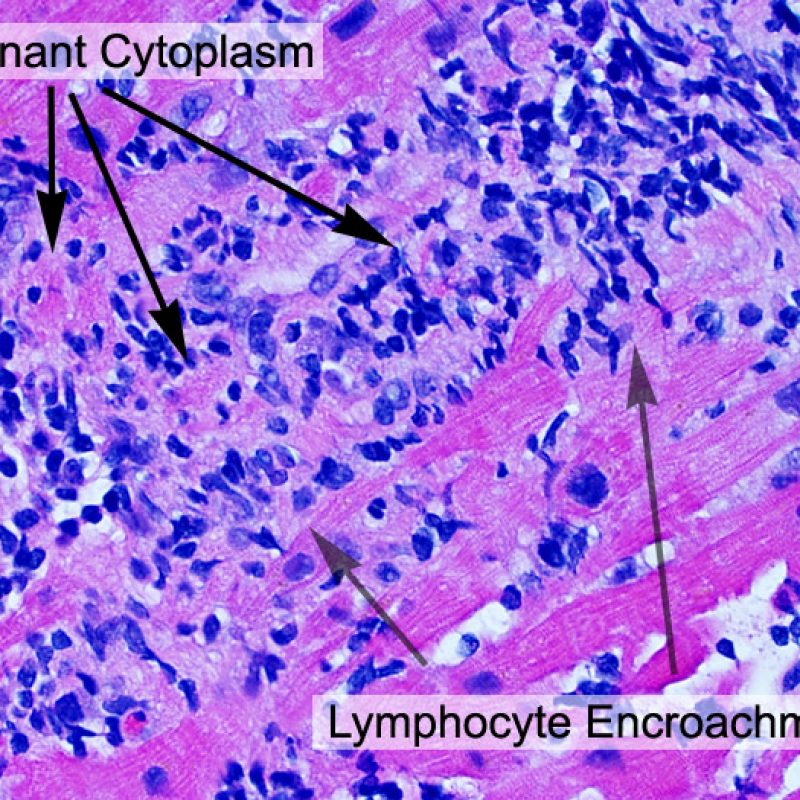
炎症細胞浸潤の部位、およびそれらの心筋細胞への影響を評価することにより、基本的な病態を把握することが可能である。急性細胞性拒絶反応(ACR)の際、リンパ球浸潤は心筋細胞の周囲 や血管周囲に認められる。心内膜あるいは線維組織に炎症が存在する場合、虚血性傷害, Quilty 効果 あるいは以前の生検部位 が採取された可能性を考慮する必要がある。心内膜の表面やその近傍にリンパ球浸潤が観察される場合、ACRとQuilty効果との鑑別は困難となるが、高度のACRは心筋細胞周囲に細胞浸潤を伴う傾向にあることが鑑別の手がかりとなる。
心内膜に沿ってリンパ球の大結節性集簇巣をみた場合、”Quilty効果” とよばれる。Quilty効果は心内膜に限局する場合と心筋層に進展する場合があるが、心筋層に向かって膨隆するように浸潤し、周囲の心筋細胞との間に比較的明瞭な境界を示す密なリンパ球浸潤が低倍率で認められた場合、Quilty効果として矛盾しない。リンパ球浸潤を心筋細胞周囲に認めた場合、必ず高倍率で心筋細胞障害の有無を検索する必要がある。
心筋細胞
“心筋細胞傷害” (myocyte injury) には、ごく軽度の退行性変化から細胞死に至るまで、幅広い病態が含まれているが、生検標本におけるその診断は必ずしも容易ではない。心筋細胞障害を正確に診断するためには、高倍率で病変を観察する必要がある。
心筋細胞への炎症細胞浸潤や、炎症細胞が心筋細胞を覆う像が低倍率で観察された場合、心筋細胞傷害と診断される。炎症細胞浸潤により、心筋細胞の境界は不整になり、心筋の構造にも変化が生じる。心筋細胞内あるいは心筋細胞周囲に認められる炎症細胞浸潤をみた場合、その標本をより慎重に評価する必要があることを示している。生検鉗子に挟まれ損傷を受けた組織においては、リンパ球浸潤の評価に注意を要する。
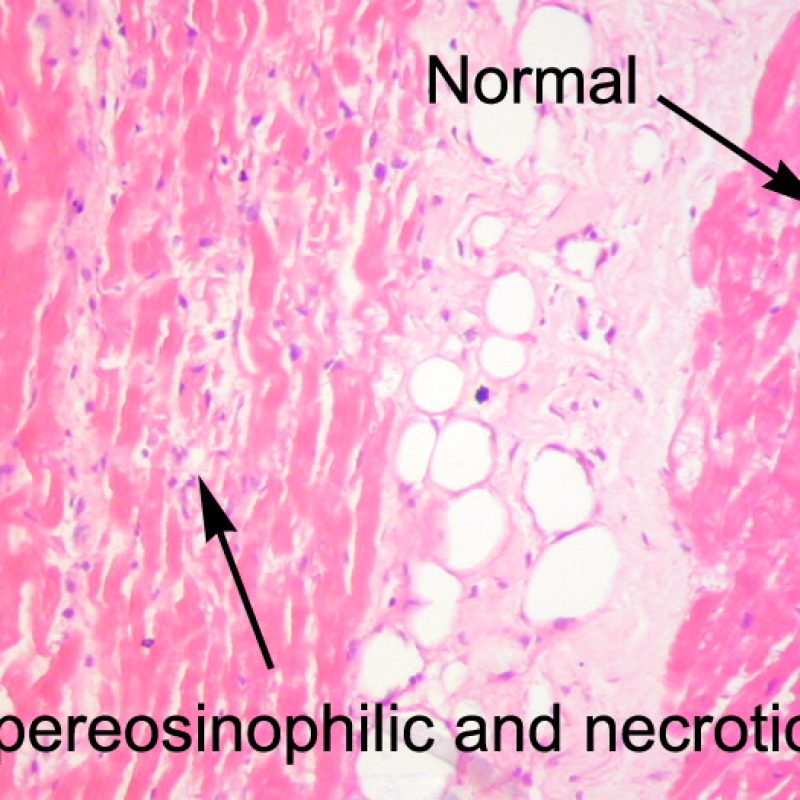
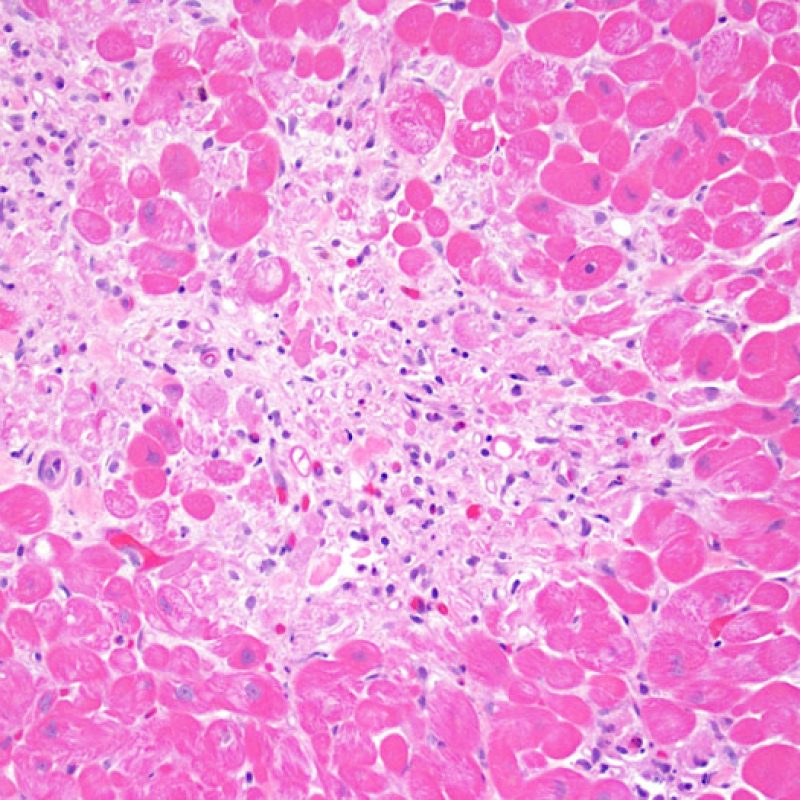
周術期の心筋虚血や慢性期の移植心冠動脈病変に起因する虚血性傷害により、心筋細胞に凝固壊死が生じる場合がある。ごく微小な虚血性障害は、低倍率ではACRとの鑑別が困難なことも多いが、大きな病変は凝固壊死を呈し、心筋細胞は様々な程度に破壊され核が消失するため、その診断は容易である。病変の大きさに関わらず、虚血性病巣はしばしば周囲にマクロファージ、リンパ球、まれに好中球の浸潤を伴う。これらの領域は境界明瞭な放射状の病変として認められる場合もある。壊死に陥った心筋細胞はトリクローム染色により紫色を呈するため、同染色は心筋障害の検出に有用である。
心筋細胞に空胞化が認められた場合、慢性虚血による心筋細胞融解 を反映している可能性がある。アーチファクトとして観察される収縮帯(contraction band artifact), は、心筋細胞融解と紛らわしいため注意を要する。特に低倍率の横断標本において、収縮帯のある濃い色調を呈する心筋と収縮帯の無い薄い色調の心筋が格子状に認められ、薄い色調の部分があたかも融解した心筋細胞のように見える場合がある。このような所見を認めた際には、アーチファクトの可能性も考慮し、慢性虚血の診断は慎重に行うべきである。
間質
前述した 細胞密度の増加 以外に、低倍率で間質に認められる所見は、主に浮腫と線維化である。浮腫は重度のACR(Grade 3R)や心不全、AMRの際に認められ、間質は疎で淡い好塩基性を呈し、血管周囲や心筋細胞周囲のスペースが明瞭となる。これらの所見が認められた場合、抗体関連拒絶反応に関連する血管病変の有無を高倍率で検索する必要がある。切片の作成過程で大小の間隙が心筋細胞間に生じ、浮腫と紛らわしいこともあるが、心筋細胞間に細胞外マトリックス成分がわずかでも存在しない場合はアーチファクトであり、浮腫と混同してはならない。
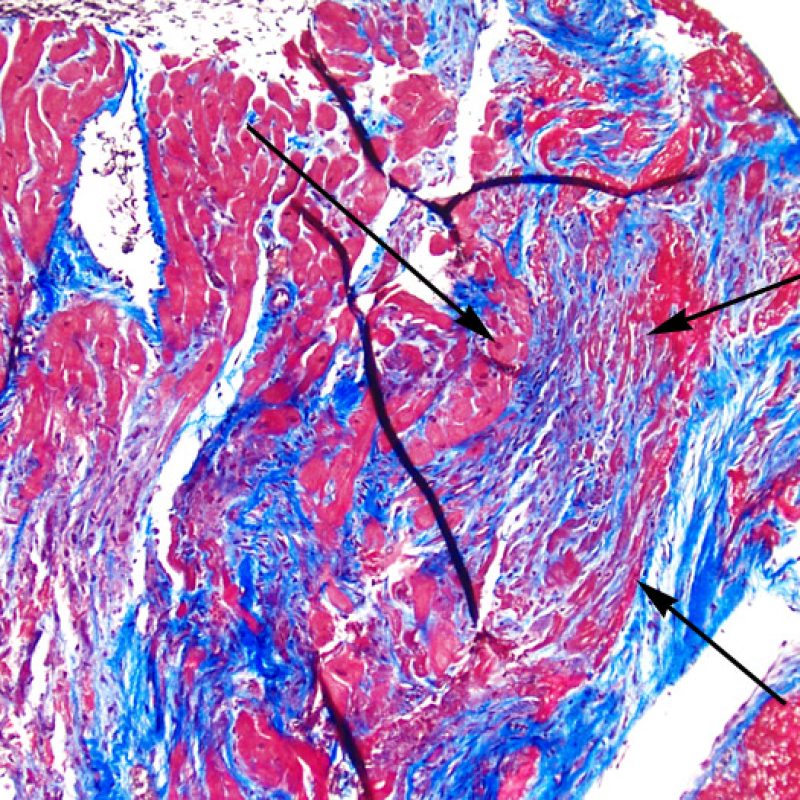
間質の線維化は、心筋が広範囲に脱落した後に生じる置換性線維化であることが最も多く、通常以前の生検部位やその周辺から採取された組織において認められる。 以前の生検部位に生じる組織学的変化 は、すでに別のセクションで解説されている。心筋虚血の治癒後や慢性心筋虚血により生じた瘢痕組織は、以前の生検部位における瘢痕組織との区別が困難である場合が多い。低倍率で放射状の瘢痕組織が認められた場合、引き続き高倍率で慢性虚血を示唆する所見が他にないか検索すべきである。ただし、虚血性病変の有無に関わらず、間質の線維化はACRの特徴的な所見ではない。
Presence of vasculature
アーチファクトにより血管内に別の血管が入れ子状に入り込むと(telescoping of blood vessels). 冠動脈病変と紛らわしい場合もあるが、基本的に心筋生検において移植心冠動脈病変を認めることは非常に稀である。また、標本内に大型の血管とともに脂肪や神経組織が存在する場合、心筋穿孔.を疑い高倍率での評価が必要である。血管病変の観察には高倍率での評価が望ましい。
高倍率での観察
スライドを低倍率(4倍または10倍対物レンズ)で観察した後、炎症細胞浸潤巣を高倍率で観察する。通常は20倍対物レンズを使用し、リンパ球浸潤巣周囲の心筋細胞傷害を検索する。低倍率で問題のない部分に関しては、必ずしも高倍率で観察する必要はない。本セクションでは、心筋細胞傷害、炎症細胞浸潤の同定、および間質に認められる所見等、高倍率での観察について解説する。
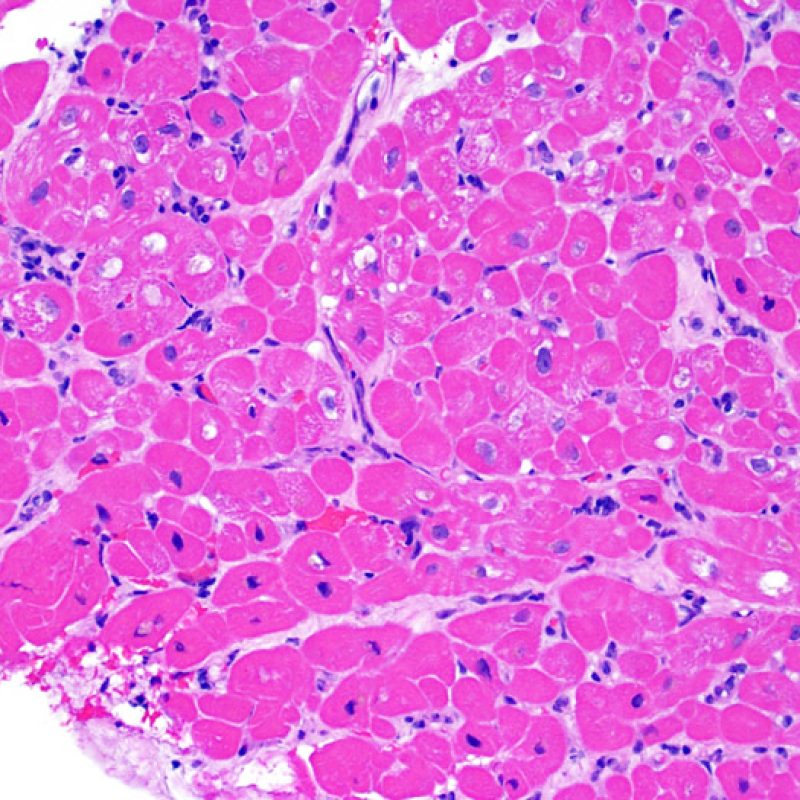
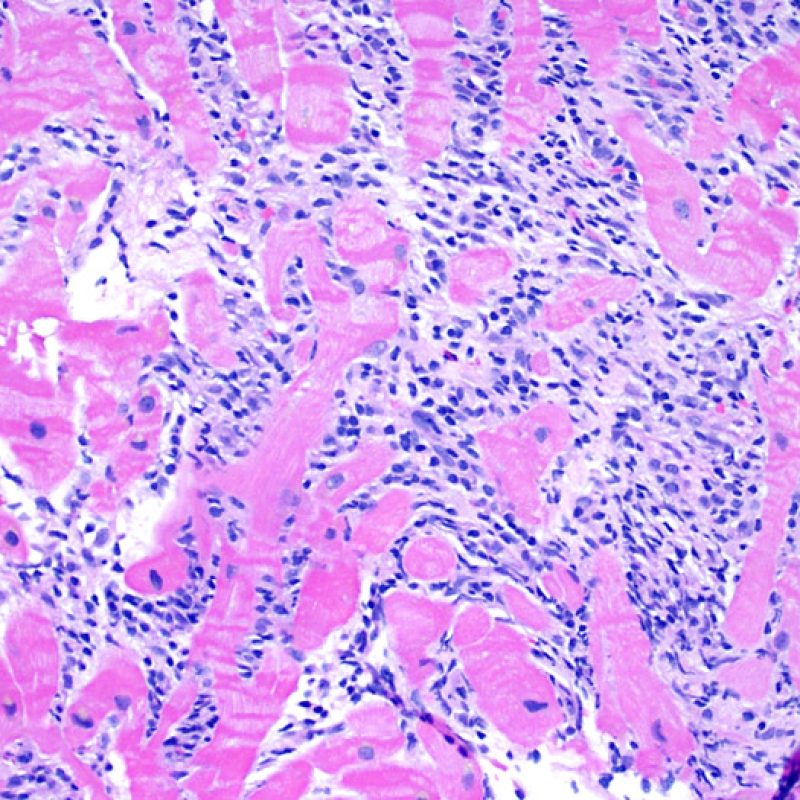
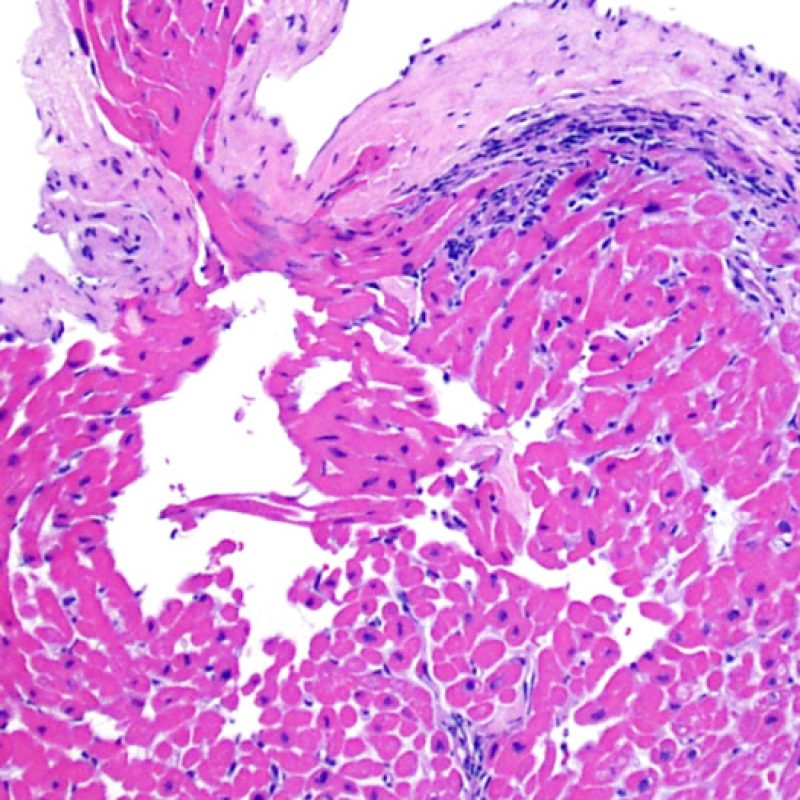
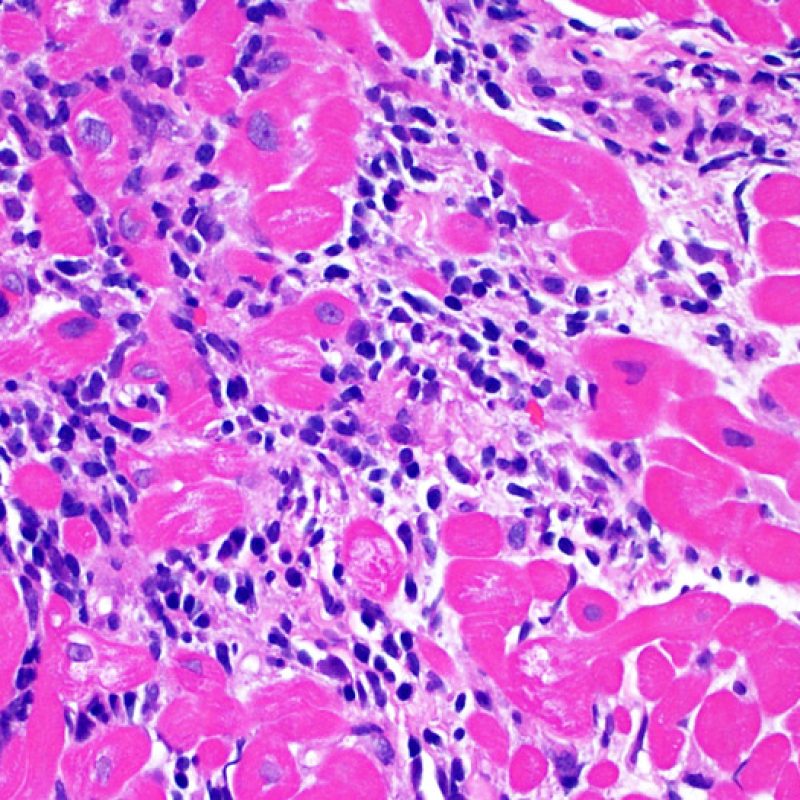
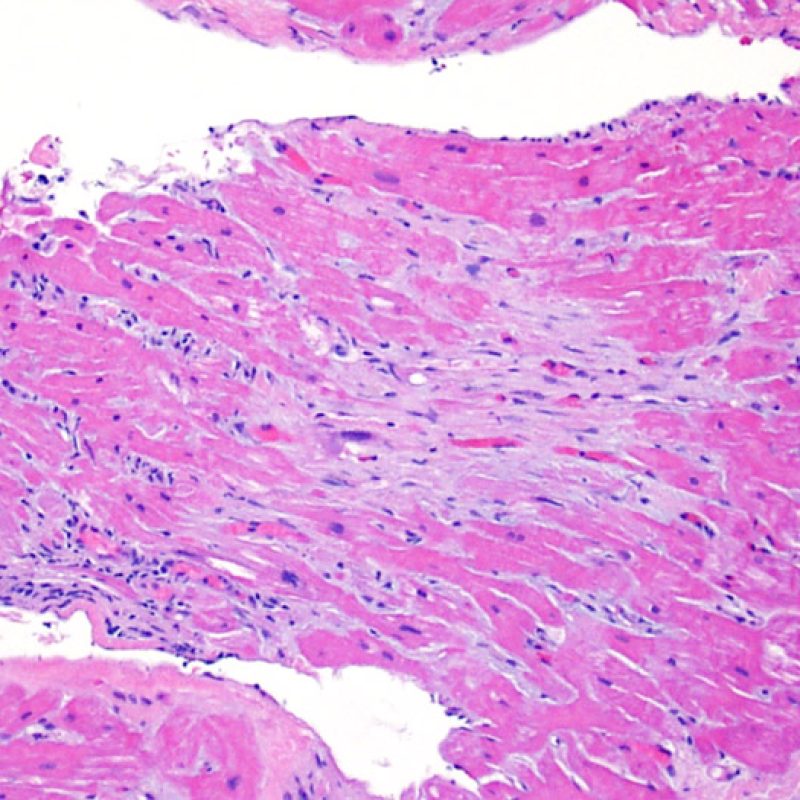
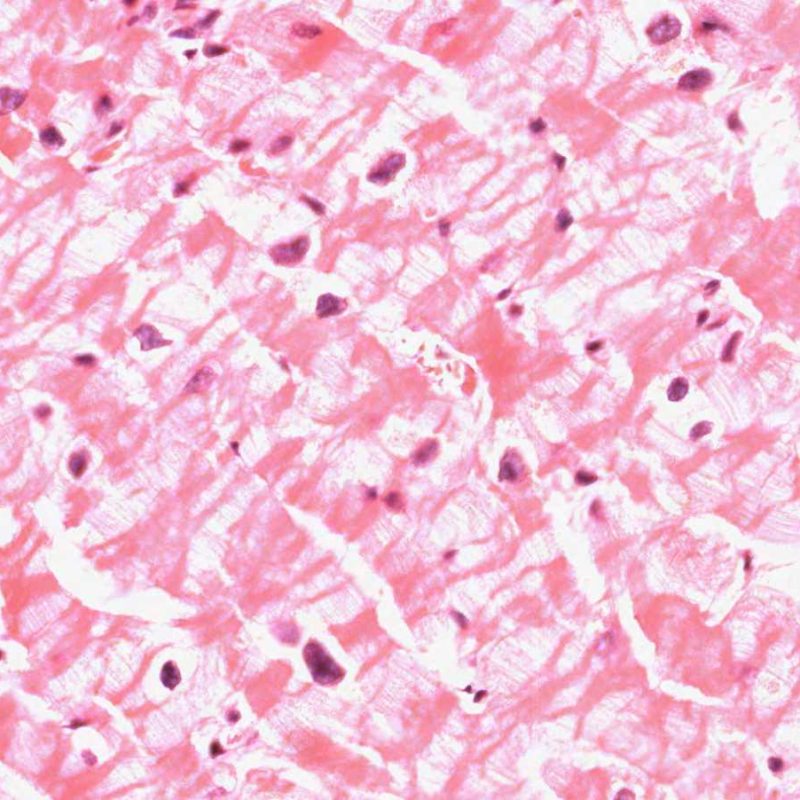
心筋細胞障害の確認
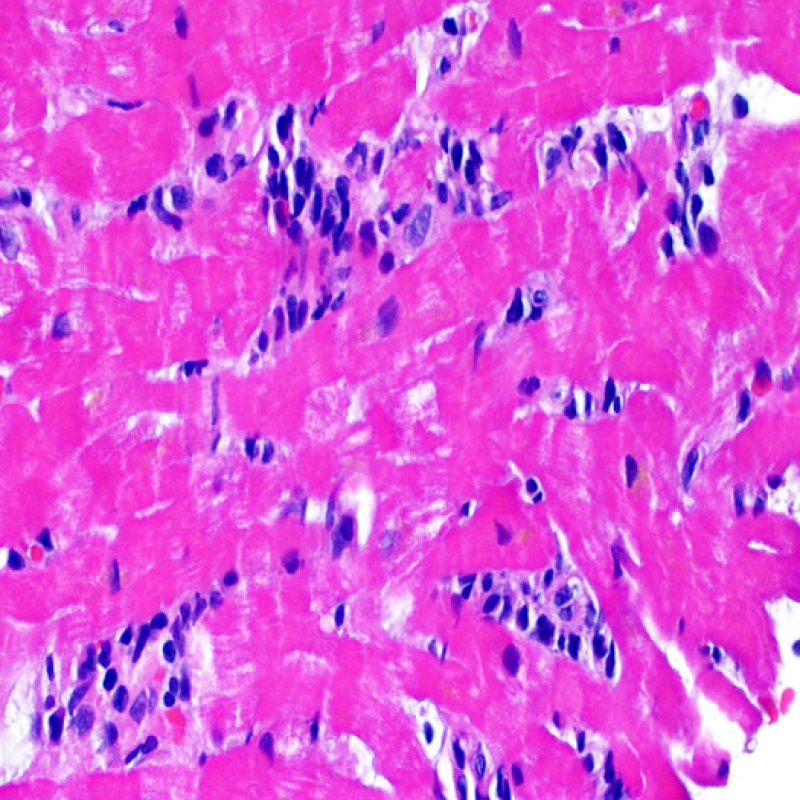
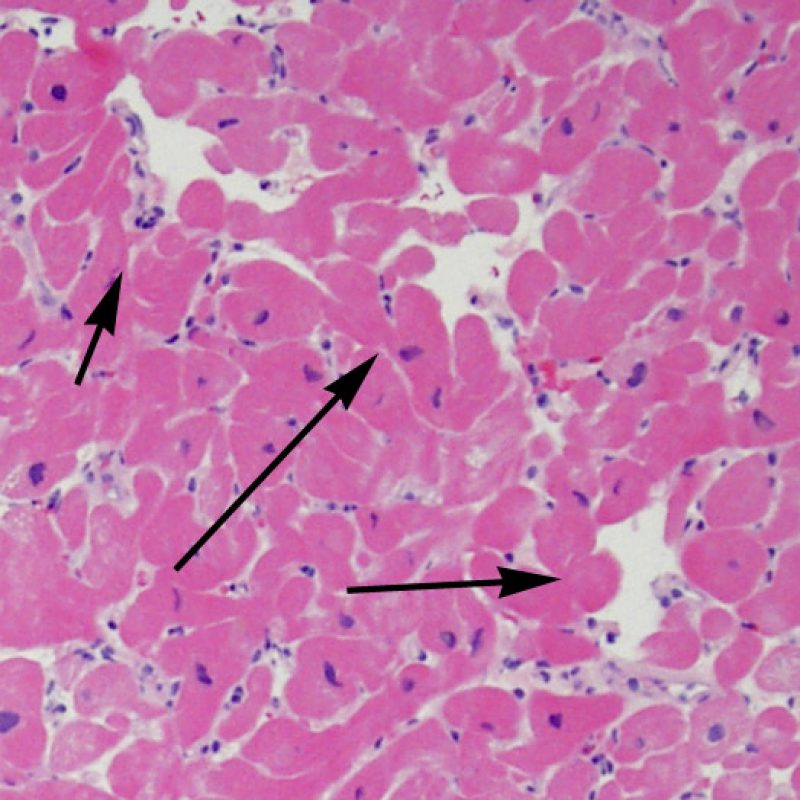
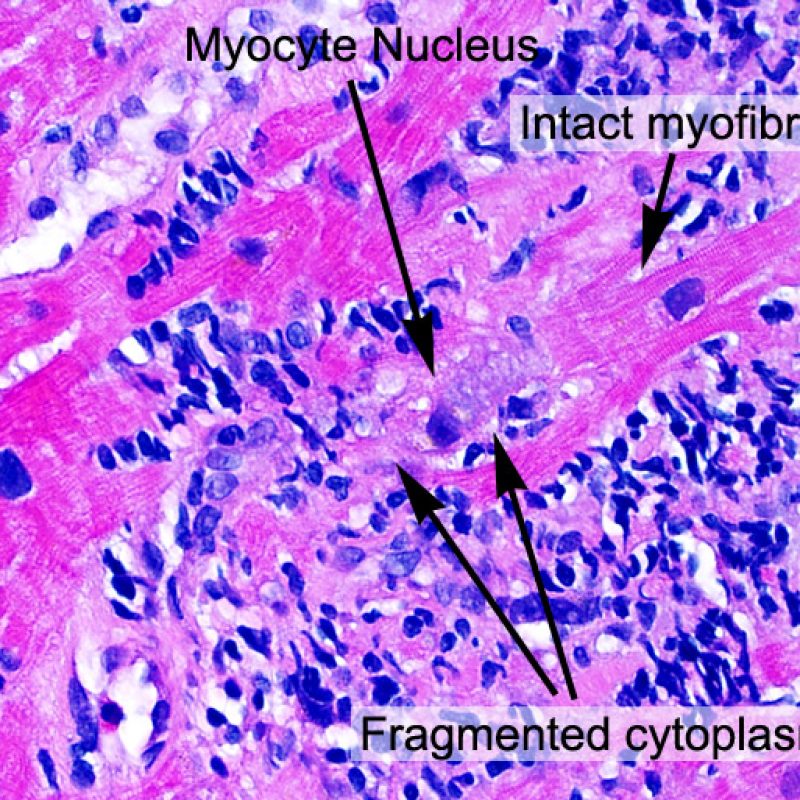
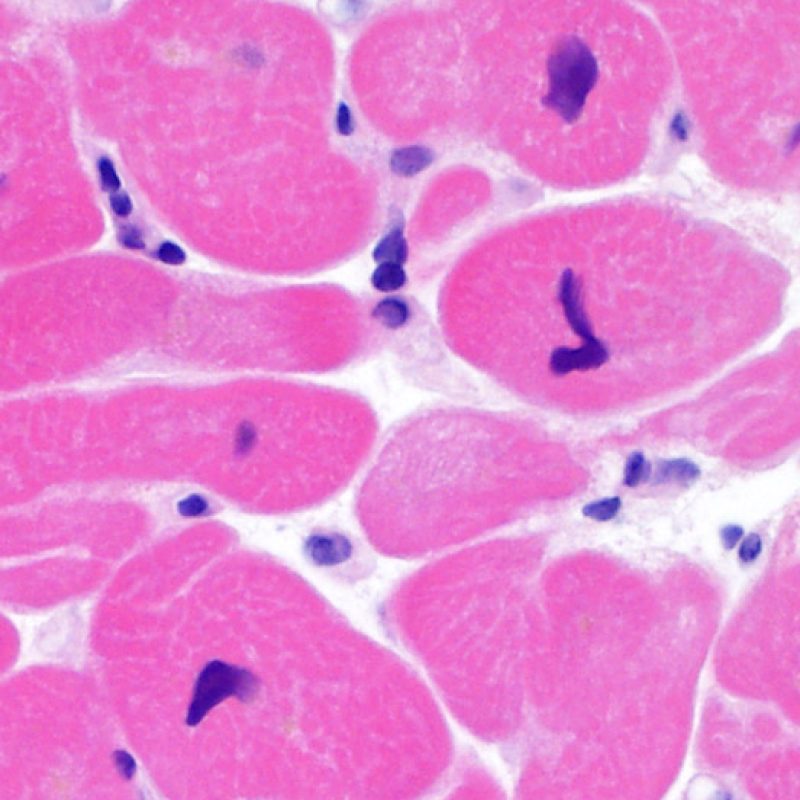
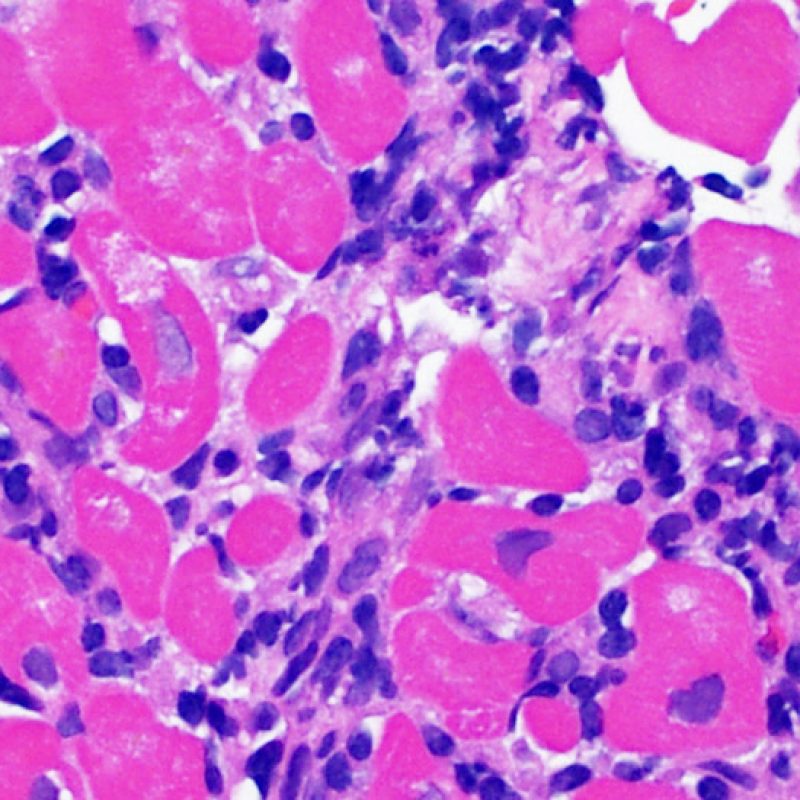
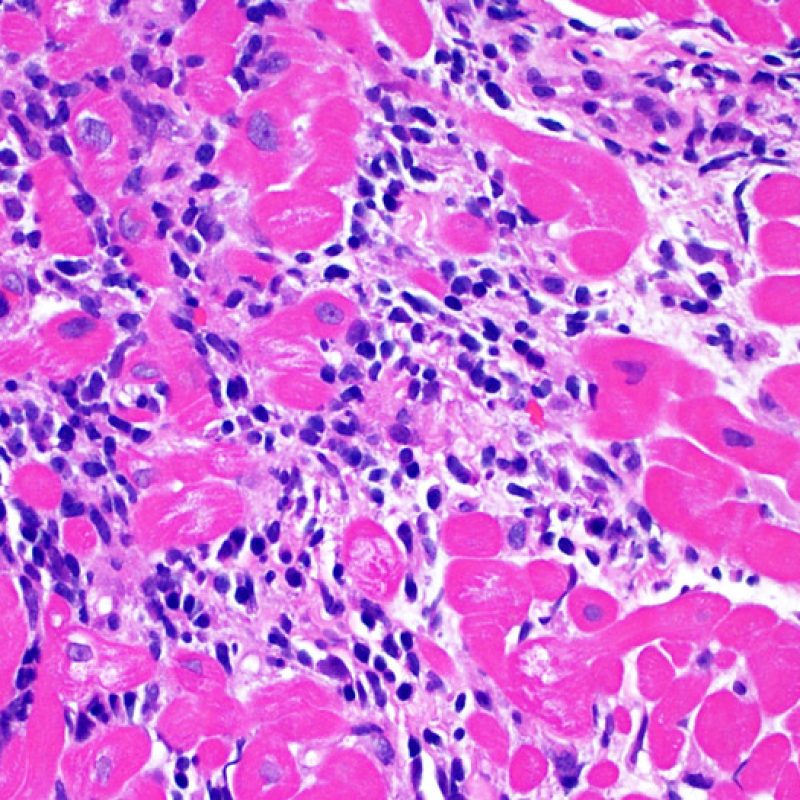
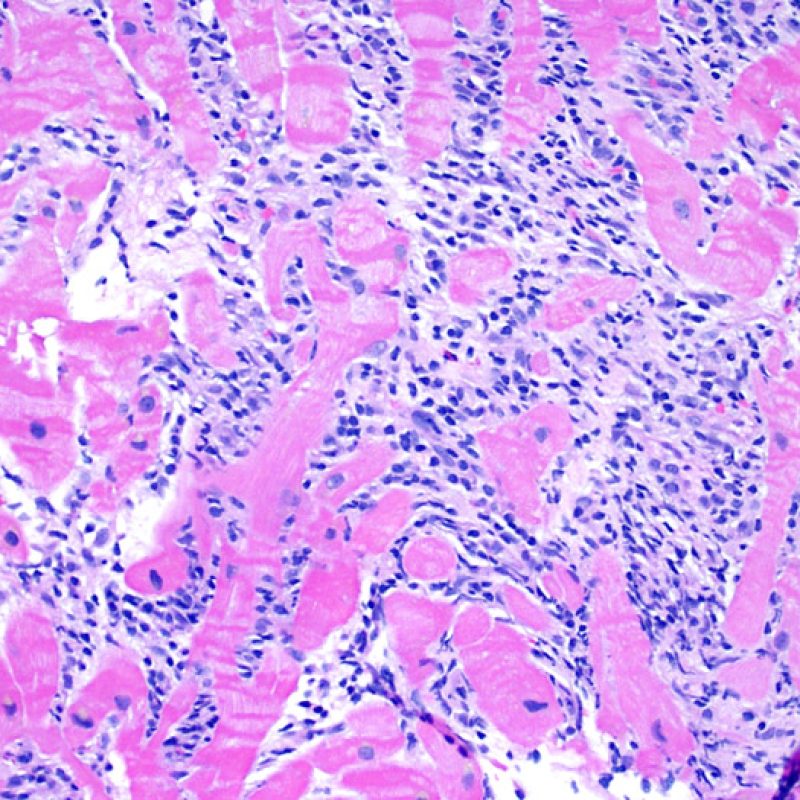
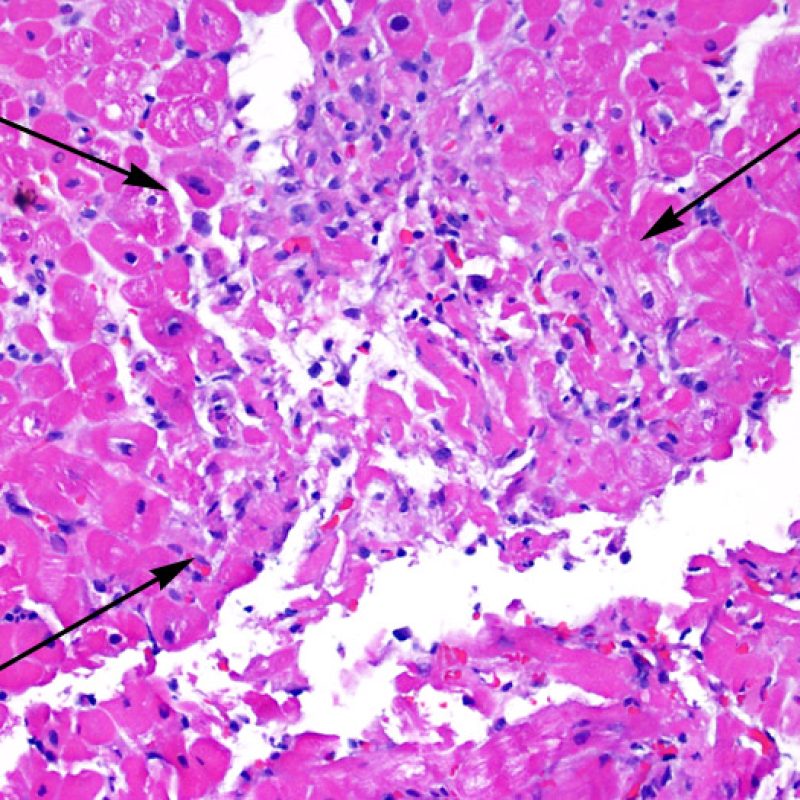
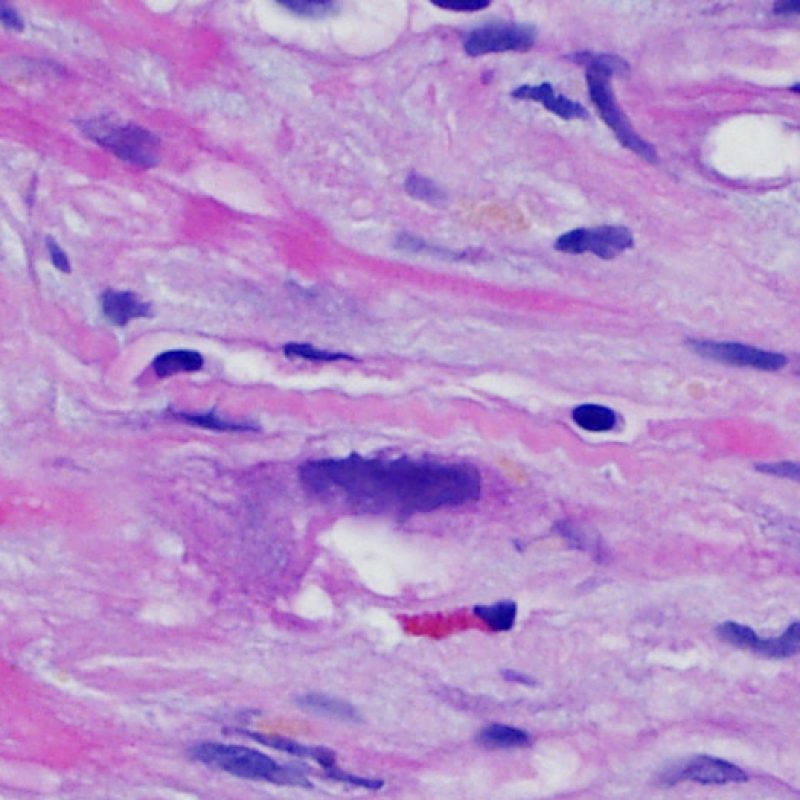
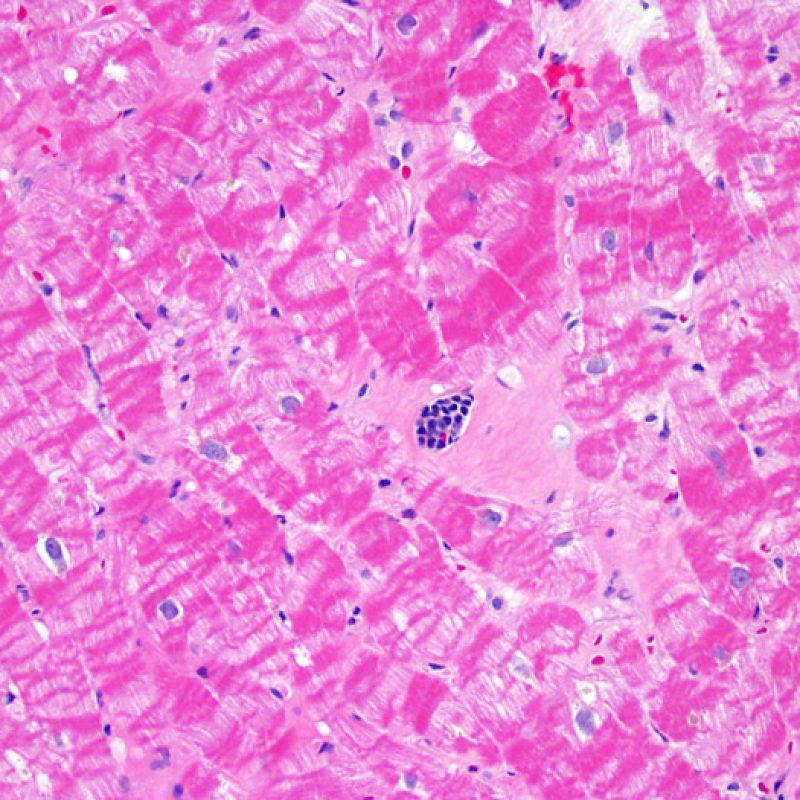
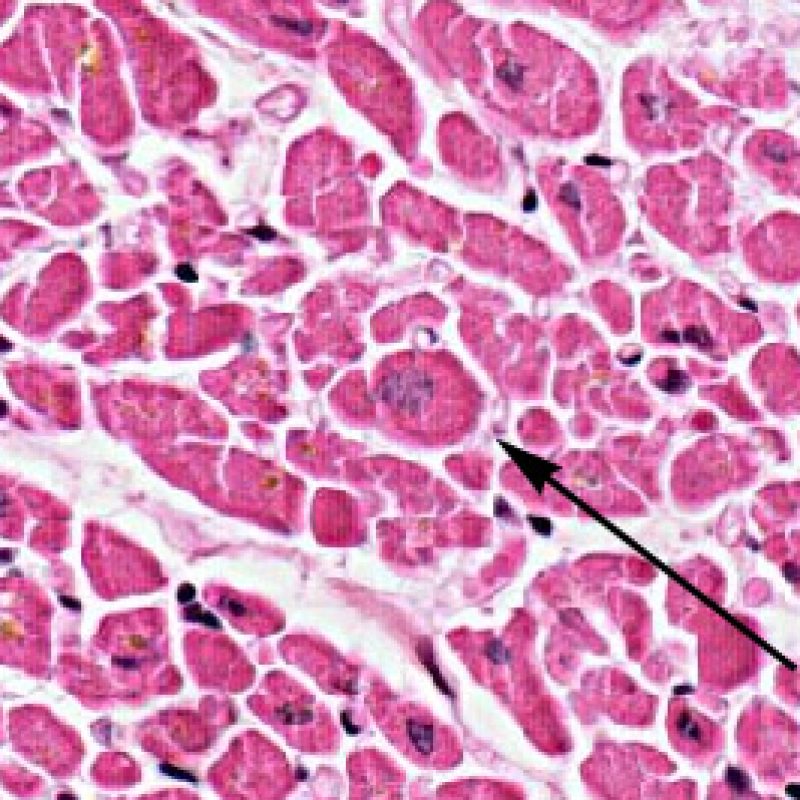
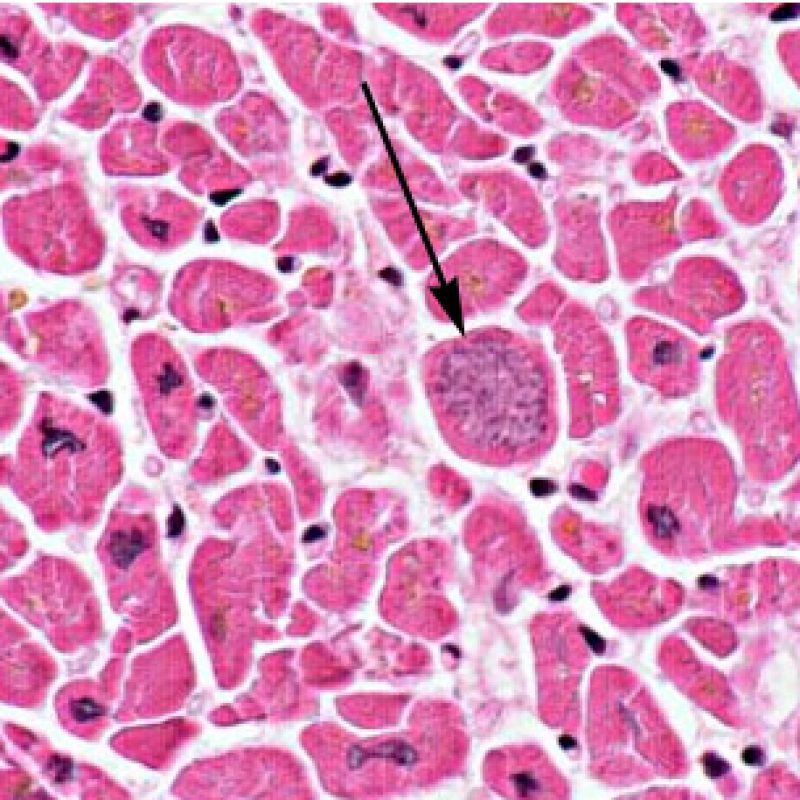
リンパ球浸潤が認められた場合、次に行うべきことは心筋細胞障害の評価である。不十分な固定により心筋細胞障害と紛らわしい変化が生じる場合があり、観察された心筋細胞障害/壊死が急性拒絶反応と関連したものか否かの判定は困難なことも多い。心筋細胞傷害は組織学的にごくわずかであることも多く、組織の深さを数段階変えて作製した切片による評価が必要である。ACRに関連した心筋細胞傷害の形態学的特徴として、細胞質の空胞変性、核周囲明庭、核周囲細胞質の消失、心筋細胞内へのリンパ球浸潤とそれに伴う心筋細胞境界の不明瞭化、心筋細胞の脱落と同部位における高度の炎症細胞浸潤および細胞外マトリックスの増加が挙げられる。細胞質の好酸性の増強や核の濃縮像も、心筋細胞傷害の良い指標となる。尚、心筋細胞融解と凝固壊死は虚血性障害を示唆する所見であり、拒絶反応とは区別して記載する。
心筋細胞傷害を示唆するその他の所見として、サルコメア構造の変化が挙げられる。正常の心筋細胞では筋原線維の配列は保たれているが、その配列が乱れ、細胞質の好酸性変化や萎縮が認められる場合、心筋細胞障害が示唆される。また、マッソントライクローム染色では正常心筋が好酸性を呈すのに対し、障害されて間もない心筋は萎縮して青みを帯びた灰色に染色されるため、同染色は心筋障害の識別に有用である。
心筋細胞障害により生じるこれらの変化には、常にリンパ球の浸潤が認められる。リンパ球浸潤が認められない場合には、観察された心筋細胞傷害は拒絶反応により生じたものではなく、移植後数週間以内に観察される虚血性傷害 など他の要因が関与している可能性がある。
単一レベルで作製した切片の評価のみでは、誤って心筋細胞障害と診断されてしまう可能性がある。このため、数段階の深さで切片を作製し、心筋障害が他のレベルにおいても同様に存在することを確認することが望ましい。
間質における細胞浸潤の同定
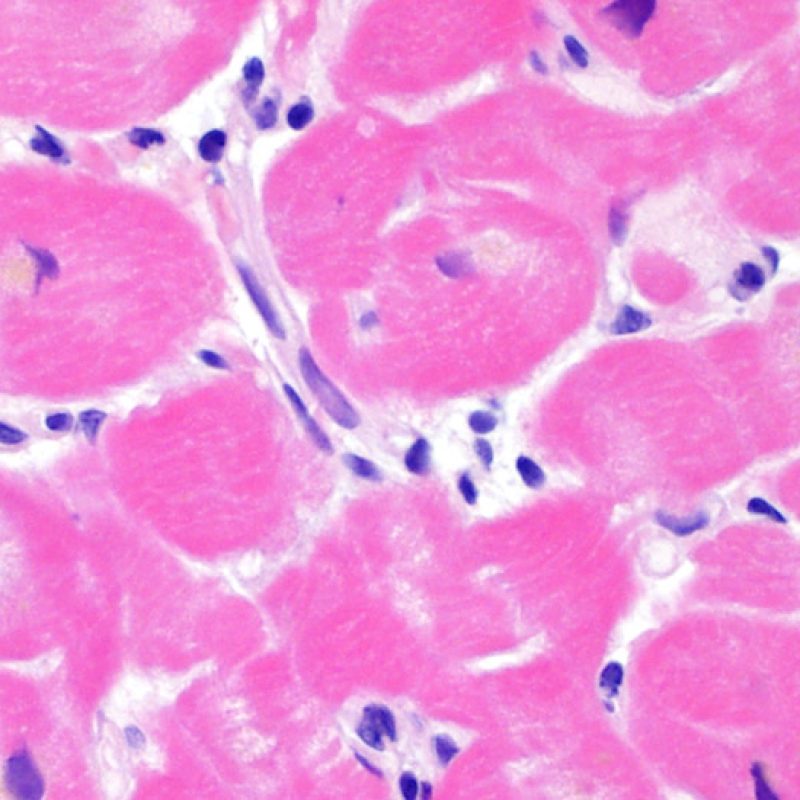
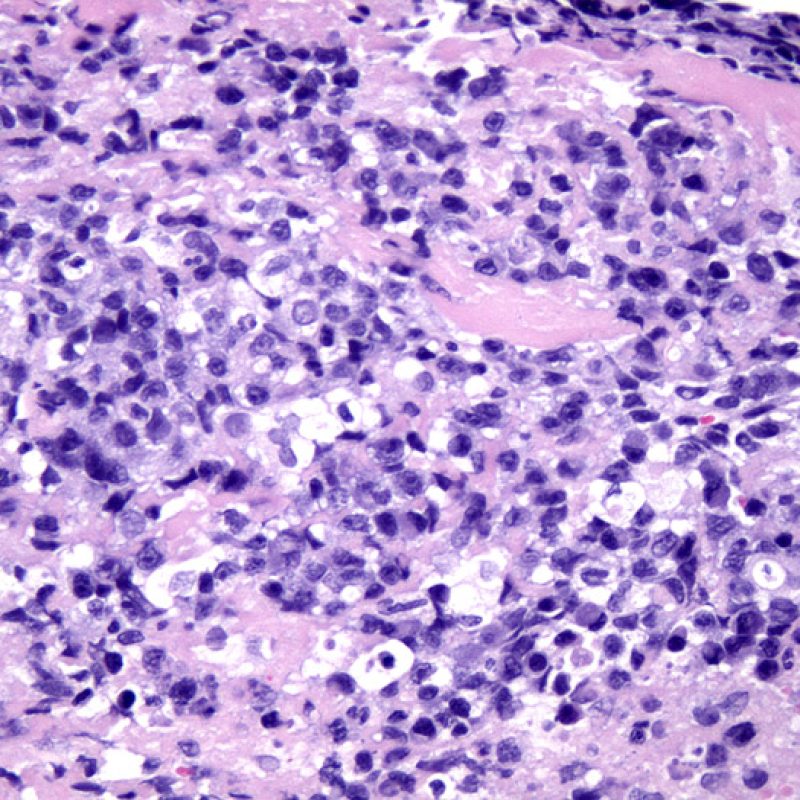
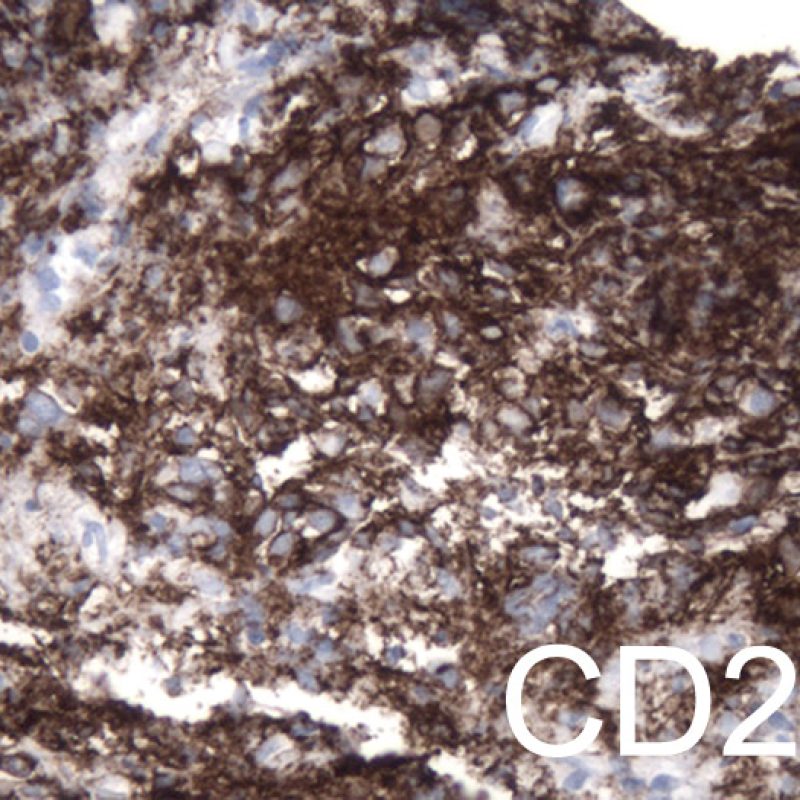
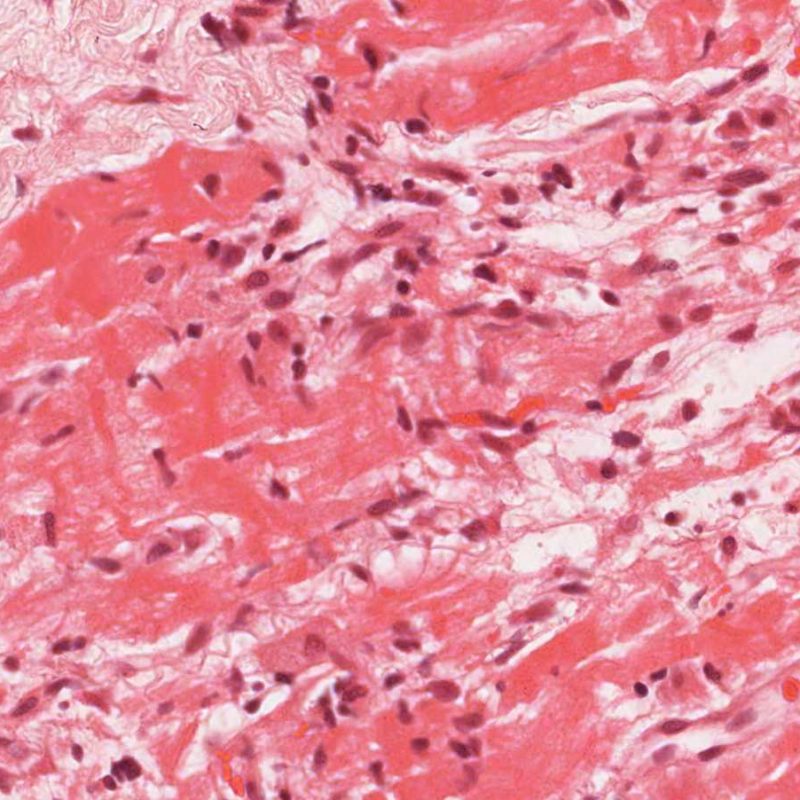
生検標本には、心筋細胞以外に様々な細胞が認められる。最も重要な所見は、急性拒絶反応の際に認められる炎症細胞浸潤であり、T細胞(CD4 +およびCD8 +)を主体とし、マクロファージや少数の好酸球もまじえた細胞浸潤である。中等度から重度の拒絶反応の際には、活性化B細胞、ナチュラルキラー細胞の増加も認められる。
しかし、間質に認められる細胞成分が、全てリンパ球というわけではない。従って、細胞性拒絶反応を除外するためには、細胞浸潤が疑われる部分を高倍率で観察し、その詳細を評価する必要がある。間質には線維芽細胞や筋線維芽細胞、原始間葉系細胞、樹状細胞、肥満細胞、内皮細胞および周皮細胞なども存在し、少数のリンパ球やマクロファージは、正常心筋でも観察される場合がある。一般的に、心筋内で集簇するのはリンパ球のみである。
炎症細胞浸潤の特徴
心移植後の心内膜心筋生検で認められる炎症細胞の種類は、拒絶反応のグレードの決定要因であるのみならず、細胞性拒絶反応を他の病態と鑑別する際にも重要である。急性細胞性拒絶反応の場合、常にリンパ球(T細胞)が存在することがその特徴である。活性化リンパ球は重度の拒絶反応で増加し、また細胞質の増加が認められる。
好中球と好酸球を混じえた炎症細胞浸潤は、通常高度の拒絶(3R)を示唆する所見である。好中球は移植後数週間以内に認められる虚血性壊死の際にも観察される。
中等度(2R)または重度(3R)の拒絶では、心筋壊死とともに少数の好酸球が散在して認められる。しかし、軽度(1R)の拒絶で 好酸球が観察されることはまずない。このため、好酸球が認められる場合には、中等度または重度(2R、3R)の拒絶の可能性を常に考慮すべきである。
また、好酸球は、薬剤と関連するHypersensitivity myocarditisの際にも認められる。この場合、リンパ球や形質細胞、マクロファージ等も出現するが、炎症細胞の主体は好酸球であり、好酸球の集簇像が観察される場合もある。局所的に心筋細胞融解が認められることもあるが、壊死は特徴的所見ではない。尚、好酸球は寄生虫感染の際にも認められる。
間質の評価
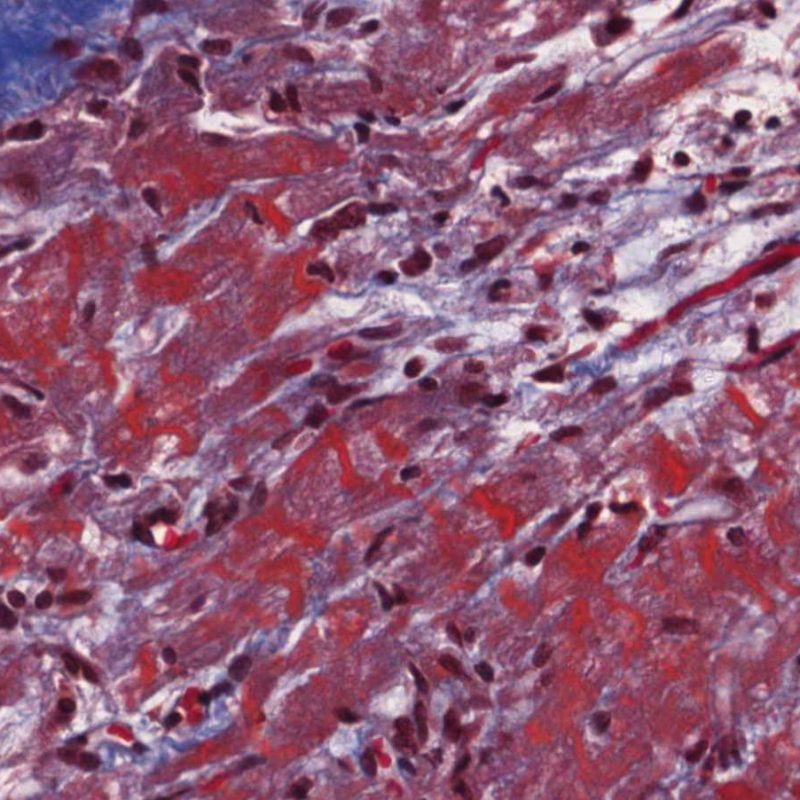
間質における細胞成分の増加や浮腫を確認するためには、高倍率での観察が必要である。高度の炎症細胞浸潤と共に、細胞の残骸や核の断片、好塩基性あるいは好酸性の不定型の物質が認められる場合、心筋細胞傷害やアポトーシスとして矛盾しない所見である。移植後早期では周術期の虚血傷害と関連する場合が多いが、移植後後期においては拒絶反応を示唆する有用な所見である。
心移植後の生検に認められる間質の浮腫 は、抗体関連拒絶反応の徴候である場合がある。しかし、生検標本の取り扱いや処理により生じたアーチファクトにより個々の心筋細胞が離開し、一見浮腫のように見える場合もあるため注意を要する。真の浮腫であれば、離開した心筋細胞の間には、非常に微細な細胞外基質が存在する。また、抗体関連拒絶反応の際に生じる浮腫は、血管内皮細胞の腫大や間質のマクロファージ、出血等の他の所見を伴う場合が多い。
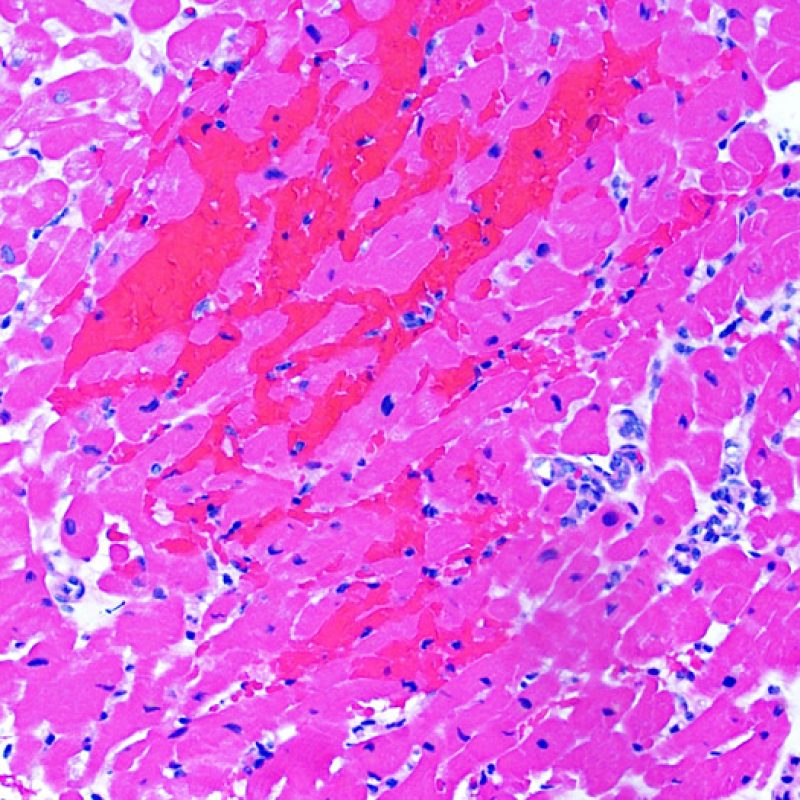
心筋細胞融解(移植後冠動脈病変)
心内膜下において、局所的あるいはびまん性に心筋細胞の空胞変性や心筋細胞融解が認められる場合、可逆性の虚血障害が示唆される。心筋細胞融解が生じた場合、核小体の目立つ腫大した核が認められ、筋形質と核は明るく抜けたように見える。もしこのような所見が移植後1年以上経過した症例の生検で観察された場合、移植心において急激に冠動脈狭窄が進行している可能性がある。
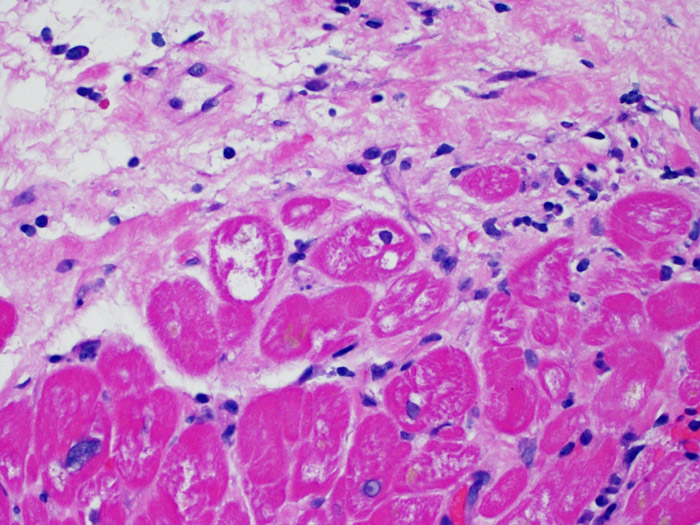
抗体関連拒絶反応の際に認められる内皮細胞の変化
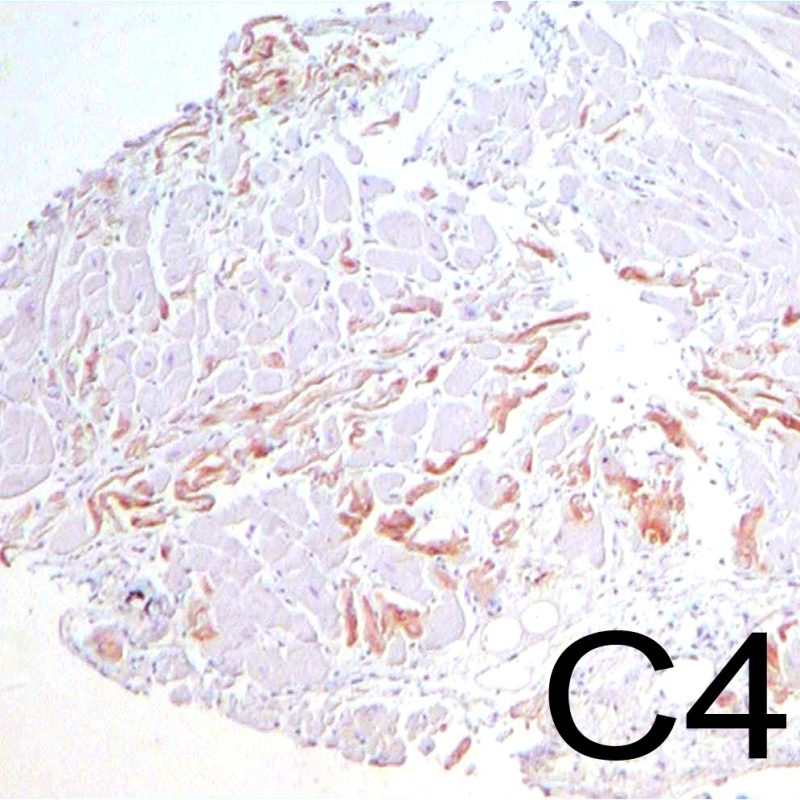
抗体関連型拒絶反応の診断基準は、本チュートリアルの別のセクションで解説されている。ヘマトキシリン・エオジン染色標本では、低倍率で毛細血管が目立つ場合にAMRが疑われる。高倍率での観察は血管内皮細胞の評価に有用であり、内皮細胞の腫大や核の腫大・濃縮像が認められた場合にはAMRが示唆され、免疫グロブリンと補体に関する検討が必要である。
拒絶反応
本セクションでは、急性細胞性拒絶反応の診断に際して重要な所見を解説する。抗体関連拒絶反応に関しても一部解説するが、低倍率・高倍率それぞれにおいて観察すべき主要所見等、抗体関連拒絶反応の詳細に関しては、別のチュートリアルで解説する予定である。
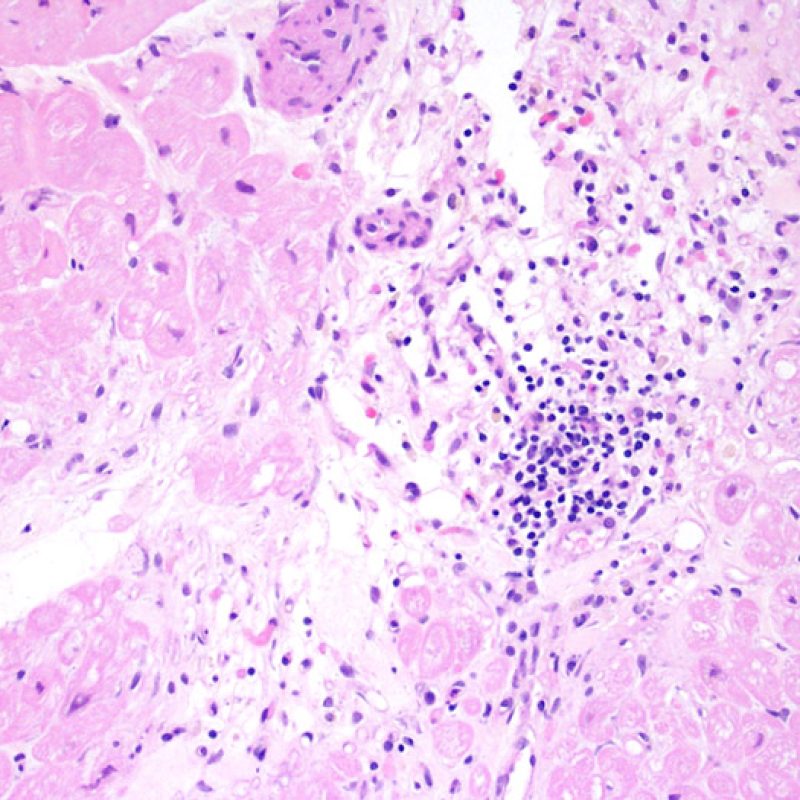
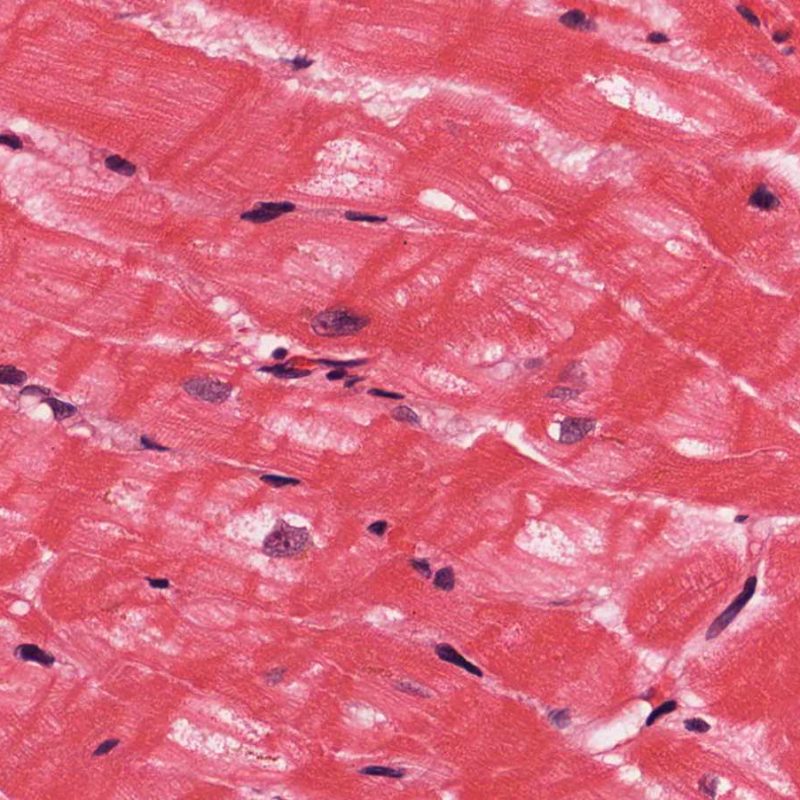
リンパ球浸潤
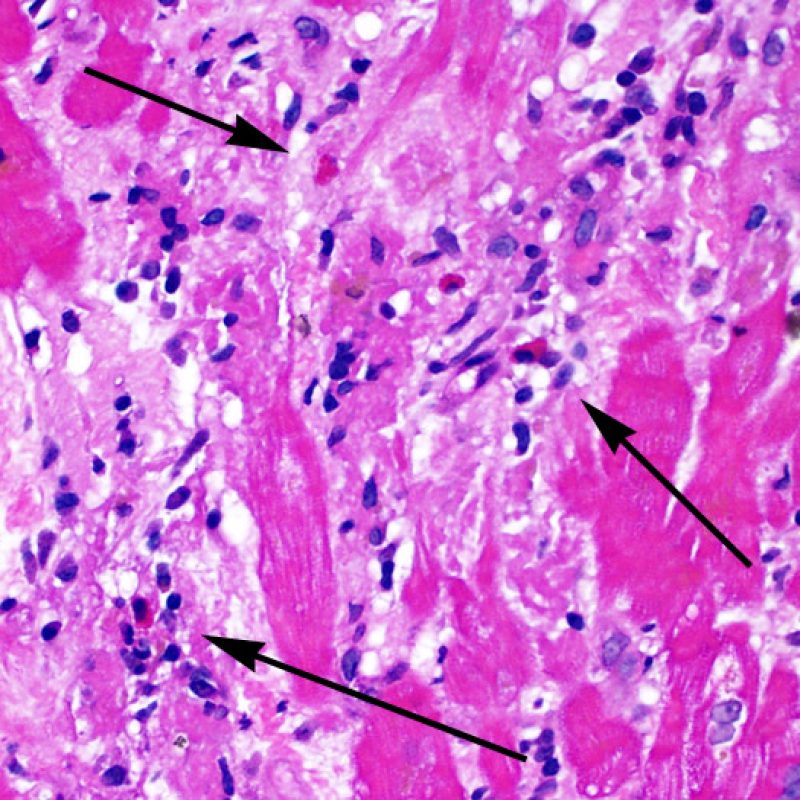
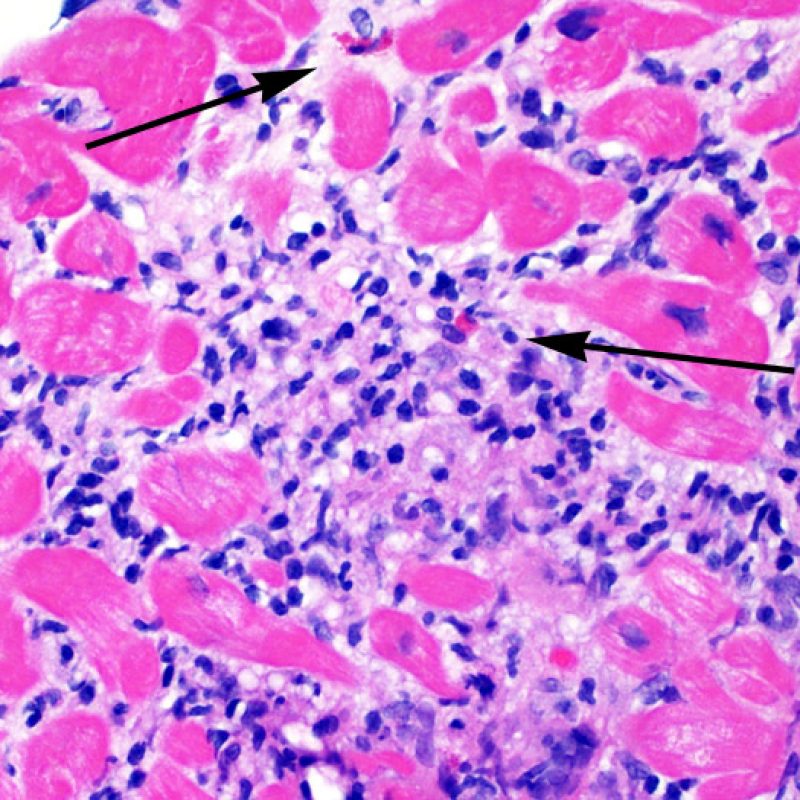
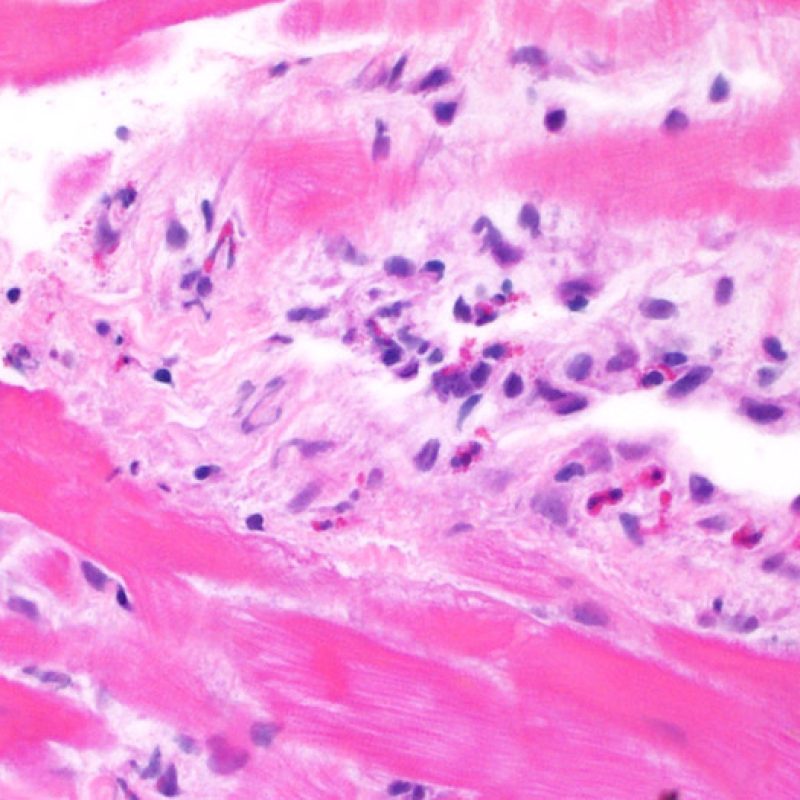
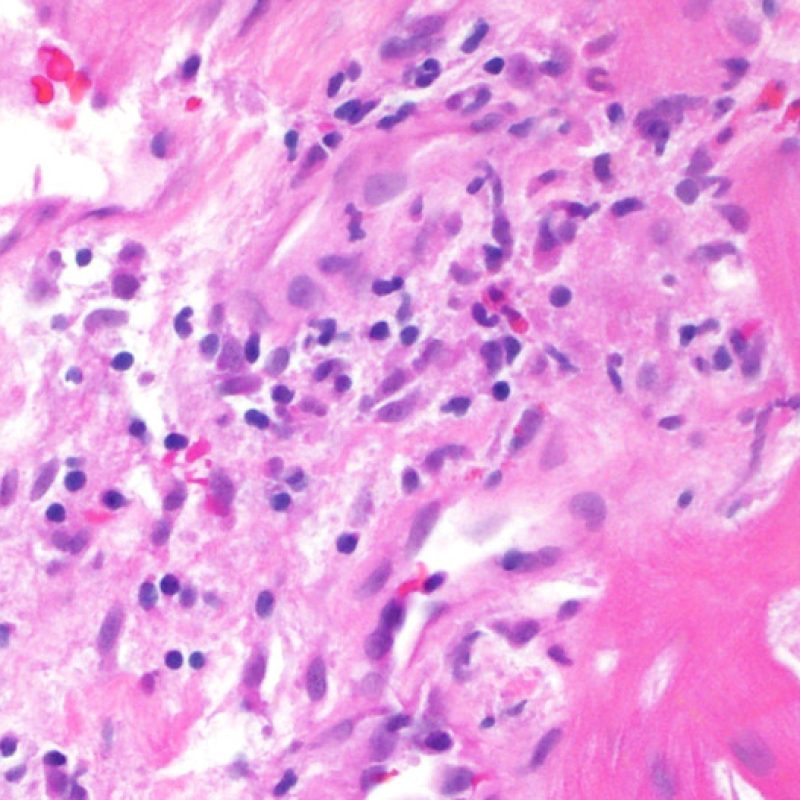
リンパ球浸潤は、急性細胞性拒絶反応を示唆する重要な組織学的所見である。 低倍率で細胞密度の増加が認められた場合、続いて心筋細胞傷害の有無を高倍率 で評価する。活性化リンパ球は、心筋細胞障害に際してみられるが、通常のリンパ球と比較して細胞質が豊かであり、核は腫大している場合が多い。
心筋細胞障害
心筋細胞傷害は、低グレートと高グレード(Grade 2R, 3R) の拒絶反応を識別する上で重要な所見である。その評価には高倍率での観察が最も適しており、好酸球の増加、核の濃縮、心筋細胞融解、凝固壊死、空胞変性、核周囲明庭、心筋細胞へのリンパ球浸潤等、様々な所見が観察される。高度のリンパ球浸潤が、心筋細胞の脱落した部位(本来心筋細胞が存在する部位に空隙が生じる)に生じている場合や、心筋細胞が変性して生じた“心筋の断片”が認められた場合にも、心筋細胞障害と評価される。
抗体関連拒絶反応
抗体関連拒絶反応(Antibody mediated rejection:AMR、またはhumoral rejection)はACRとは別の拒絶反応である。ただし重度のAMRの場合、組織学的所見が急性細胞性拒絶反応と重複する場合もある。光学顕微鏡では、毛細血管内皮細胞の腫大、血管内のマクロファージの集族、間質の浮腫が認められるが、一般的には補体C4dの染色もAMRの検索に併用される。AMRに焦点を絞った別のチュートリアルは、間もなく閲覧可能となる予定である。
拒絶反応以外の所見について
本セクションでは、生検標本に認められる拒絶反応以外の所見について解説する。稀な所見から非常に一般的な所見まで様々な組織学的所見が知られているが、これらの多くは拒絶反応と混同しやすく、むやみに拒絶反応と診断しないよう注意が必要である。
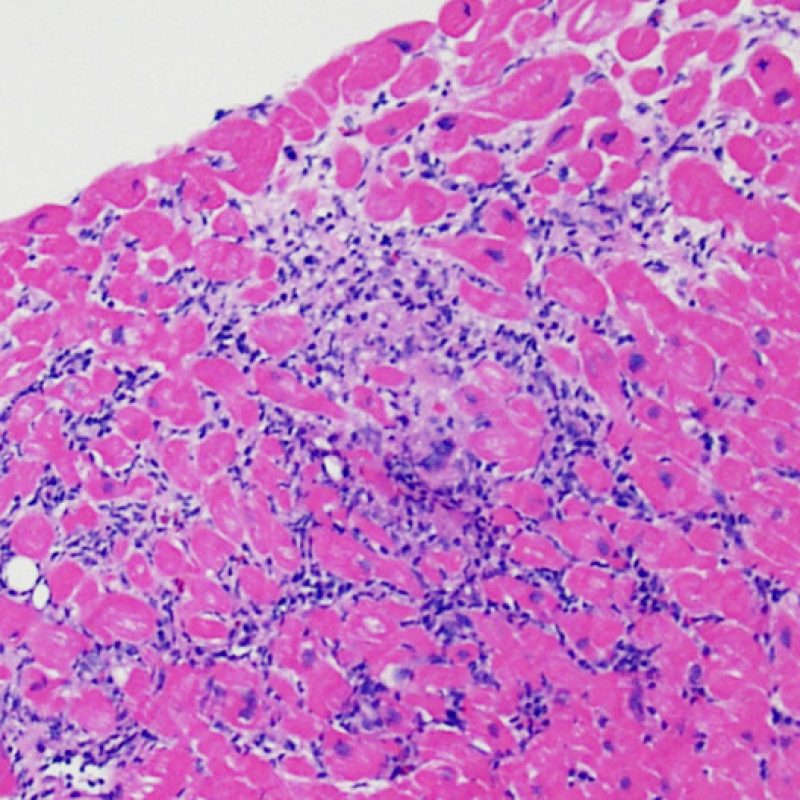
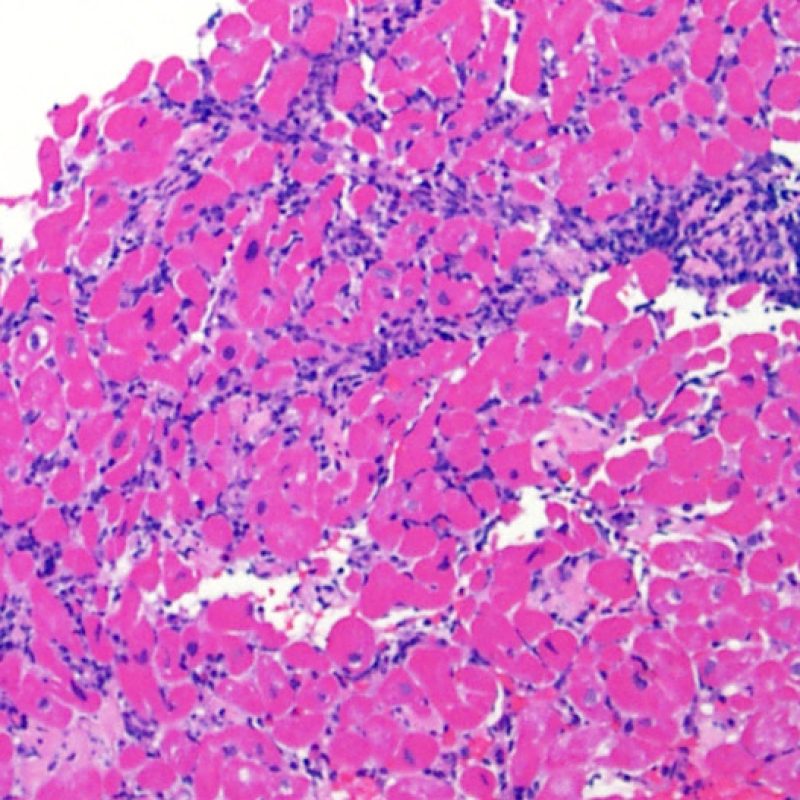
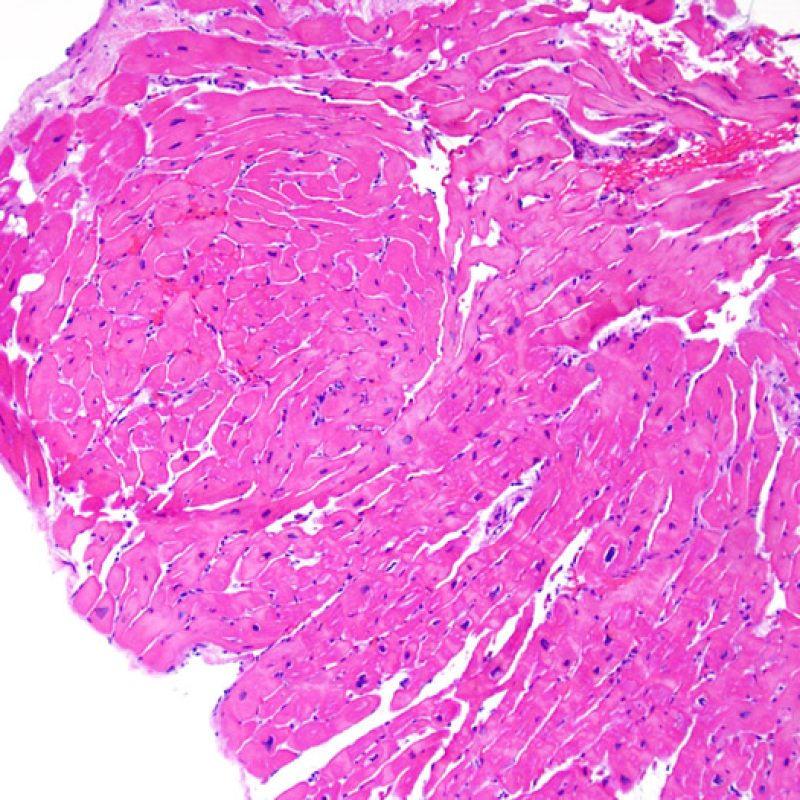
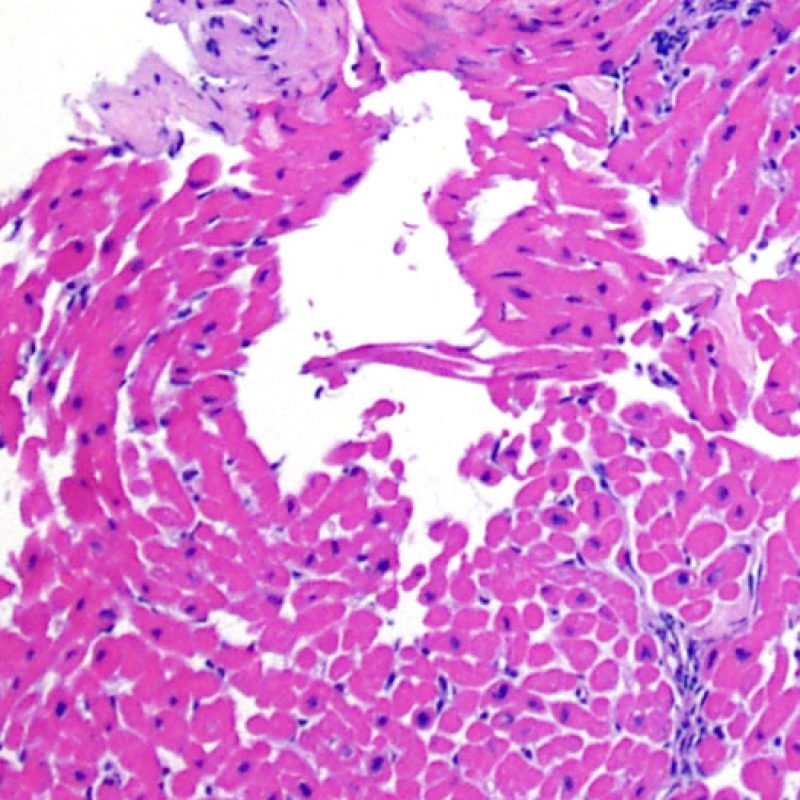
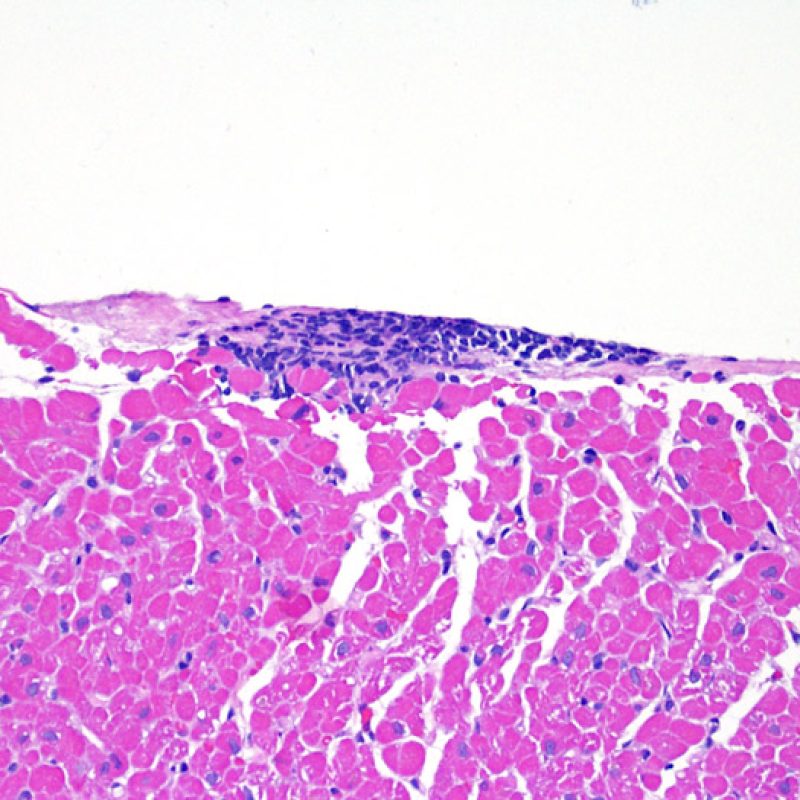
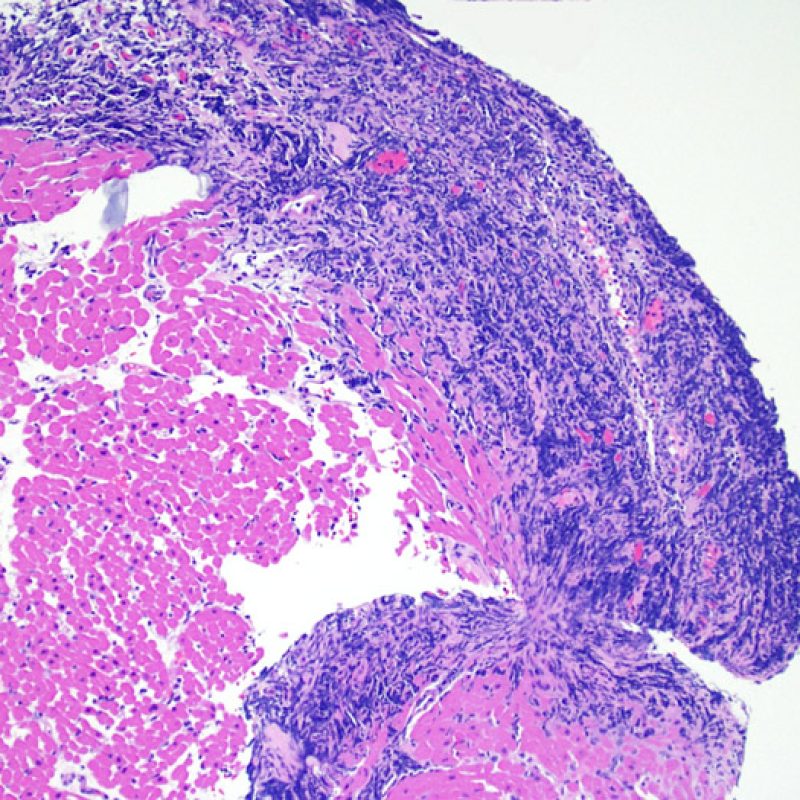
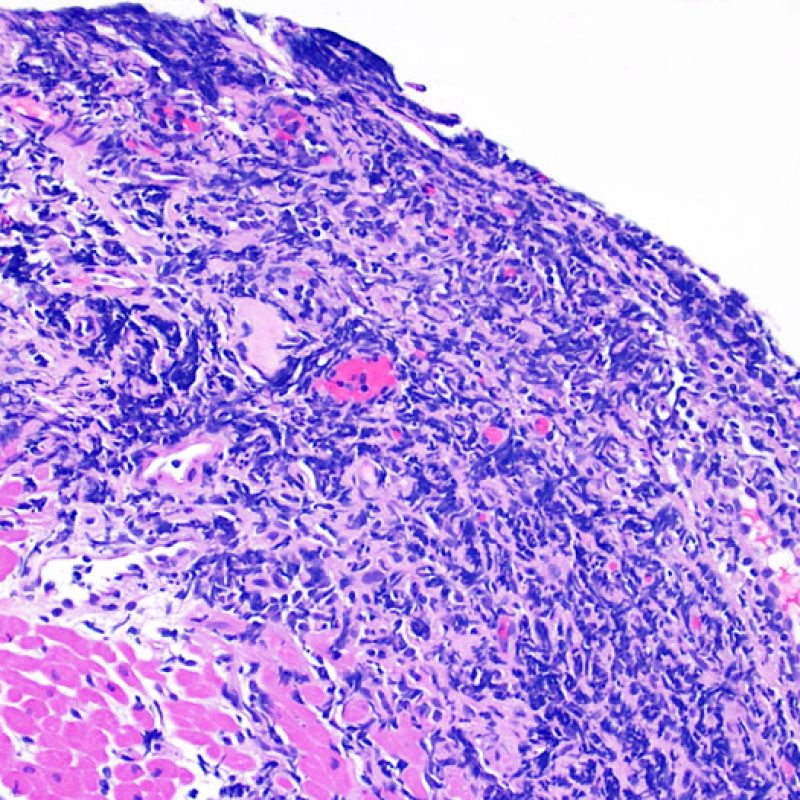
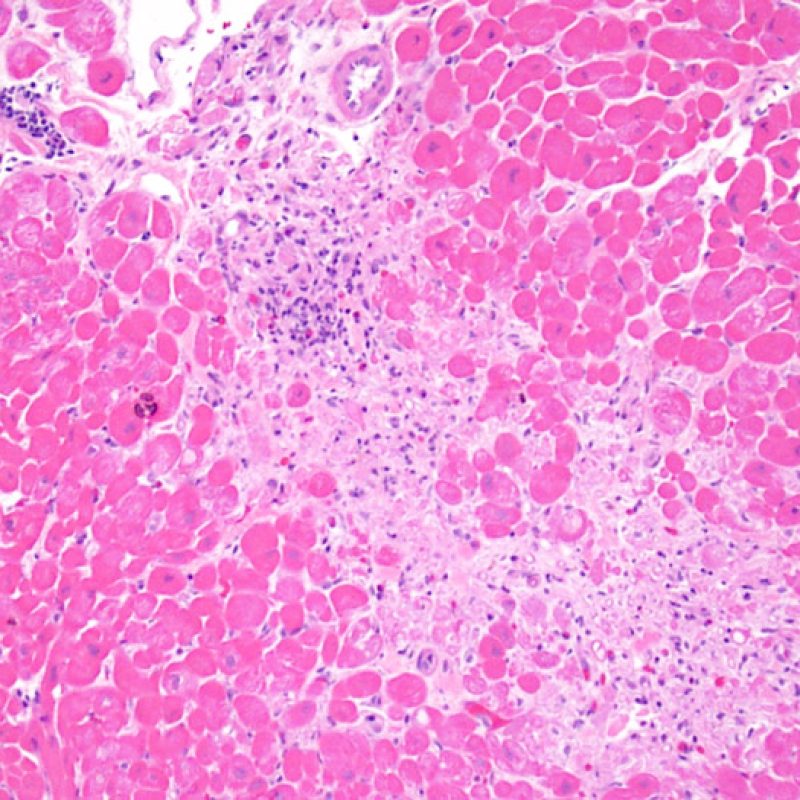
Quilty効果
心移植後の症例の約50%において、心筋生検標本にQuilty効果(最初に報告された患者の名前にちなんで名付けられ、以前はQuilty lesionと呼ばれていた)と呼ばれる所見が認められる。これは心内膜下に限局して認められるリンパ球の密な集簇で、隣接する心筋層に拡がって存在する場合もある。浸潤細胞は主としてBリンパ球とTリンパ球であるが、時に樹状細胞も含まれる。細胞浸潤を生じている部位には、小血管の増生もしばしば認められる。
Quilty効果の成因は不明であるが、シクロスポリン主体の免疫抑制療法、シクロスポリンAに対する特殊な反応性変化、Epstein-Barrウイルス感染の関与等が示唆されている。腎臓、肝臓など、他の臓器移植後にシクロスポリンの投与を受けた症例の心臓にはQuilty効果は認められない。細胞性拒絶反応の重症度、ウイルス感染、抗体関連拒絶反応、あるいは移植心冠動脈病変と、Quilty効果との関連性について、過去に数多くの研究が行われてきたが、関連性に関しては意見の一致がみられておらず議論が続いている。またQuilty効果と何らかの病理組織学的所見あるいは予後との関連についても未だ結論が得られておらず、今後の検討が期待される。
Quilty効果は、心内膜下に限局する場合と周囲の心筋層に拡がる場合がある。大きなQuilty効果は心筋細胞の間に浸潤して周囲に心筋細胞障害を生じ、拒絶反応と紛らわしい場合があり、ISHLT-1990基準においてgrade2と診断されている生検の多くが、実際はQuilty効果であると考えられている。このように、Quilty効果と急性細胞性拒絶反応の鑑別は非常に重要であり、複数の切片を作成して、リンパ球浸潤が心内膜にまで及んでいるかどうかを確認する必要がある(ただし、急性細胞性拒絶反応も心内膜に認められる場合がある)。小血管が細胞浸潤巣の内部に認められた場合には、Quilty効果である可能性が高い。また、Quilty効果の内部では、心筋細胞周囲に線維化が認められる場合が多い。
免疫染色を用いたリンパ球サブセットの評価もときに必要である。急性細胞性拒絶反応の際にはT細胞が優位となるが、Quilty効果ではB細胞、T細胞、マクロファージが混在する。抗CD21抗体をQuilty効果の同定に用いる場合もあり、もし陽性であればQuilty効果であることを裏付ける強力な根拠となる。ただし、CD21陰性だとしてもQuilty効果を否定できるわけではない。
Quilty効果が一部の標本において観察された場合、同時に採取された他の標本に認められる炎症細胞浸潤も、同様にQuilty効果である可能性が高い(ただし、急性細胞性拒絶反応の可能性を完全に除外できる訳ではない)。Quilty効果が消失する過程で、過去の生検部位から採取された標本と同様の組織像を呈する場合もあるが、以前の生検部位に由来する瘢痕組織は心筋層と不均一な境界を示すのに対し、Quiltyの消失過程に認められる瘢痕は、より均一な境界を示す傾向にある。
虚血性障害(周術期)
周術期に生じる虚血性傷害は、一般的に移植後6週間までの生検で指摘されることが多いが、術後3ヶ月に至るまで認められることもある。これらの病態は、急性細胞性拒絶反応との鑑別が困難な場合もある。虚血病変は、ドナーから心臓を摘出しレシピエントに移植されるまでの過程で生じ、大小様々な壊死巣として観察される。移植後初回の生検では、心筋細胞の好酸性の増加と核の消失等、非常に僅かな所見しか認められない場合も多い。壊死した心筋細胞は、免疫組織化学法または蛍光抗体法によりC4dに強い染色性を示すため、抗体関連拒絶反応と混同しないよう注意を要する。移植後慢性期に心筋細胞死が生じることもあるが、その場合リンパ球浸潤は伴わないため、急性細胞性拒絶反応との鑑別が可能である。移植後早期は強力な免疫抑制療法が行われるため、炎症所見に乏しい。
一般的に移植後2-4週間で炎症所見が最も顕著となる。これはマクロファージの反応によるもので、炎症はしばしば広範となり、心筋細胞傷害を伴うことがある。虚血性障害と急性細胞性拒絶反応の鑑別において重要な点は、拒絶反応の際には主にリンパ球が浸潤するのに対し、周術期に生じる虚血性傷害では様々な炎症細胞が混在して認められることである。虚血性傷害が生じた場合、周囲の間質にも変性が認められる。ただし、同一標本の中に急性細胞性拒絶反応と虚血傷害の両方が観察された場合、両者の識別は困難である場合が多い。拒絶反応の重症度を高く(悪く)診断することは容易であるが、その結果不要な治療が行われたり、必要以上に生検を繰り返すことになるため、注意が必要である。
多くの虚血性傷害は、移植後一ヶ月以降に、微小梗塞巣の修復過程と類似した組織像を示し、ヘモジデリン含有マクロファージや疎な線維化、心筋細胞の局所的な消失などが認められる。急性細胞性拒絶反応との鑑別はさほど問題とならないが、以前生検を行った部位との区別は困難である。
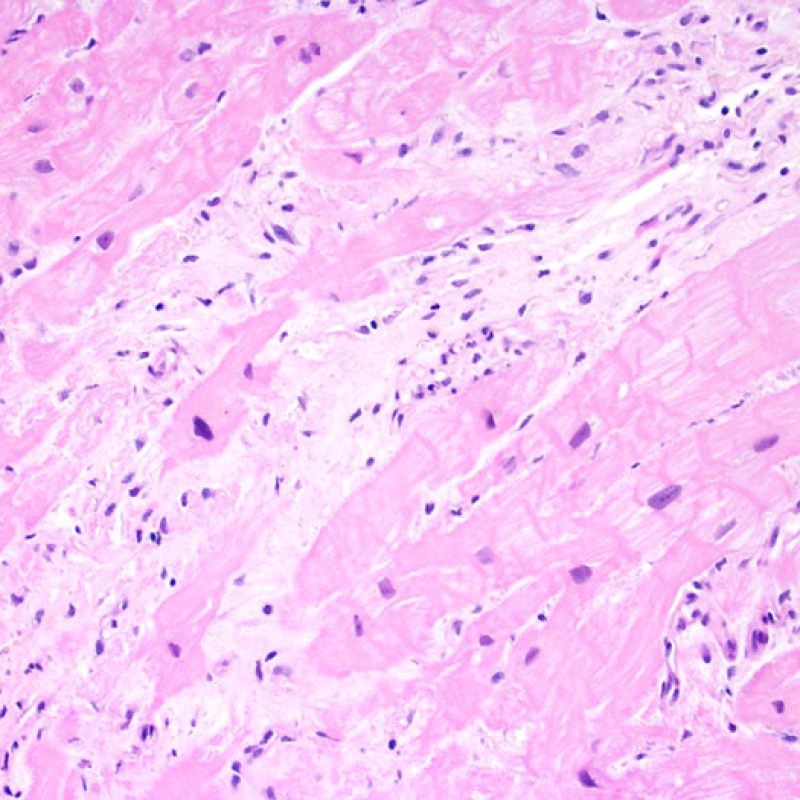
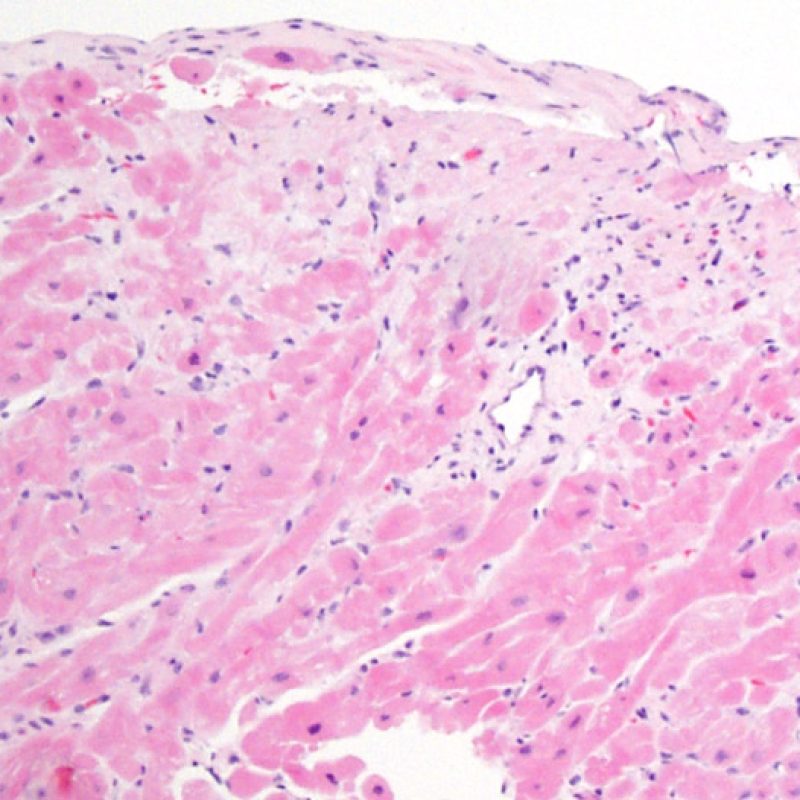
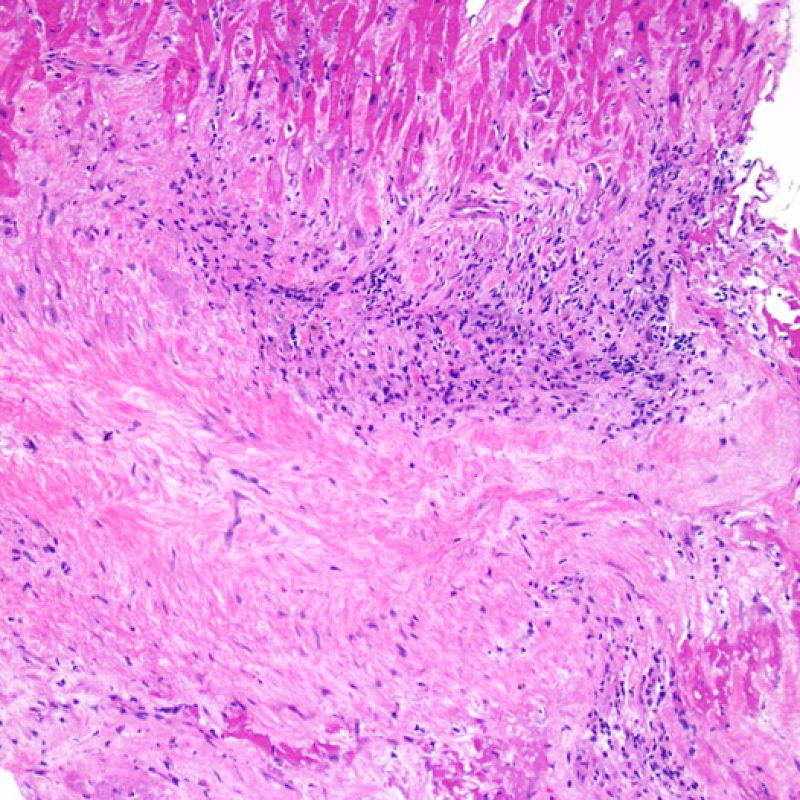
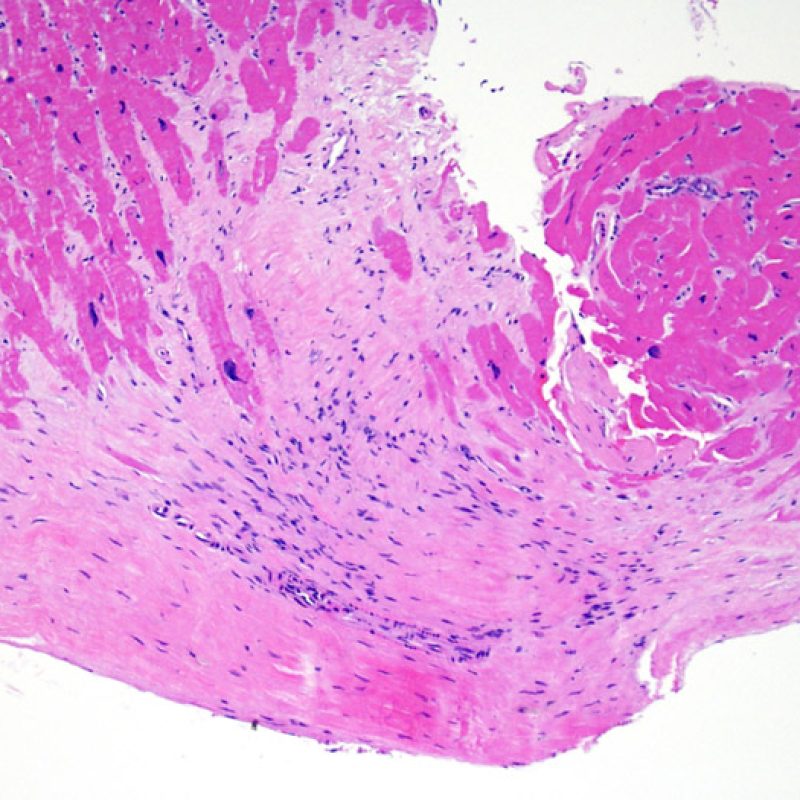
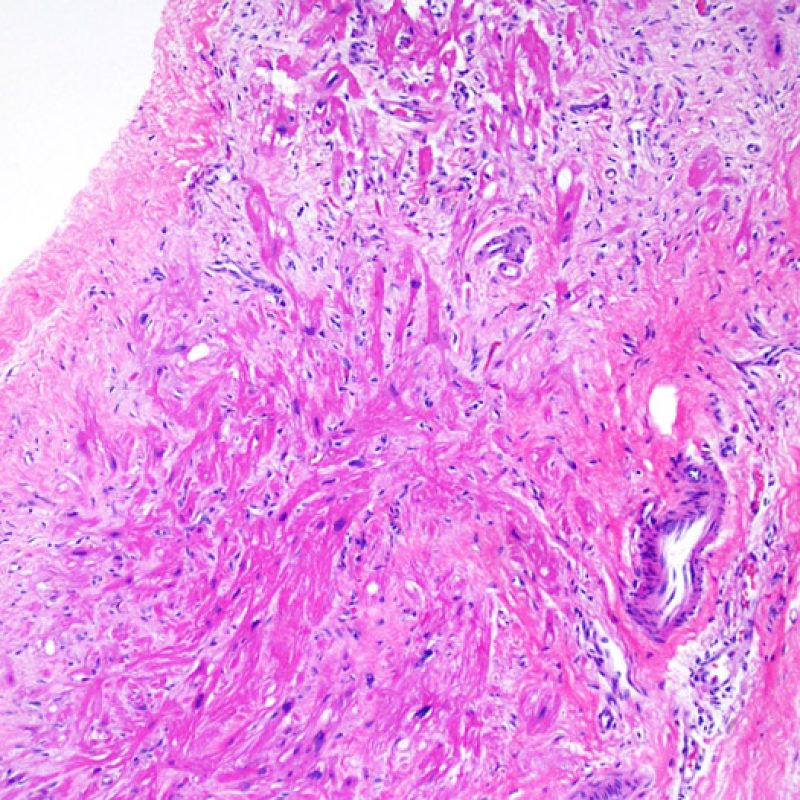
以前の生検部位と血栓
右心室の解剖学的な理由により、以前の生検部位と同部位、またはその周辺の領域から検体が採取されることは稀ではないため、心移植患者の生検では、以前の生検部位から採取している可能性を常に考えておかなければならない。過去の生検部位から採取された検体の組織像は、その前の生検がいつ施行されたかにより異なるが、新しい生検部位では心内膜が局所的に欠損し、その上にフィブリン/血小板血栓あるいは器質化血栓が覆い、炎症性細胞(マクロファージ、T細胞、B細胞)が認められる。修復過程では肉芽組織が観察され、最終的には心内膜に局所的な瘢痕が残存する。瘢痕組織周囲の心筋は配列が乱れ肥大し、錯綜配列を呈する場合もある。心移植後の症例は心筋生検を何度も施行されている場合が多いため、約14-70%の確率で過去の生検部位から組織が採取されると報告されている。
過去の生検部位に認められる炎症細胞浸潤は細胞性拒絶反応ではないため、拒絶反応のように重症度判定はしない。従って、診断が拒絶なし(0R)の場合でも、過去に生検を行ったことによる炎症所見が標本に含まれる場合もあり得る。
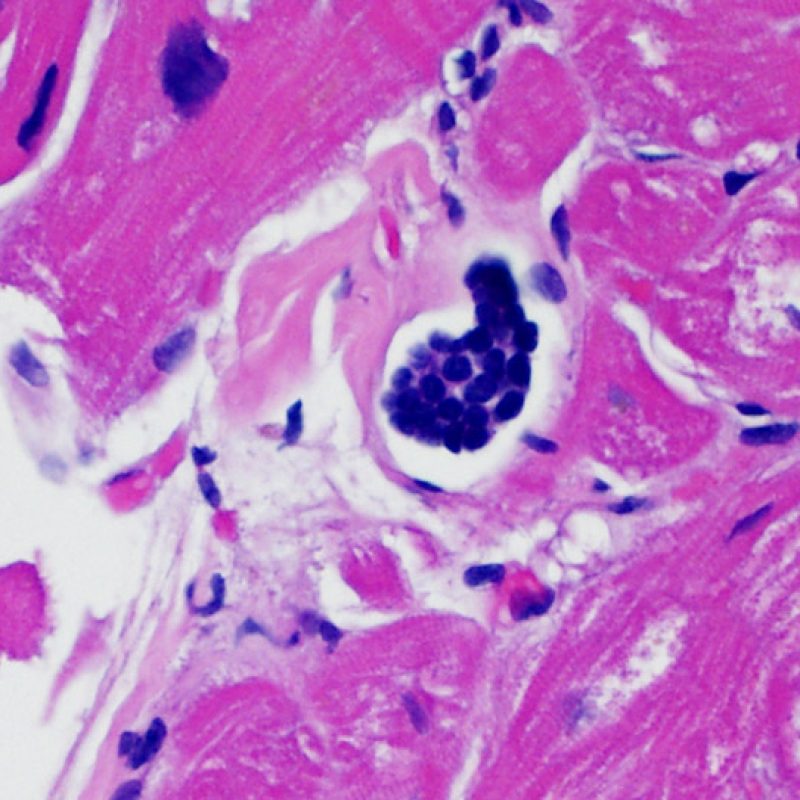
血管内リンパ球
リンパ管にリンパ球の集簇像が認められる場合もあるが、その原因は不明である。急性細胞性拒絶反応との関連はないため、記載する必要はない。
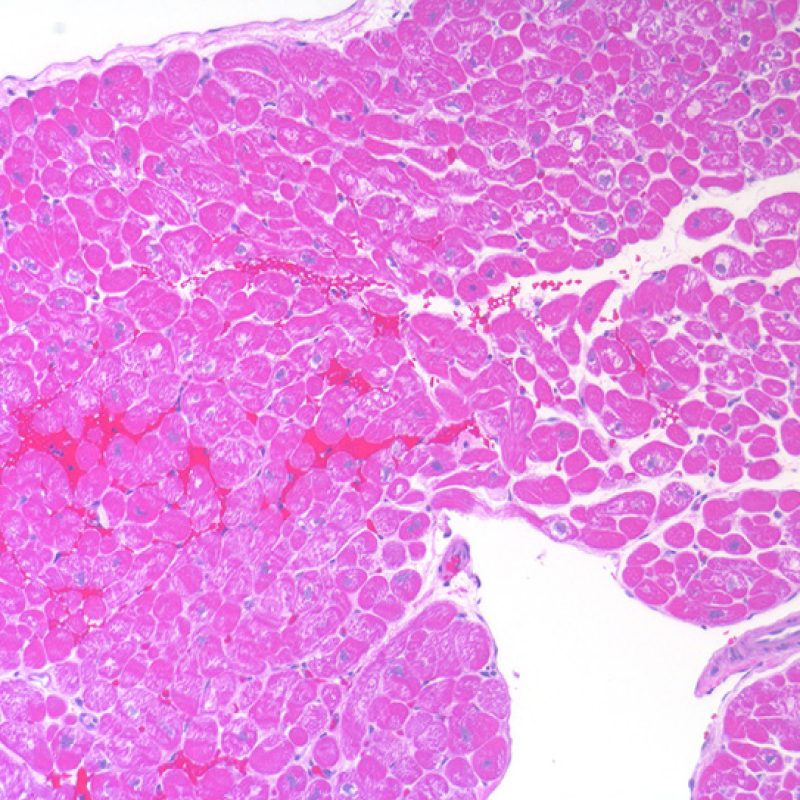
脂肪組織と中皮細胞
脂肪組織は成分としては少量であるが、心筋の正常な構成要素であり、しばしば大きな血管の周囲に存在する。生検標本においても、ときに種々の程度に脂肪組織が認められる。脂肪組織とともに、緻密化されていない心筋が僅かに採取される場合があるが、これらの標本は右室自由壁に由来すると考えられ、急性拒絶反応の評価には適していない。尚、標本に脂肪組織が存在する場合、心筋穿孔を疑う必要がある。脂肪組織と接する、接しないに関らず、中皮細胞が認められた場合、または脂肪組織内に小さな神経が認められた場合、心外膜由来の脂肪組織が採取され、右心室穿孔を来した可能性が示唆される。心膜血腫を生じる危険があるため早急に臨床医へ報告すべきであるが、多くの心移植患者は心膜が心臓に癒着しており、致命的な心膜血腫に至るリスクは非心移植患者と比較して大幅に少ない。
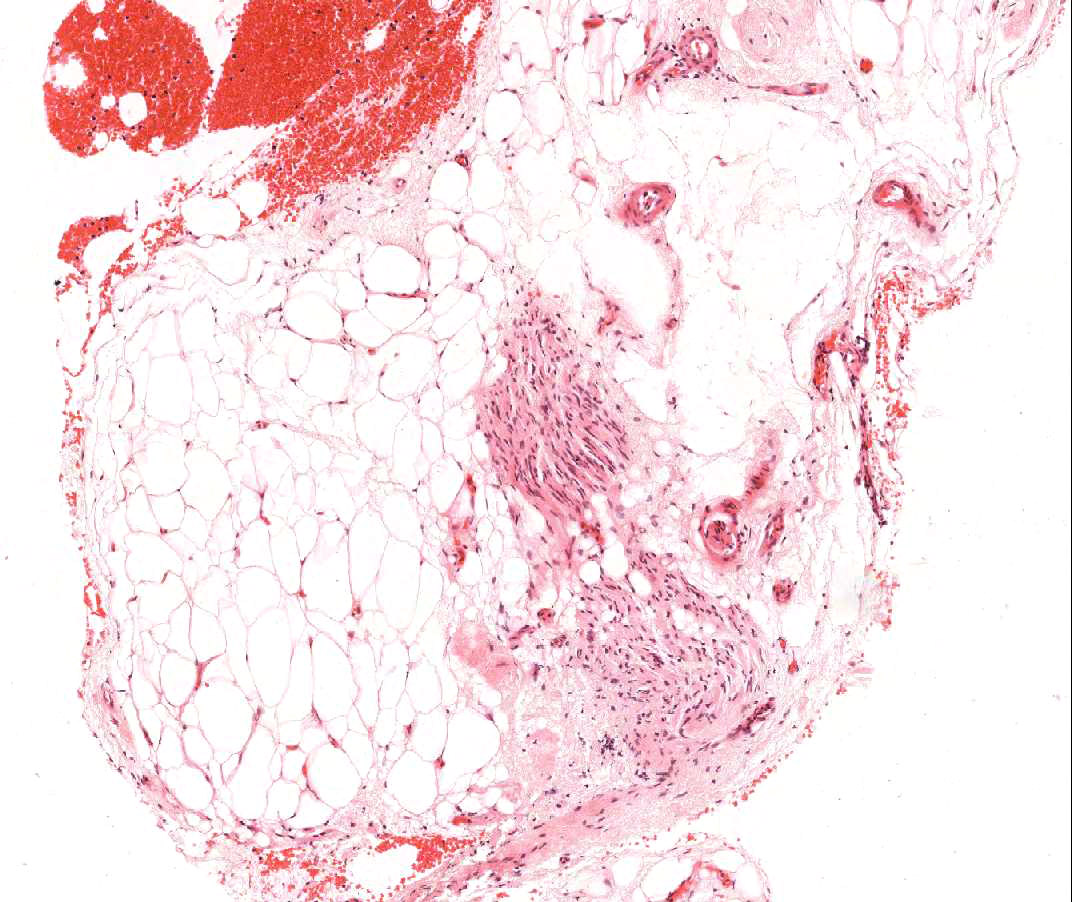
心筋の石灰化
心移植後の症例において心筋細胞に生じる石灰化は、移植時の一時的な高カルシウム血症が原因と考えられており、極めて稀な所見である。また、時間の経過した以前の生検部位においても石灰化が観察される場合があるが、より高頻度に認められる石灰化は、急性または慢性腎不全に伴うものである。石灰化は組織学的に、個々の心筋細胞に生じる場合と集塊状に生じる場合がある。周囲に線維化を生じることはあるが、通常炎症は伴わない。石灰化が広範に生じると心機能に悪影響を及ぼす可能性があるが、急性細胞性拒絶反応との関連はない。
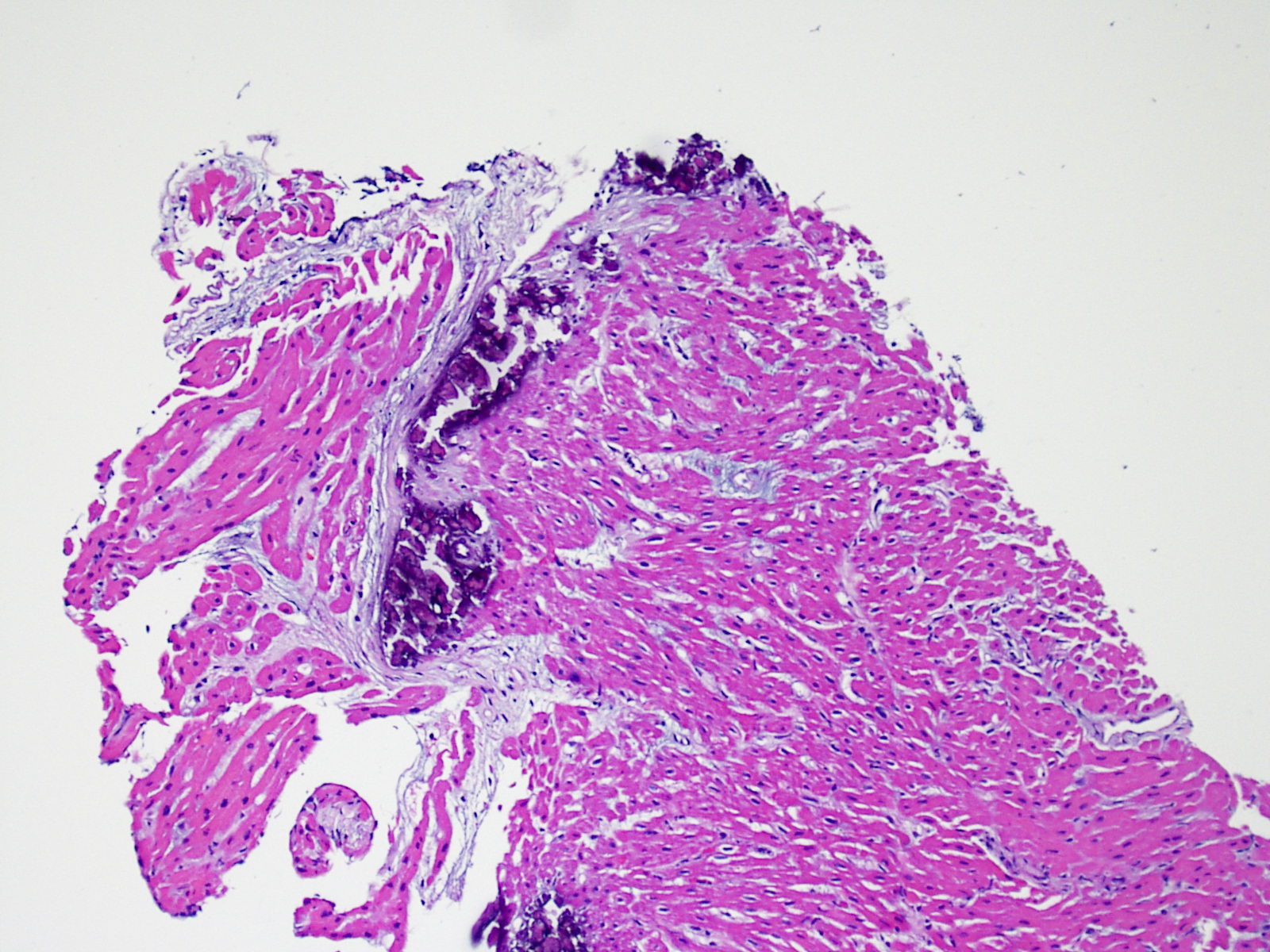
原疾患の再発
サルコイドーシス、巨細胞性心筋炎、アミロイドーシス、Chagas病、軽鎖沈着症など、心不全の原因となる疾患の一部は、移植心において再発すると報告されている。このため、病理医は患者の原疾患を常に把握し、その再発に注意を払う必要がある。特に、サルコイドーシスおよび巨細胞性心筋炎は、急性細胞性拒絶反応と組織学的に紛らわしい場合があるため注意が必要である。
感染症
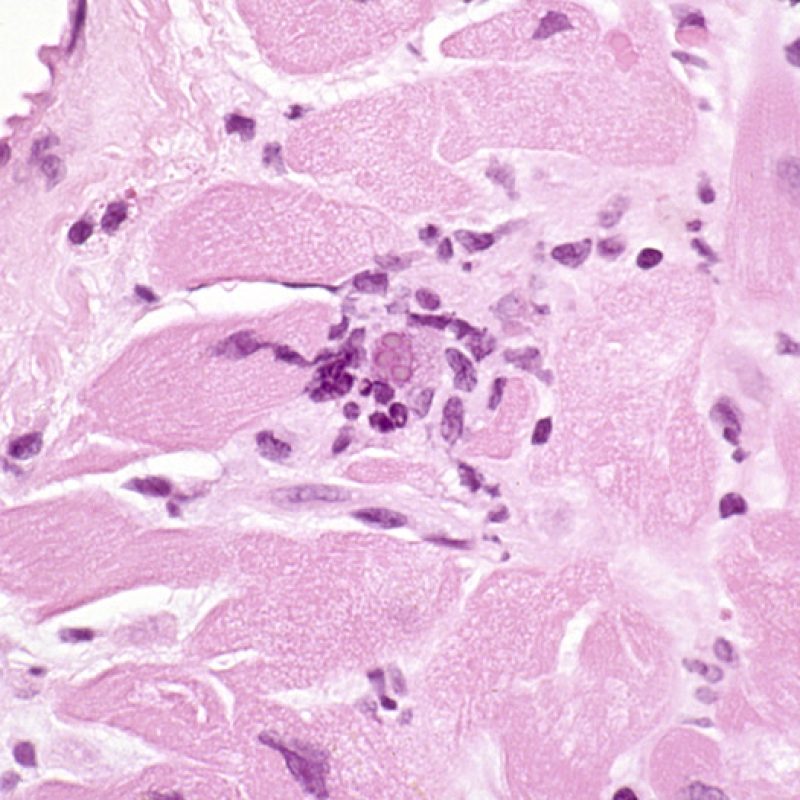
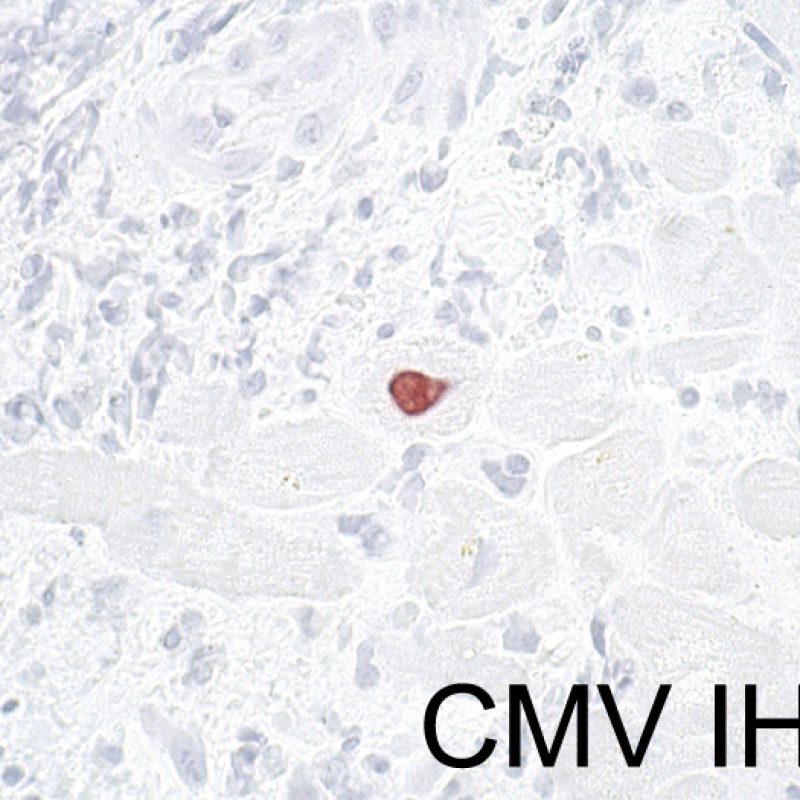
心移植後の患者は免疫抑制療法により感染のリスクが上昇しているが、心筋生検にて感染所見が認められるケースは非常に稀である。サイトメガロウイルス(CMV)は、心筋生検で認められた例も報告されてはいるが、通常血液検査(移植前にCMV陰性であったレシピエントのみ)や心臓以外の臓器(食道など)の組織検体を用いた病理所見に基づき診断される場合が多い。ウイルス封入体が心筋生検標本に認められた場合、免疫組織化学法でCMVや他のウイルス感染を検索する。何らかの感染症が確認された際には臨床医へ報告すべきであるが、急性細胞性拒絶反応と混同してはならない。心移植患者はトキソプラズマ症を発症する可能性もあり、抗トキソプラズマ抗体を用いた免疫染色により、心筋内に増殖する緩増虫体(Bradyzoites)の検出が可能である。炎症所見は伴わない場合が多い。
移植後リンパ増殖性疾患(PTLD)
移植後リンパ増殖性疾患(PTLD)は移植患者において極めて高頻度(最大6%)に発症するが、心筋生検でその診断を行うことは極めて稀である。組織学的には急性細胞性拒絶反応と類似し、Bリンパ球のシート状の集簇として認められる。通常EBV陽性であるため、PTLDが疑わしい症例ではin situハイブリダイゼーションによるEBVの検索および免疫組織化学法(CD20)によるB細胞の検出が必要である。急性細胞性拒絶反応と診断した後、治療に対する反応がみられない場合、過去に遡ってPTLDの検索が必要な場合もある。また、生検中に形質細胞が多数認められた場合、形質細胞性PTLDの可能性を疑う必要がある。稀ではあるが、T細胞リンパ腫によりPTLDが発症する場合もある。
異物
心筋生検を繰り返し受けた症例において、心内膜に異物型巨細胞の小さな集簇像が稀に認められる。生検鉗子を拭くために使用したガーゼの木綿糸等、偏光下で重屈折性を示す異物が観察される場合がある。
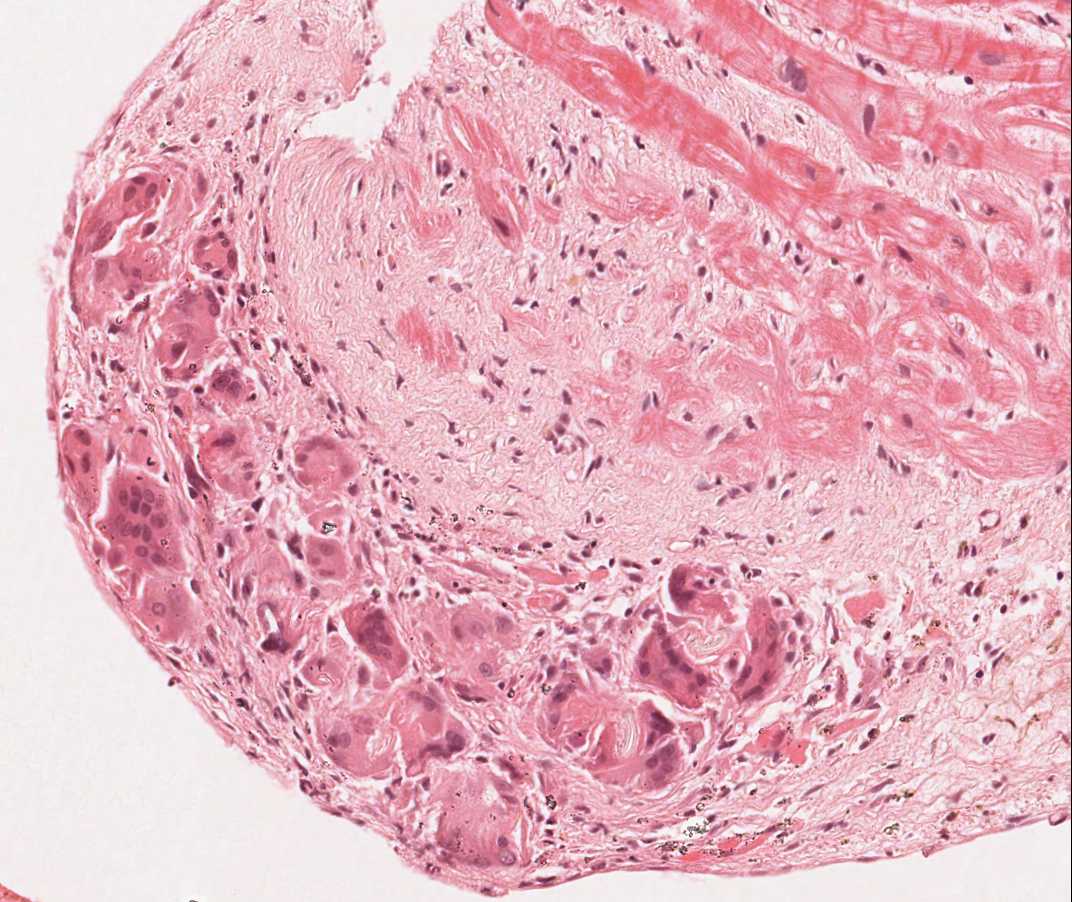
三尖弁あるいは肝組織の断片が採取された場合
約12%の症例において、心移植後数年間に三尖弁由来の心雑音が聴取される。心移植後に生じる三尖弁閉鎖不全症の主な原因は、うっ血性心不全、三尖弁輪拡大、肺高血圧などであるが、稀に生検鉗子が三尖弁を通過する際に弁尖が破れたり、あるいは鉗子が腱索にひっかかることで、弁閉鎖不全を生じる場合がある。このため、生検標本に弁尖や腱索の一部が認められた場合、臨床医への報告が推奨される。臨床的に問題となることは少ないが、採取された腱索組織が大きい場合、グラフト機能不全を発症する可能性がある。弁や腱索は、基本的に検体の長軸方向に弾性線維が配列した、細い紐状の線維性組織である。両側面に内皮細胞が認められる点が肥厚した心内膜との相違点であるが、両者の鑑別は困難なことが多い。
極めて稀ではあるが、生検鉗子が上大静脈から下大静脈を通過し、肝臓でサンプリングされてしまう場合がある。従って、スライドに肝組織が認められた際には、実際にその患者から誤って採取された場合、あるいは標本の作製段階で混入したアーチファクトの場合の、いずれの可能性もあり得る。
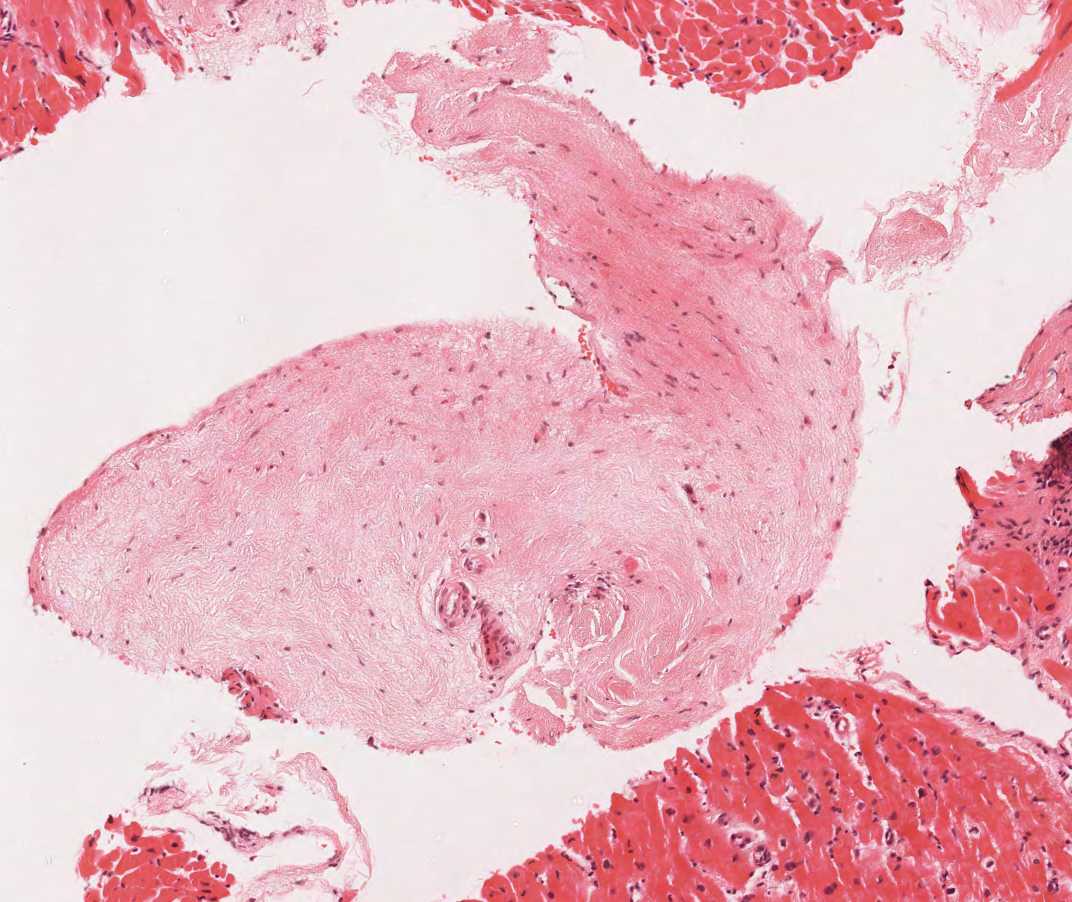
アーチファクト
心筋生検には、数多くのアーチファクトが認められる可能性がある。主要なものを以下に示すが、これらは誤って重要な病変と解釈される可能性があり、注意を要する。
収縮帯
心筋生検施行後ホルマリン溶液に入れられた検体は、アーチファクトを生じないよう丁寧に扱う必要がある。しかし、検体が常に心筋の切断面を含んでいる以上、固定による心筋の収縮は避けられない。固定液の温度が冷たい場合、標本の縞模様が顕著となる。Z帯の肥厚とサルコメアの過収縮、正常に保たれた筋原線維から成るこの所見は収縮帯と呼ばれる。高頻度に認められる所見であり、広範囲に生じる場合も多いが、病理学的な意義はない。
収縮帯は、収縮帯壊死/心筋細胞融解との鑑別が重要である。収縮帯壊死/心筋細胞融解は、術後/インターベンション後の再潅流傷害や、高容量のカテコラミンが投与されている患者、頭蓋内出血で死亡したドナーの心臓において認められる。単一の心筋細胞に生じる場合と、複数の心筋細胞に生じる場合があり、周囲はほぼ正常の心筋細胞に囲まれている。個々の心筋細胞を結合するZ帯は崩壊し、筋原線維は細胞内のカルシウム沈着により顆粒状粒かつ好塩基性の色調を呈し、断片化を生じる。
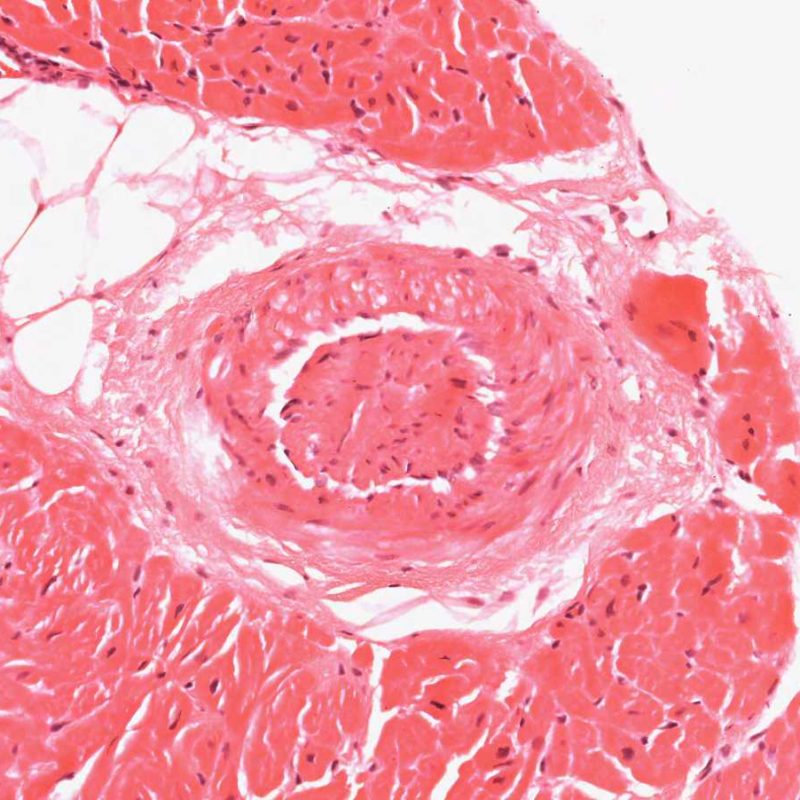
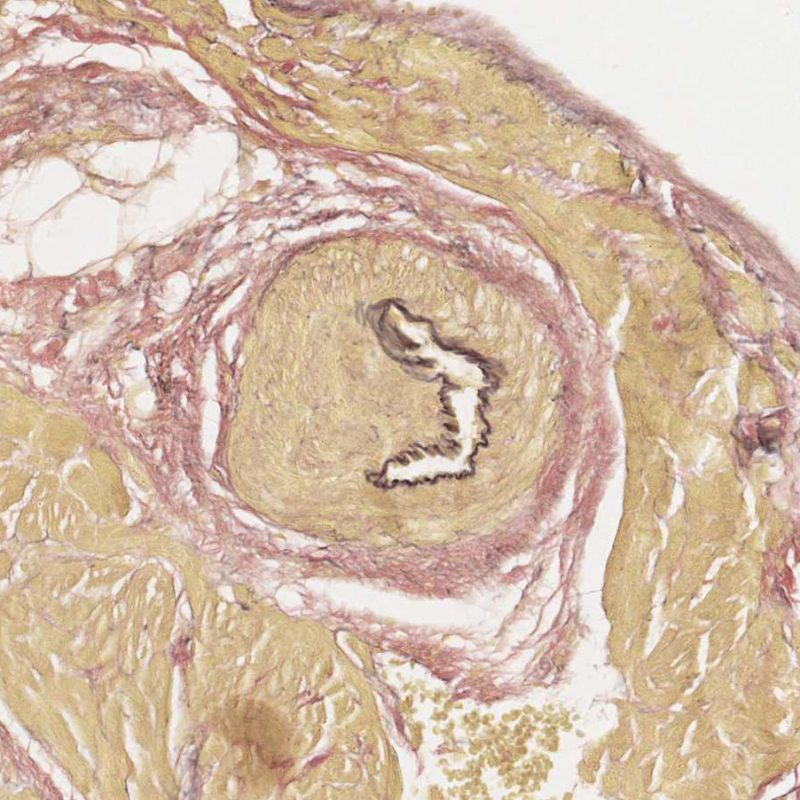
Telescoping of blood vessels
アーチファクトにより、血管内に別の血管が入れ子状に入り込む場合がしばしばあり、”telescoping” と呼ばれる。これは、血管の弾性収縮力により、血管内に血管が入り込んだ状態で、生検鉗子が中隔から組織を引っ張ってサンプリングした際に生じる。組織学的に血管内腔が閉塞しているように見えるため、移植心冠動脈病変(CAV) と紛らわしい場合もあるが、Elastica van Gieson染色等により内外弾性板や内膜に問題のないことを確認することで鑑別可能である。
血管のtelescopingは単に生検部位を反映したもので、臨床的意義はない。サンプリングが心室中隔に非常に近い場所で行われた場合、この領域を走行する左冠動脈前下行枝の小さな貫通枝が偶然採取され、telescopingを認める場合がある。同部位の生検において、極まれに移植心冠動脈病変が診断されることもあるため、血管構造を注意深く観察する必要がある。
生検に伴う出血
生検により、心筋組織に出血を生じる場合がある。重度の拒絶反応(Grade 3R)にみられる出血とは異なり、生検手技に関連する出血は、顕著な炎症や浮腫を伴わない場合が多い。
小児における心筋生検の評価
小児における心移植後の心筋生検は、通常、小児専門施設あるいは成人と小児の両者の移植を実施する施設において施行される。ただし、ルーチンの生検は成人ほど頻回には行われない。前述の成人移植患者における心筋生検標本の解説は、全て小児の患者にも適用されるが、本セクションでは、注意すべき小児特有の所見について解説する。
生検検体の大きさ
小児の中でも、乳児は特に心臓が小さく血管も細いため、小さな生検鉗子を用いる必要がある。このため、採取される組織は非常に小さなものとなるが、拒絶反応の検索に最低3個の心筋組織が必要である点は成人と同様である。
細胞密度
新生児や小児の心筋細胞は、成人と比較して非常に小さい。このため、概して核/細胞質比が高く、炎症細胞浸潤がない場合でも細胞密度が高い印象を受ける。また、内皮細胞が腫大し目立つ印象を与えるため、むやみに抗体関連拒絶反応と診断しないよう、注意を払う必要がある。
拒絶反応の頻度
我々の施設において、小児(1-18歳)における拒絶反応の発生頻度は、成人の約2倍であった。小児患者に拒絶反応が多い理由としては、第一に十代の移植患者の服薬コンプライアンスの悪さが挙げられる。また高齢者と比較して、小児では免疫応答がより強いことも一因かもしれない。病理医にとっては、成人よりも小児における拒絶反応に遭遇する機会が多いと思われるが、それは極めて当然な結果である。