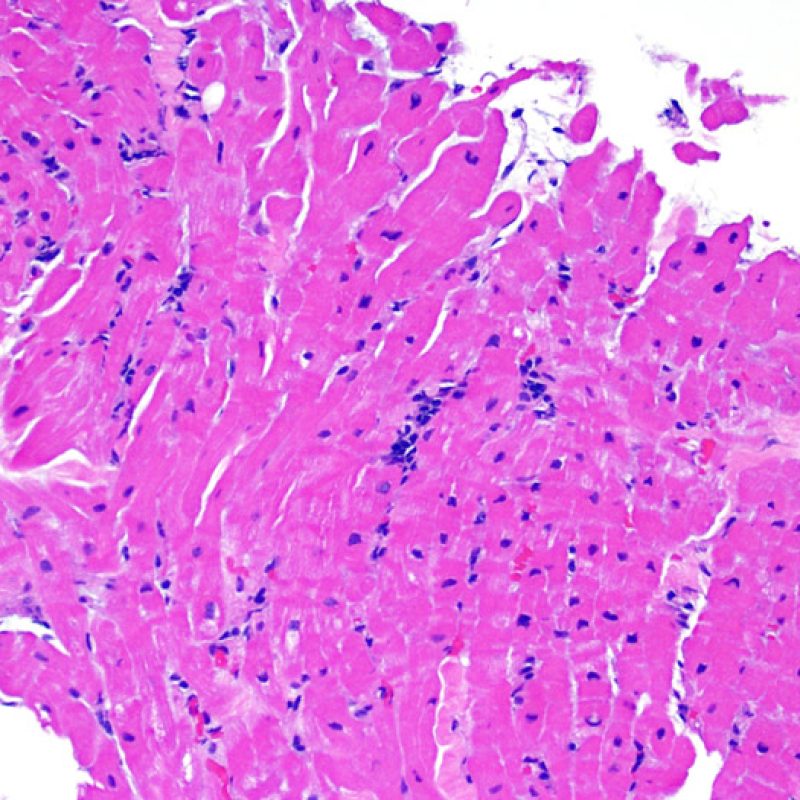
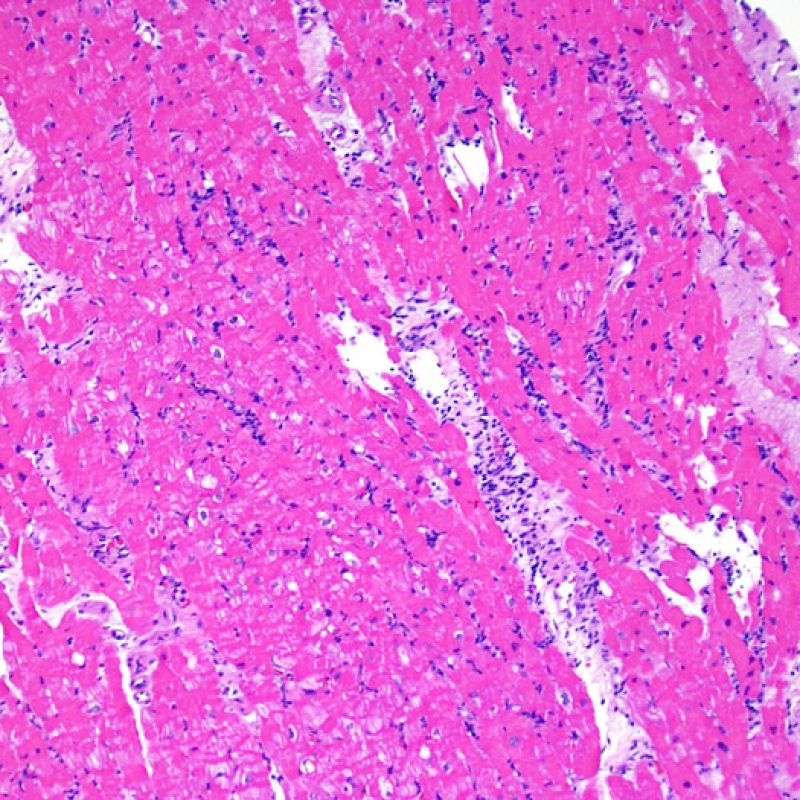
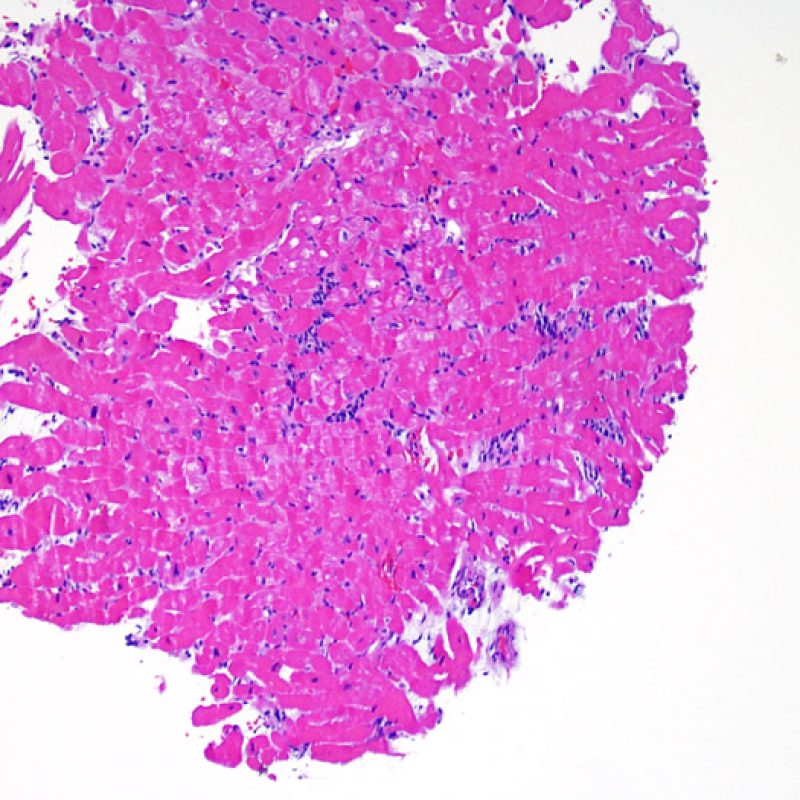
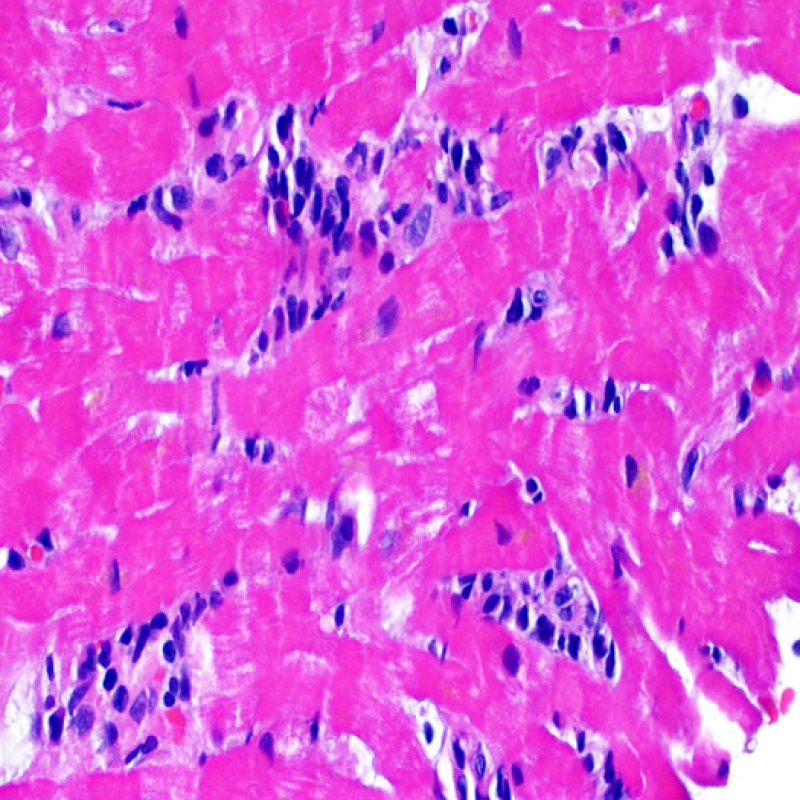
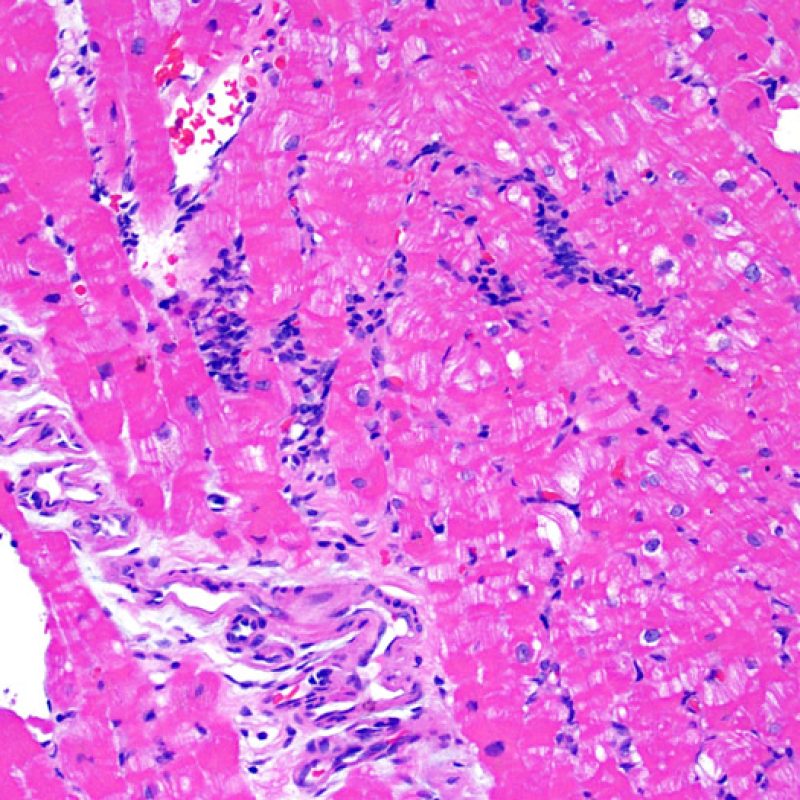
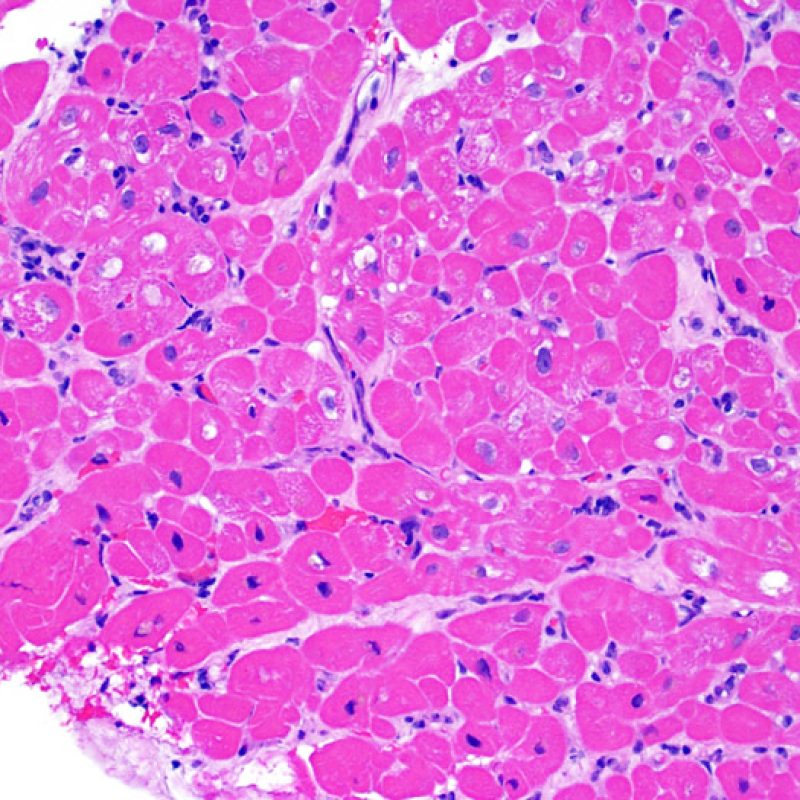
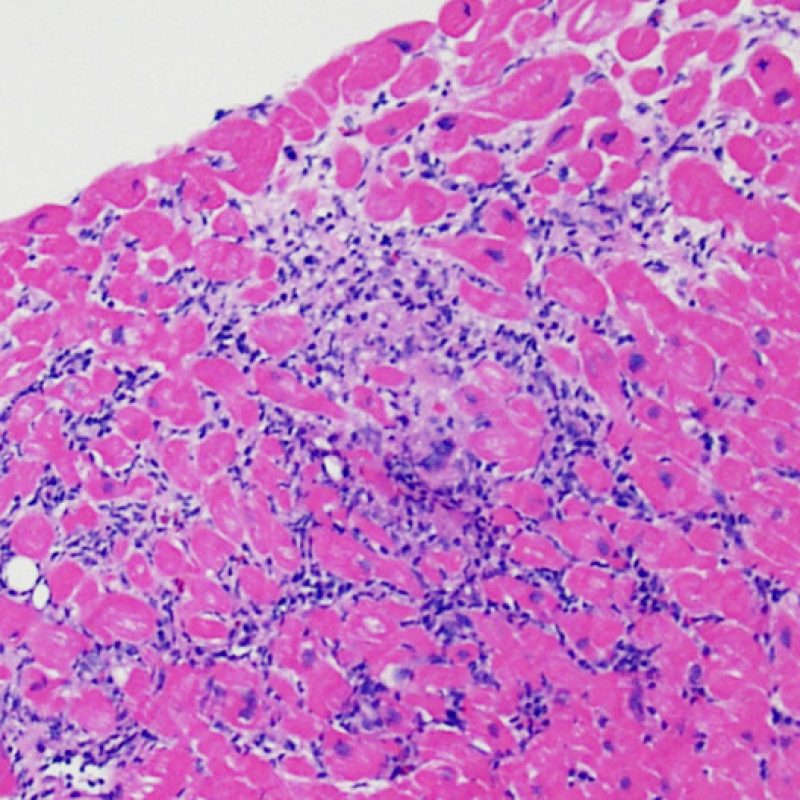
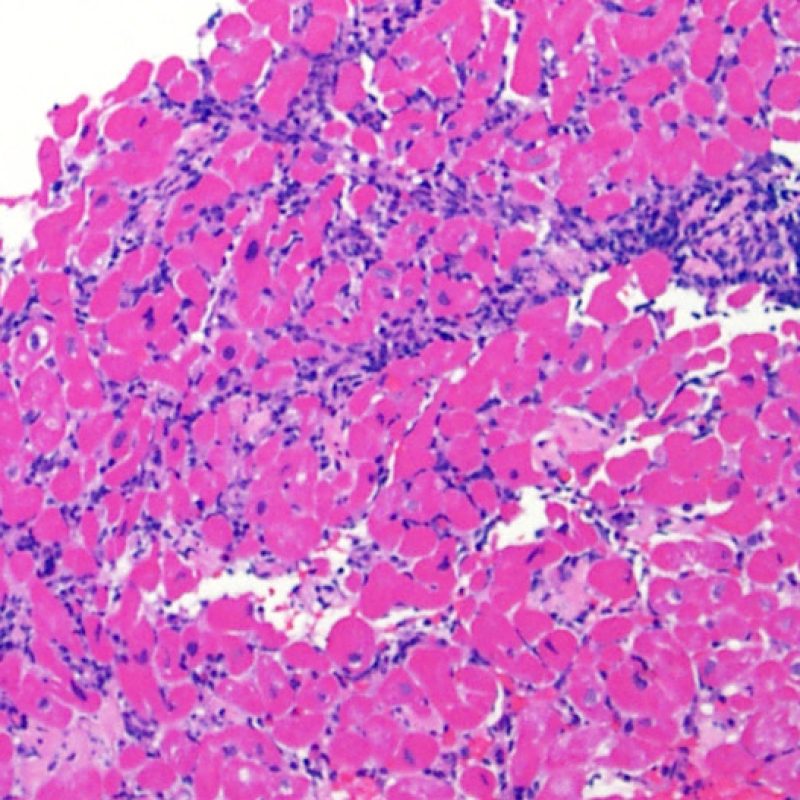
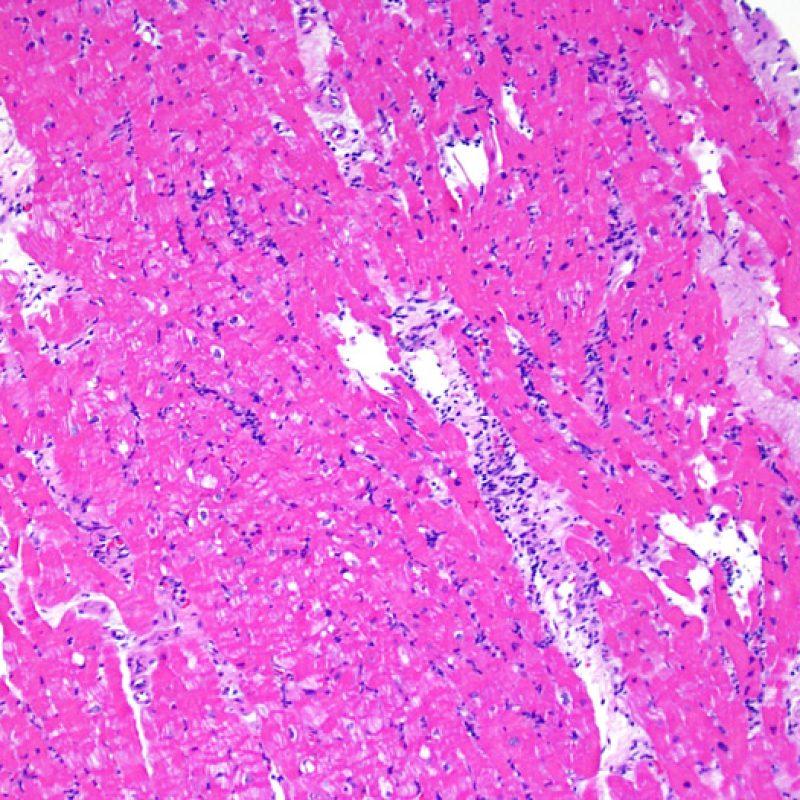
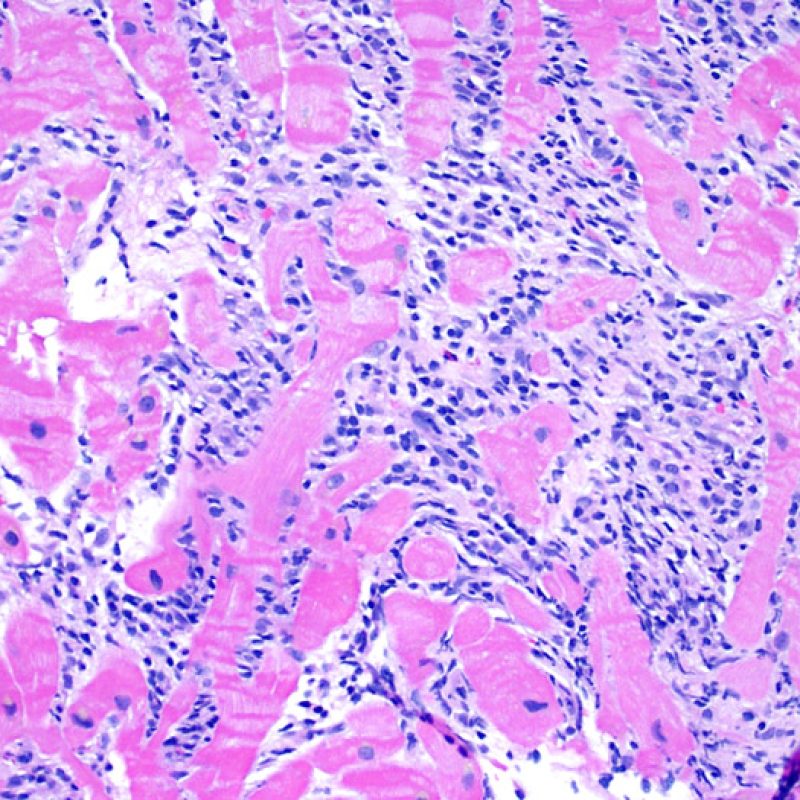
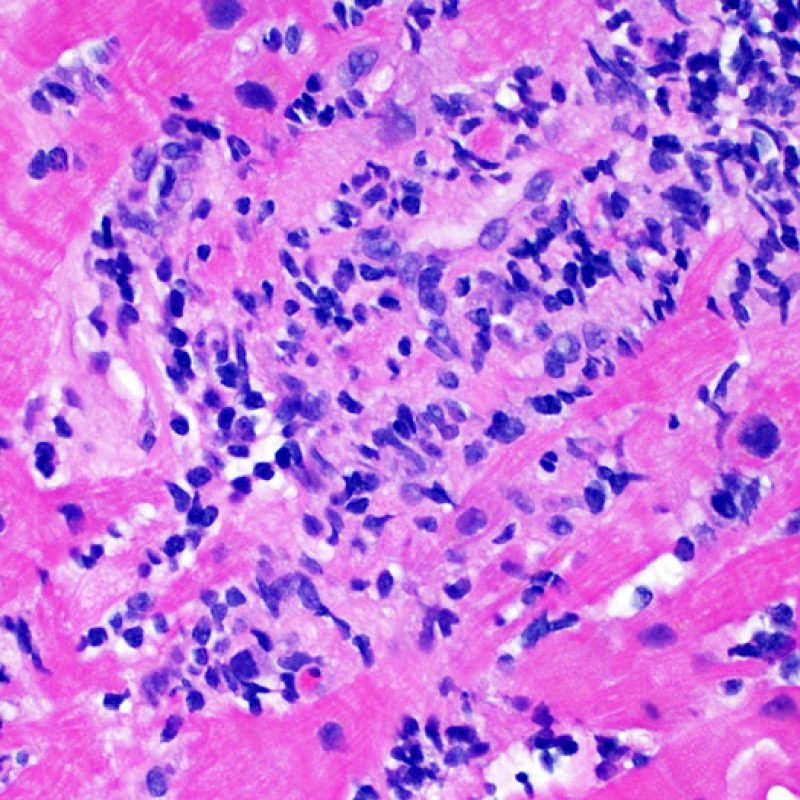
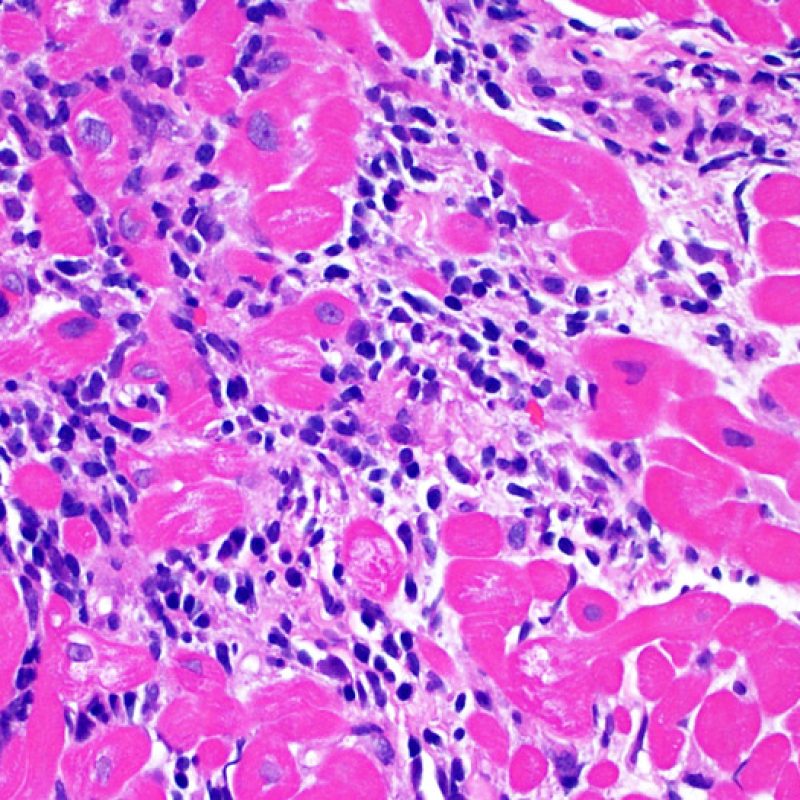
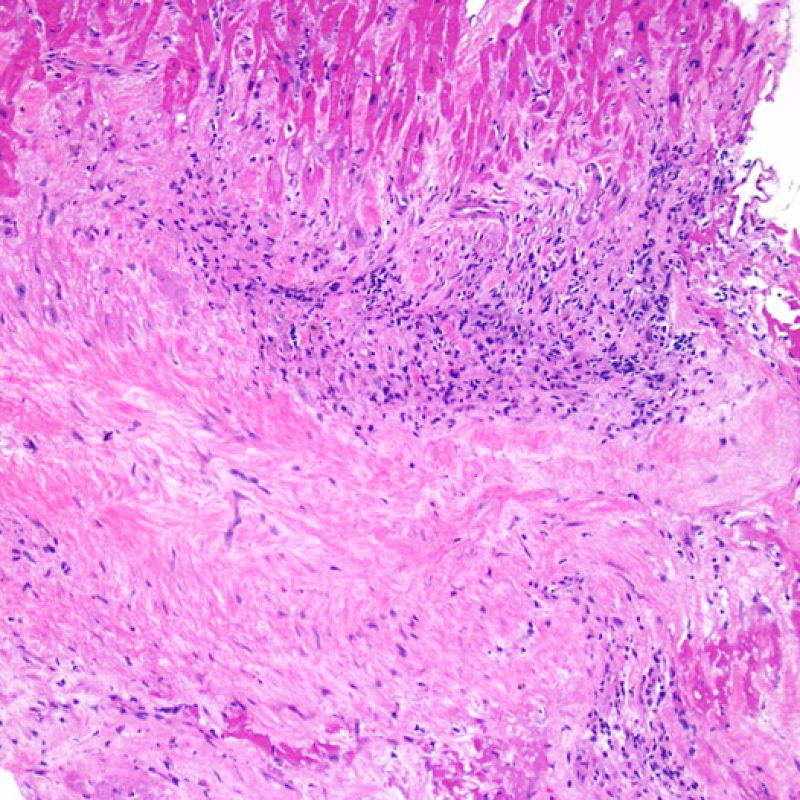
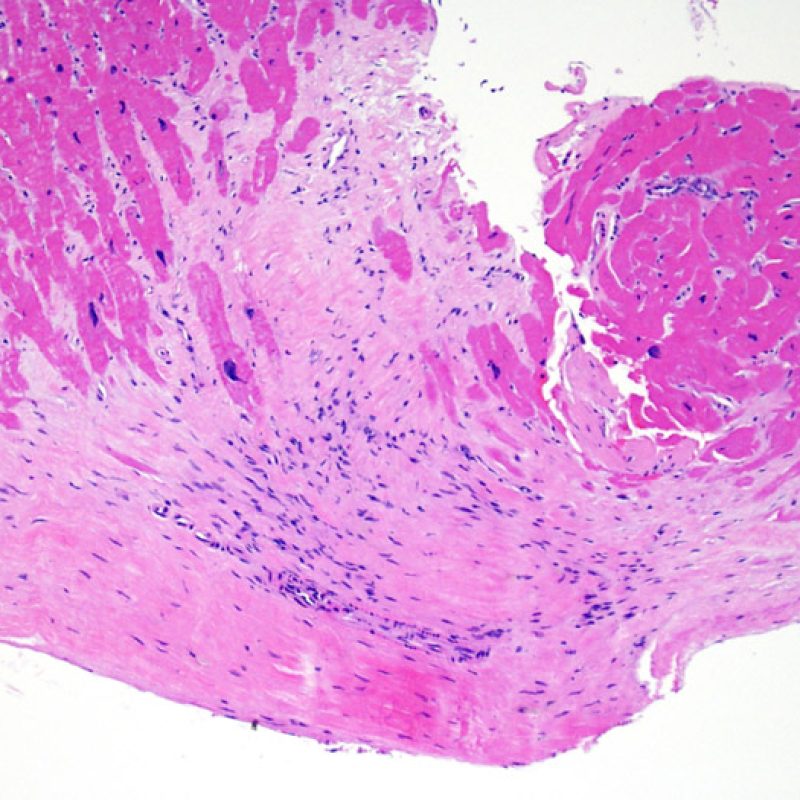
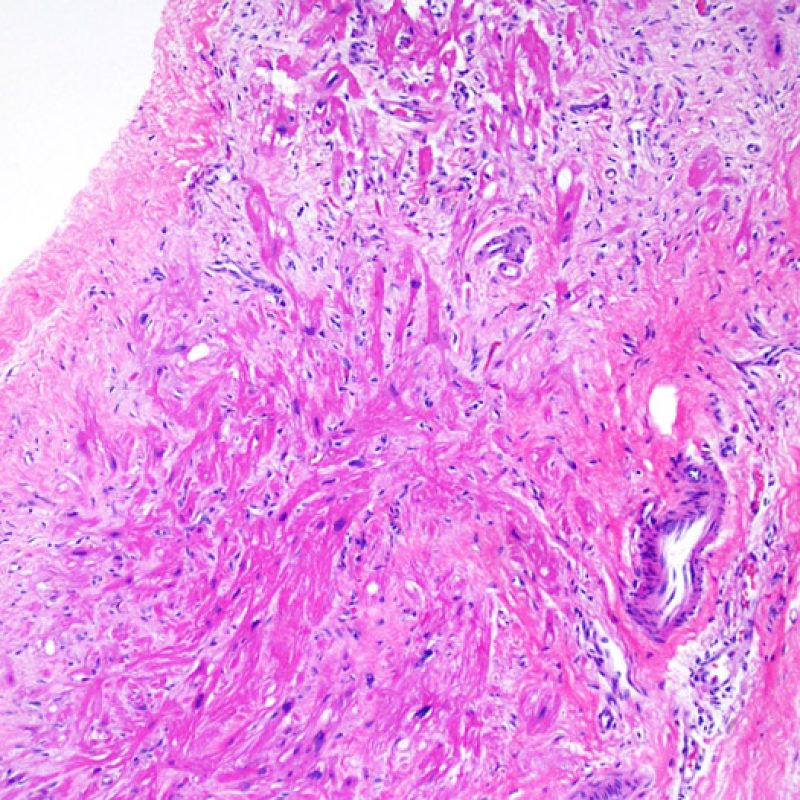
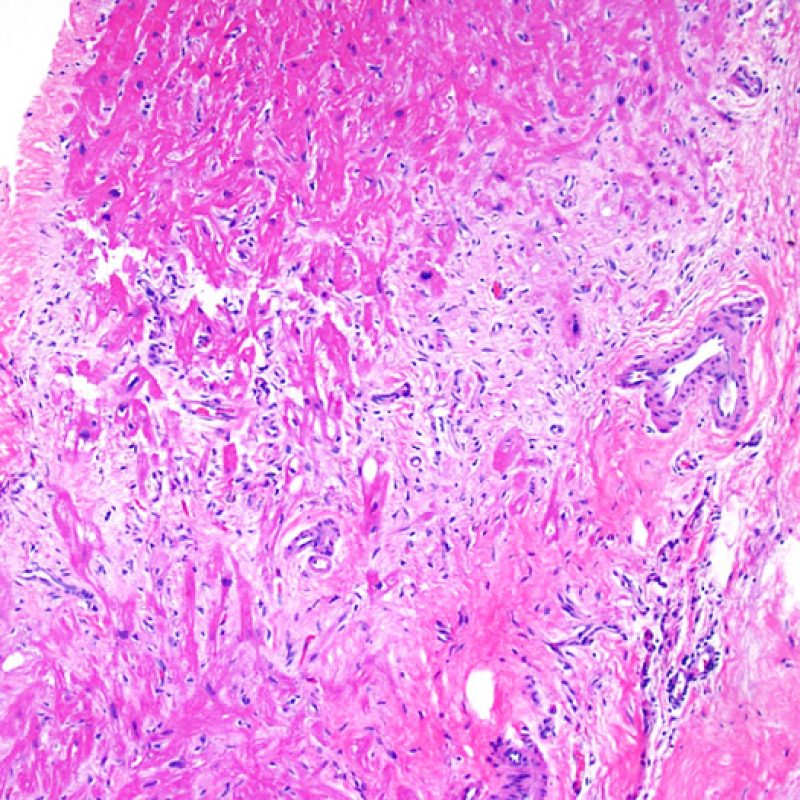
Consideraciones Generales
Bienvenidos a la página web de la Sociedad de Patología Cardiovascular (SCVP) y la Asociación Europea de Patología Cardiovascular (AECVP), donde se ofrece un tutorial sobre la interpretación de resultados de la biopsia endomiocárdica en el rechazo agudo celular del trasplante cardíaco. El objetivo de este tutorial es educar a los patólogos en un método de interpretación y en los hallazgos histopatológicos que se observa en este material de biopsia.
Este tutorial consta de 7 secciones que cubren todos los aspectos de la biopsia endomiocárdica. El menú de la banda izquierda permite al usuario pasar directamente al área de interés. Todas las imágenes se pueden ampliar haciendo un clic sobre ellas (para encoger la foto haga otro clic). Hemos creado un auto-cuestionario usando preparaciones virtuales de casos concretos, para asegurar que ha comprendido los criterios que determinan el rechazo celular y no se confunde con otros hallazgos histológicos.
El proceso de creación de este tutorial ha pasado por dos fases: la creación y la edición de los documentos. La información sobre los miembros de este comité se puede encontrar en la página “agradecimiento”. Ellos son los únicos responsables del contenido de este documento. Está en marcha la creación de un tutorial sobre el rechazo mediado por anticuerpos (RMA), del que solo habrá una breve referencia en este tutorial.
La biopsia endomiocárdica
La biopsia endomiocárdica (BEM) es un procedimiento clínico establecido utilizado para la obtención de tejido miocárdico. Se suele realizar con anestesia local pasando un biotomo (ver esquema) a través de la vena yugular interna derecha, cruzando la válvula tricúspide hacia el ventrículo derecho. El muestreo se realiza generalmente bajo orientación fluoroscópica (o menos comúnmente ecocardiográfica), tomándose las muestras a lo largo del septo interventricular.
La indicación más común y establecida para BEM es la vigilancia y control de rechazo del trasplante cardíaco, incluyendo ambos tipos mediado por células y mediado por anticuerpos. Sigue siendo el único método fiable para el diagnóstico de rechazo cardiaco. Los protocolos establecidos por los centros para esta vigilancia generan numerosas biopsias, especialmente en los primeros meses del trasplante, para a continuación descender en número y frecuencia, basado en el estilo y experiencia individual de cada institución.
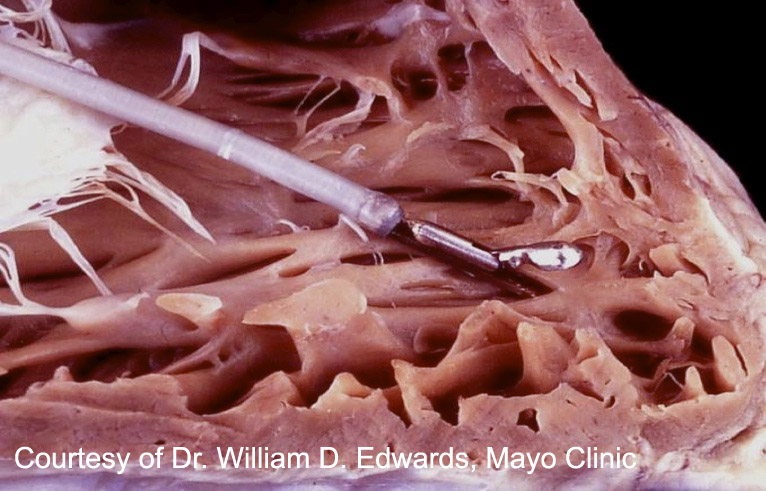

Cómo procesar una biopsia
Número de muestras a obtener: La Sociedad Internacional de Trasplante de Corazón y Pulmón (ISHLT) aconseja obtener un mínimo de 3 fragmentos de la pared del ventrículo derecho para una evaluación apropiada de rechazo del trasplante; no obstante se ha demostrado que 5 fragmentos mejoran la sensibilidad de la prueba. Cabe destacar que las muestras deben recogerse individualmente y sin cortar después de la toma de biopsia con el ánimo de aumentar el número de fragmentos.
Manipulación de los tejidos: El cardiólogo debe retirar la muestra del catéter con una aguja y colocarlo en una gasa empapada con una solución salina isotónica. El fragmento de biopsia debe ser manejado lo mínimo posible después de la recogida y nunca deben utilizarse pinzas para separar la muestra del catéter.
El procesamiento de las muestras de tejido: Para la evaluación de rechazo, las muestras deben ser fijadas inmediatamente en formalina tamponada neutra al 10%. A continuación se incluirán en parafina y serán seccionadas y teñidas de acuerdo con los protocolos en uso del laboratorio. También se pueden llevar a cabo estudios de inmunofluorescencia para el diagnóstico o seguimiento del rechazo mediado por anticuerpos, dependiendo de los protocolos específicos de cada laboratorio. En este caso sería necesario recoger un fragmento adicional y congelarlo instantáneamente.
Portas para procesar:La mayoría de instituciones utilizan de 3 a 4 portas que contienen al menos tres secciones de 3 a 5µm teñidas con H&E cada uno. Algunas instituciones colocan hasta 8 secciones en un solo porta. El punto importante es que para evaluar adecuadamente el proceso de rechazo deben considerarse un mínimo de 10 secciones, independientemente del número de portas que la institución decida utilizar.
Estudios complementarios: Para evaluar cambios de rechazo mediado por anticuerpos (RMA) en la muestra de biopsia es frecuente solicitar inmunofluorescencia o inmunohistoquímica para C4d al mismo tiempo que las secciones iniciales con H&E. Algunas instituciones utilizan habitualmente CD68 (un marcador histiocítico) o C3d como parte de su investigación de RMA. El RMA será tratado ampliamente en un tutorial aparte.
Como evaluar si el muestreo es adecuado
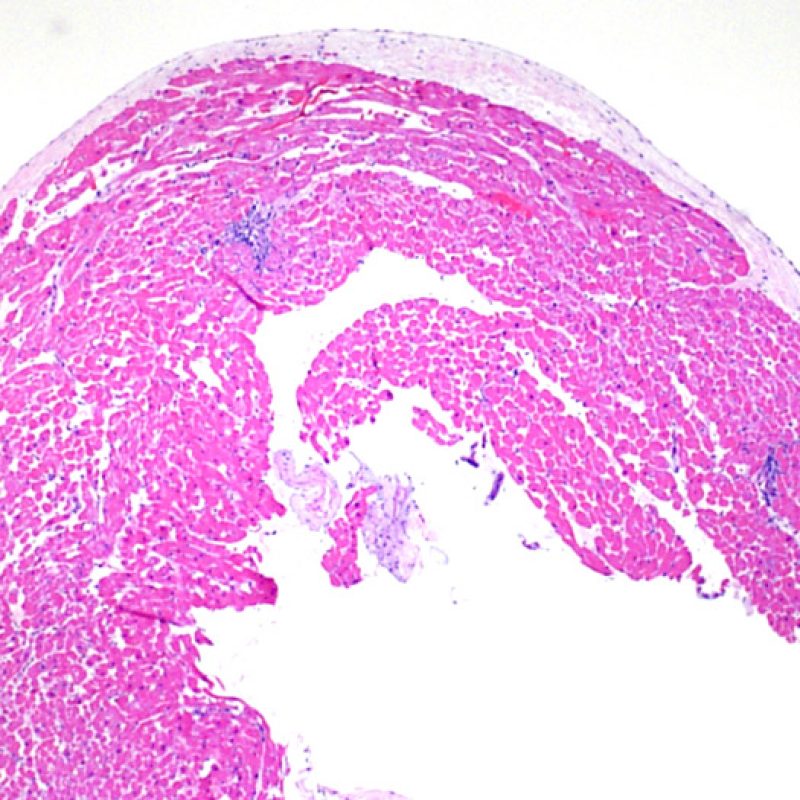
Un muestreo adecuado debe consistir en al menos 3 fragmentos de biopsia, cada uno de los cuales esté constituido por miocardio en al menos el 50% del fragmento. Si el tejido es insuficiente, en primer lugar debemos asegurarnos de que todos los fragmentos presentes en la inclusión han sido suficientemente expuestos en las secciones para microscopía. Los pacientes con trasplante de corazón son sometidos a numerosas biopsias de control y el biotomo tiende a menudo, por razones mecánicas, a muestrear la misma región del ventrículo. Por lo tanto es muy probable encontrar áreas con fibrosis, infiltración grasa, etc., y es bastante común ver tejido de granulación o formación de cicatriz de una biopsia previa. Un cardiólogo con experiencia en la realización de la BEM es capaz de reconocer, basado en el color y la apariencia del fragmento de biopsia, si la muestra es de miocardio, trombo o tejido fibroso.
¿Qué hacer con una biopsia inadecuada?:
- Si hay cambios de rechazo celular o de rechazo mediado por anticuerpos, estos deben ser informados independientemente de la idoneidad de las muestras.
- Si no hay cambios de rechazo y la muestra no cumple los criterios de idoneidad, hay que señalar con un comentario la falta de adecuación de la BEM y la posibilidad de que el resultado represente un falso negativo.

Comunicación de los resultados
El informe de patología debe ser conciso y estandarizado para transmitir eficientemente la información pertinente al profesional encargado (por lo general al cardiólogo). Un diagnóstico completo, además de la presencia o ausencia de rechazo, debe incluir el número de muestras analizadas, el número de fragmentos con lesiones de rechazo, la presencia de lesiones Quilty, así como cambios morfológicos relacionados con infección o con lesiones isquémicas.
Aquí se facilita una plantilla de ejemplo para el formato de los informes de patología.

Criterios de gradación
En esta sección del tutorial se explican los criterios de gradación revisados por la Sociedad Internacional de Trasplante de Corazón y Pulmón (ISHLT).
Consideraciones generales de Sistema de Gradación
En 1990, la Sociedad Internacional de Trasplante de Corazón y Pulmón (ISHLT) desarrolló un método de gradación estandarizado para la evaluación del rechazo agudo celular en la biopsia endomiocárdica. Estos criterios de clasificación se revisaron en 2004 y son conocidos como criterios ISHLT-2004. La nueva clasificación establece cuatro grados de rechazo: 0R, 1R, 2R y 3R. La letra R (“revisado”) se ha puesto para evitar la confusión con el sistema de gradación anterior, el ISHLT 1990 (0, 1A, 1B, 2, 3A, 3B, 4). En la mayoría de los centros, los grados 0R y 1R no implican un tratamiento inmunosupresor adicional, mientras que los grados 2R y 3R son tratados con un incremento de la inmunosupresión. Por consiguiente, es esencial que el patólogo sepa distinguir el rechazo de bajo grado (0R y 1R) de los de alto grado (2R y 3R).

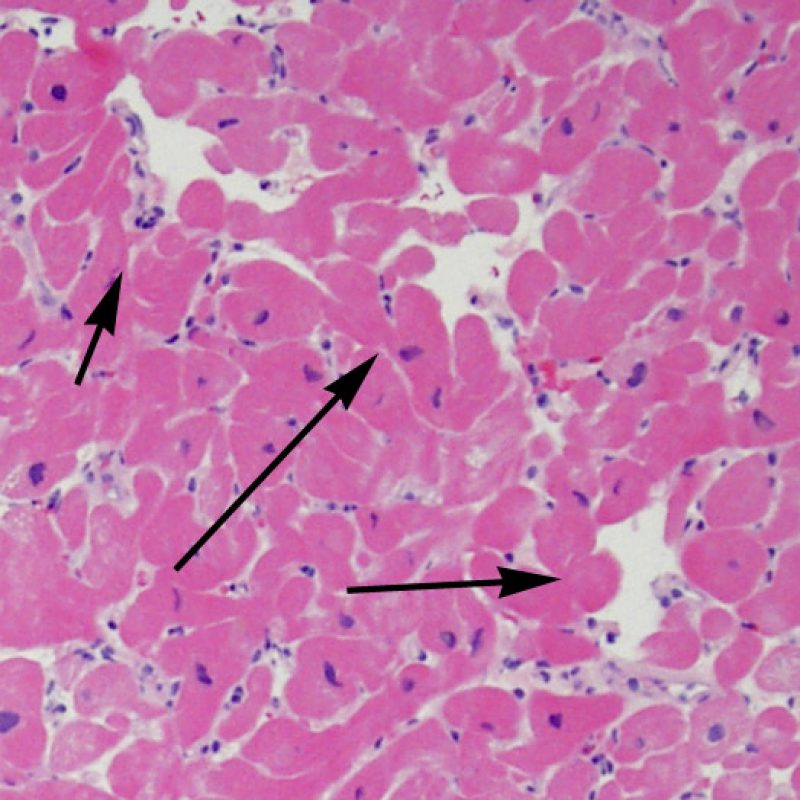
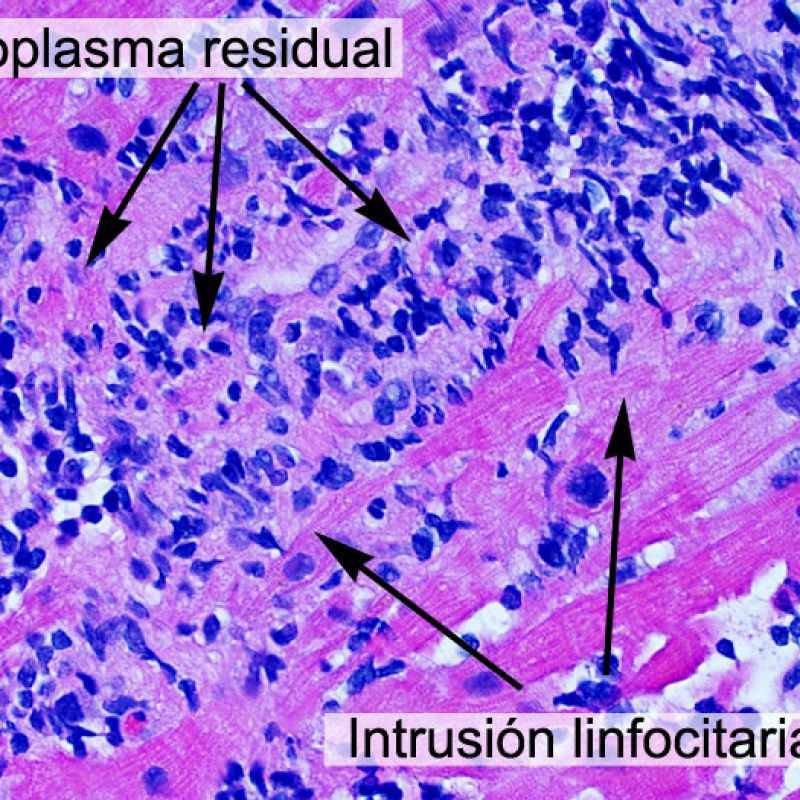
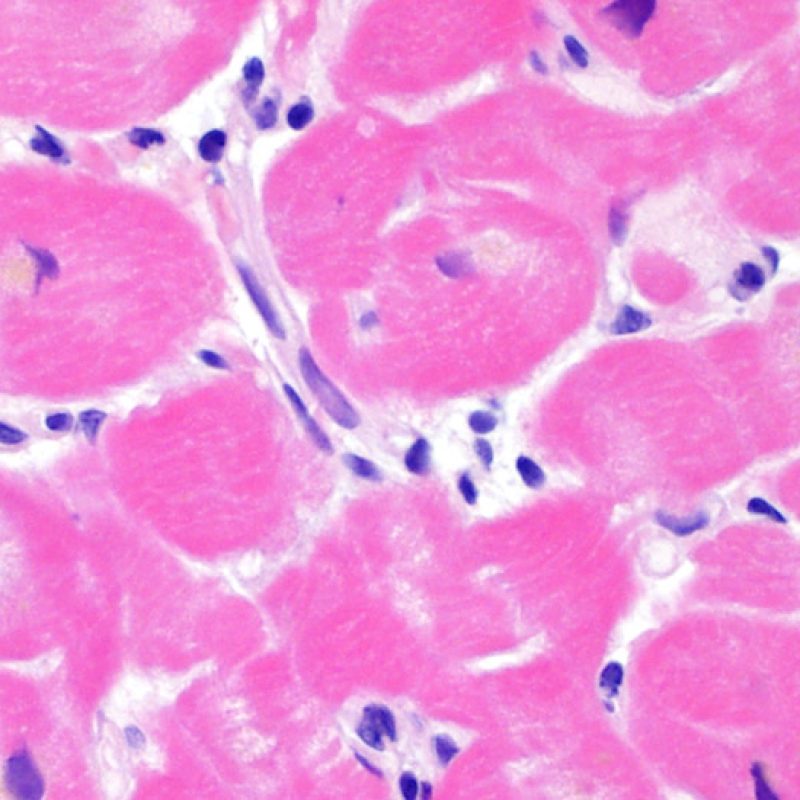
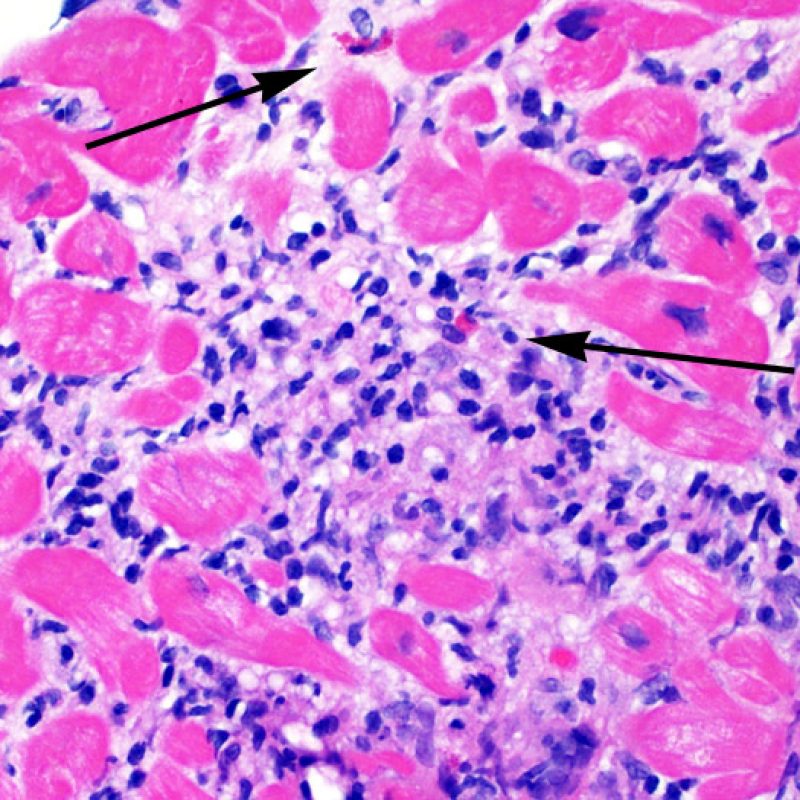
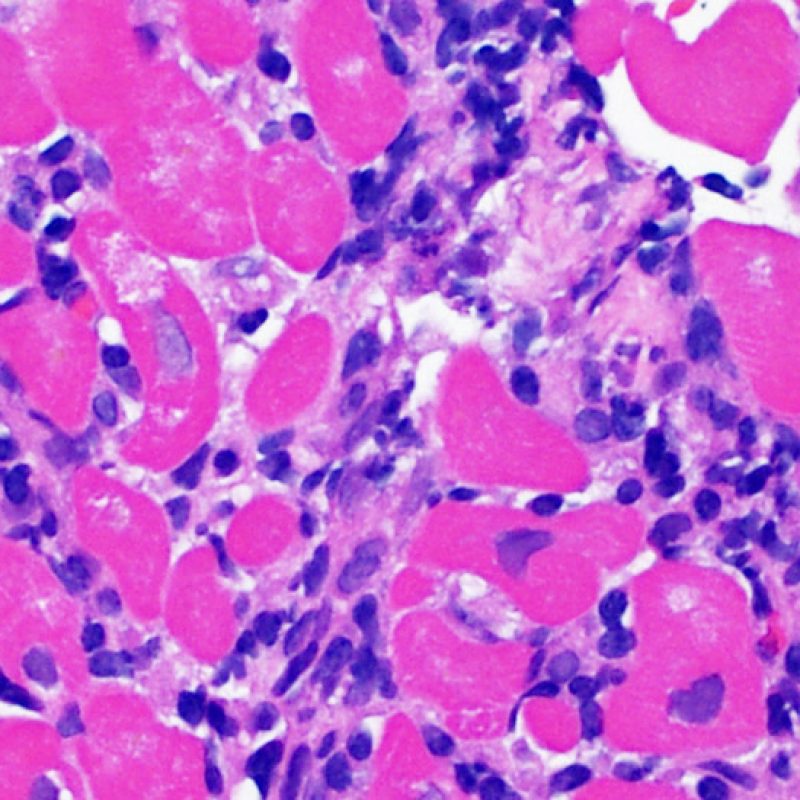
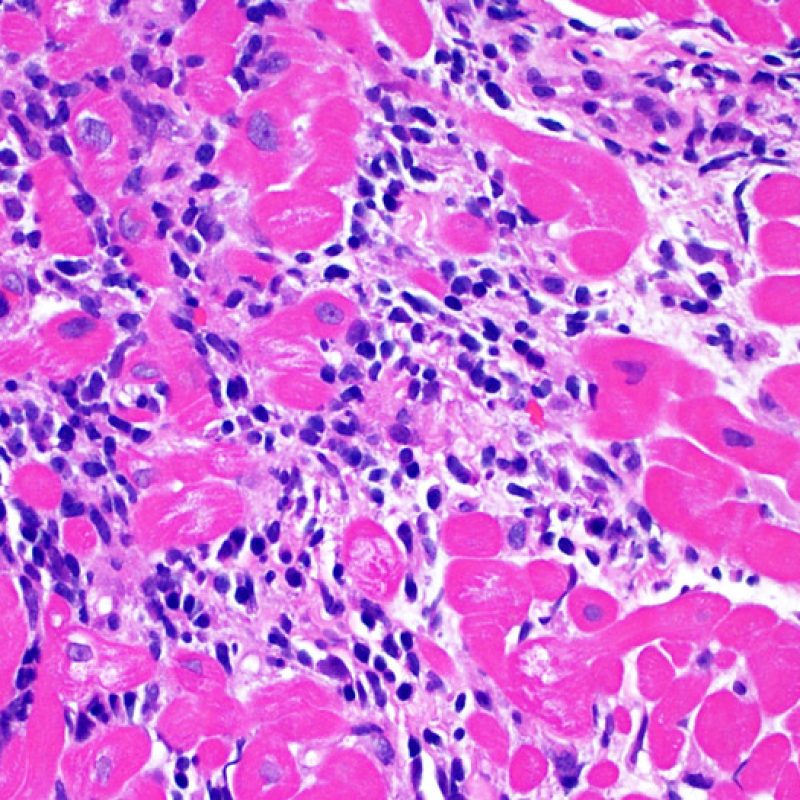
Los dos elementos clave para el diagnóstico de rechazo celular agudo son la presencia de infiltrado linfocitario y el daño miocítico. Otros cambios de la biopsia endomiocárdica pueden imitar las lesiones de rechazo, pueden ser artefactos, pueden representar pistas útiles para diagnosticar rechazo u otras enfermedades. Por lo tanto, es importante reconocer que el éxito de la interpretación de una biopsia endomiocárdica por rechazo depende de la evaluación de sólo dos características – infiltración y daño.
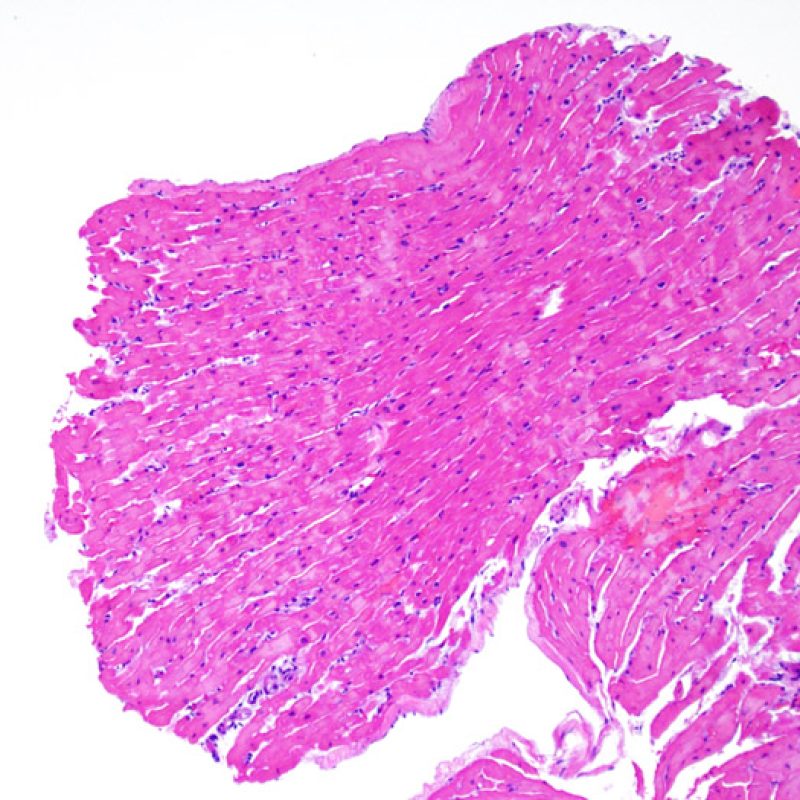
Ausencia (no evidencia) de rechazo (0R)
El grado 0R – no evidencia de rechazo – se caracteriza por la ausencia de infiltrados inflamatorios. El cuadro histológico corresponde a la de una biopsia limpia sin alteraciones endomiocárdicas. Pueden estar presentes otras lesiones, tales como efectos Quilty o cambios de sitio previo de biopsia. Éstas no están involucradas en la determinación del grado de rechazo y deben indicarse por separado.
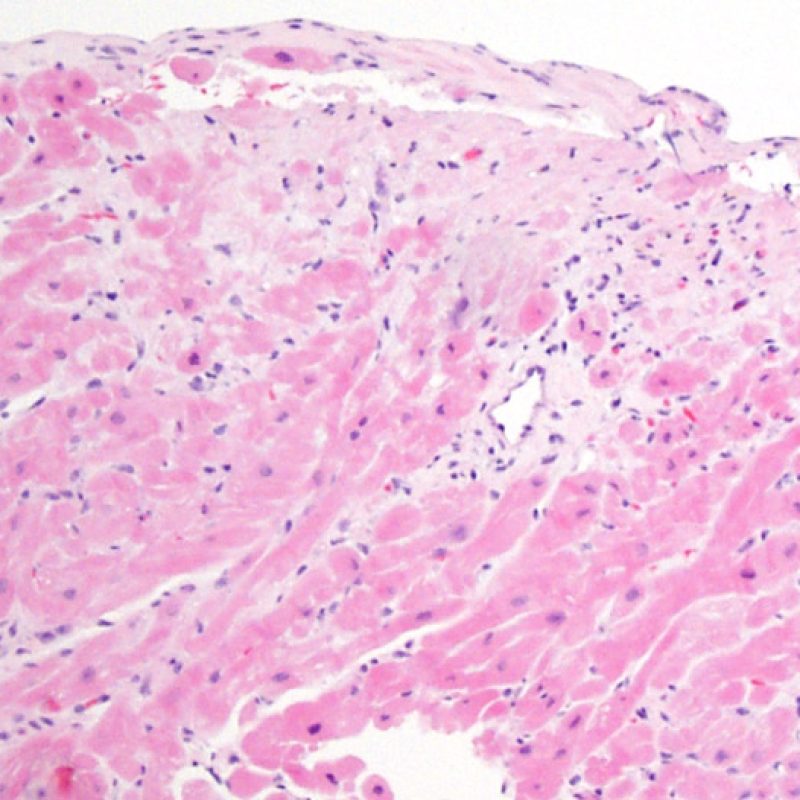
Rechazo leve (1R)
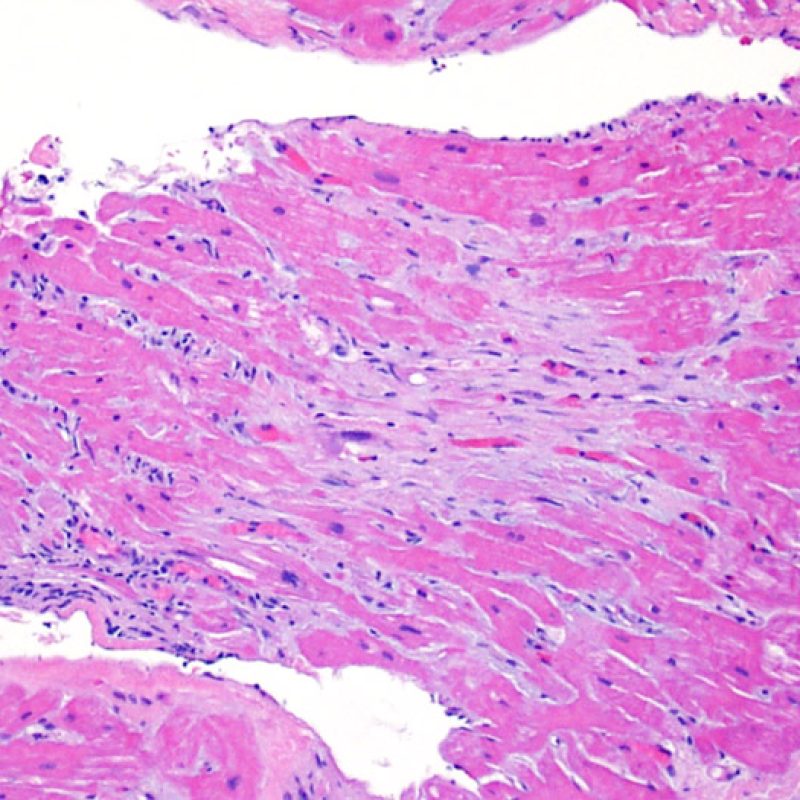
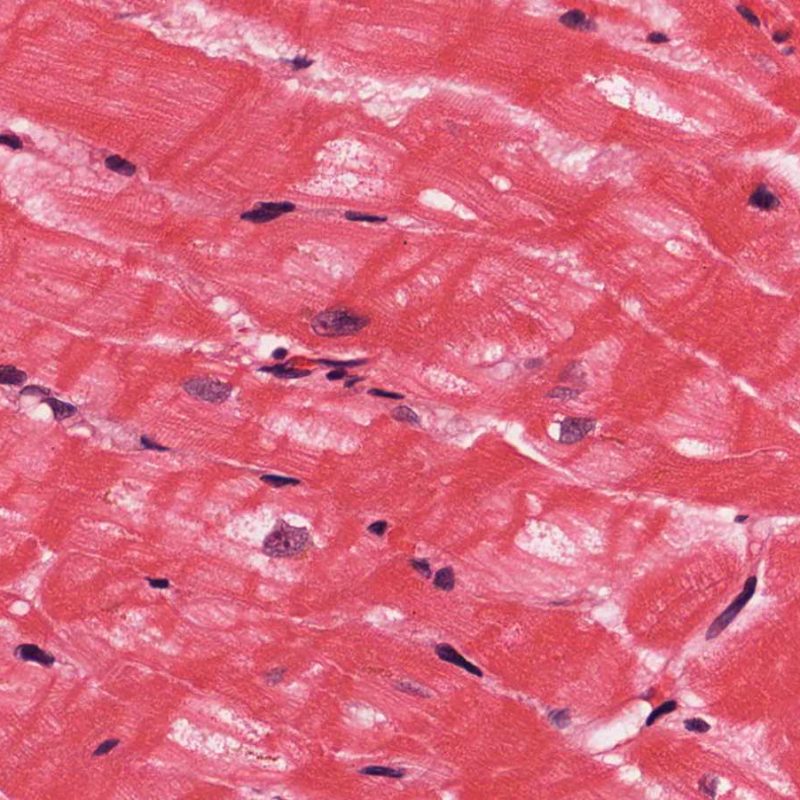
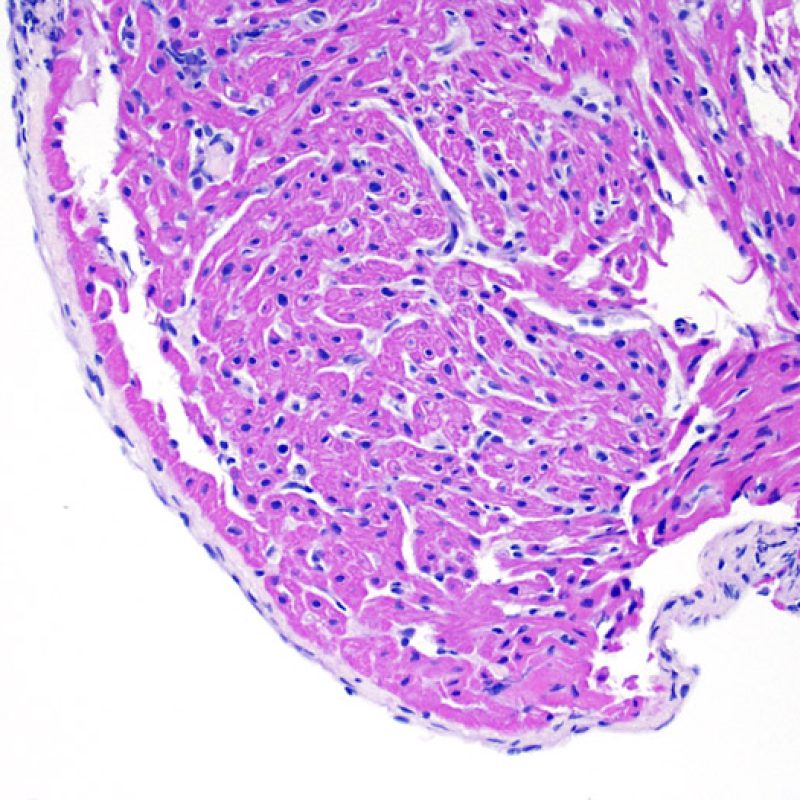
El rechazo leve (1R) se caracteriza por la presencia de infiltrados inflamatorios perivasculares y/o intersticiales con un solo foco de daño miocítico asociado como máximo. Un amplio abanico de biopsias encajan en esta categoría ya que esta definición incluye cualquier cantidad de linfocitos en cualquiera de sus patrones. Las infiltraciones pueden ir desde unos pocos linfocitos perivasculares hasta una infiltración linfocítica extensa que no daña a más de un foco de miocitos. La severidad del infiltrado inflamatorio puede ser similar a la del rechazo de grado moderado [2R], pero se distingue precisamente de él en la medida del daño miocítico. Por otra parte, en general los infiltrados de de rechazo grado 1R no incluyen eosinófilos ni neutrófilos.
Las biopsias con un sólo foco de daño miocítico son particularmente problemáticas. ¿Hallamos solo un foco de daño miocítico debido a que la biopsia no era del todo adecuada? ¿Quizás sea un efecto Quilty imitando el daño miocítico? En el marco del rechazo 1R es importante que el patólogo comunique directamente al clínico en el caso de un infiltrado inflamatorio significativo o si existe un foco de daño miocítico.
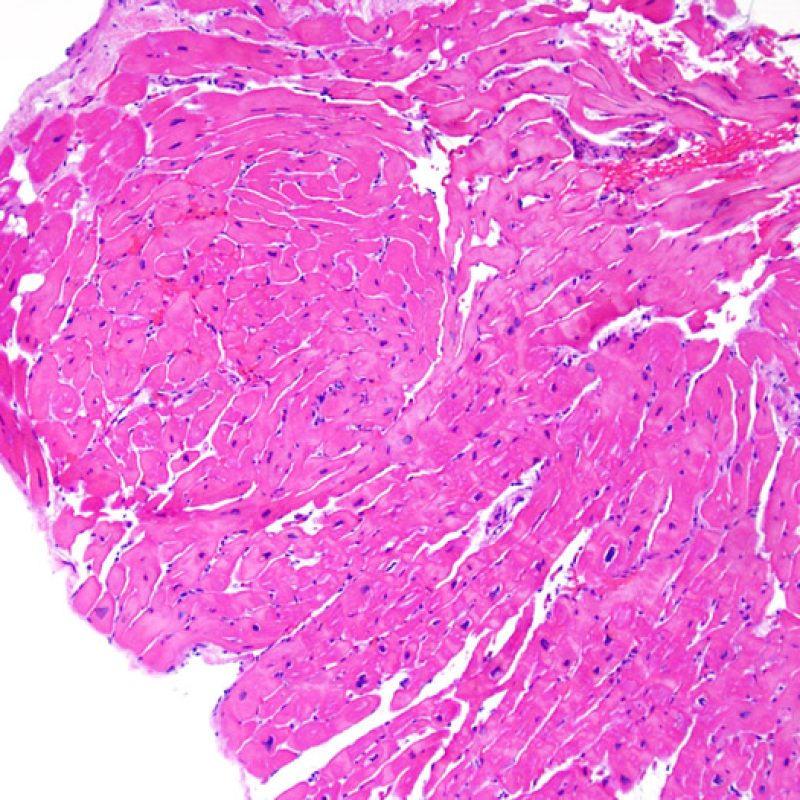
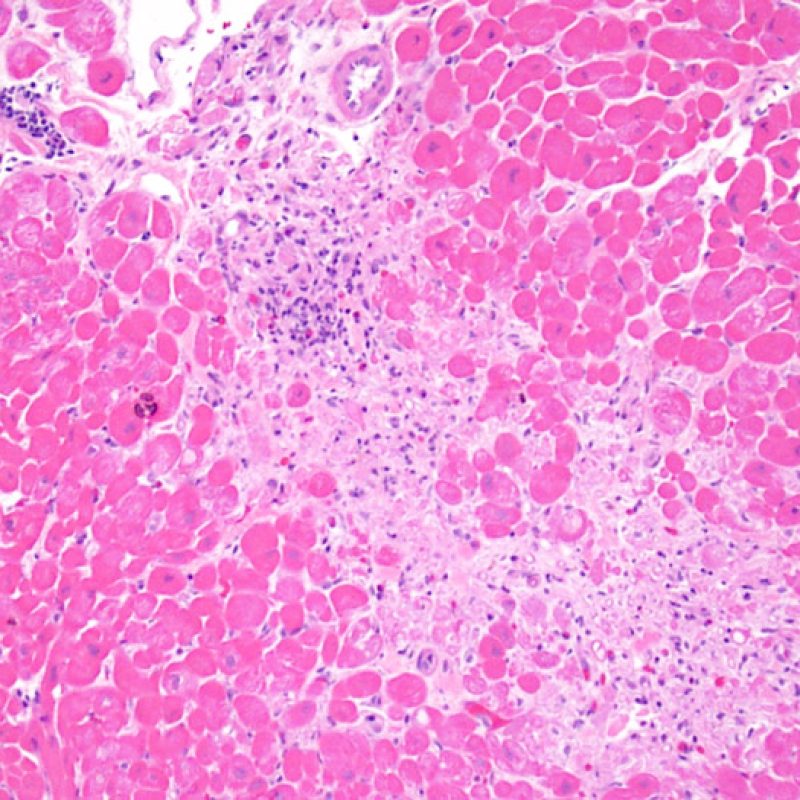
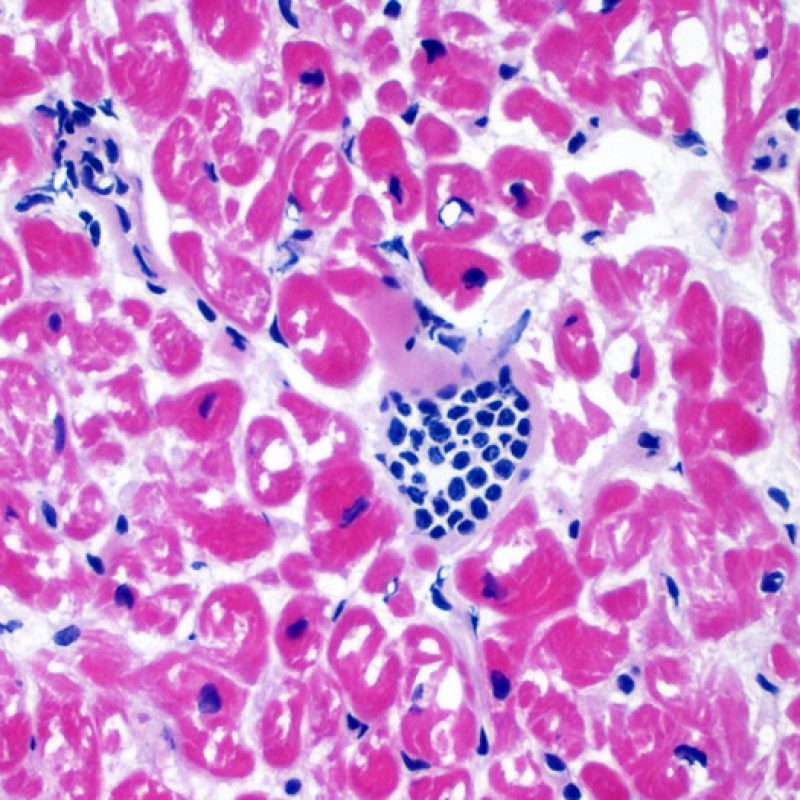
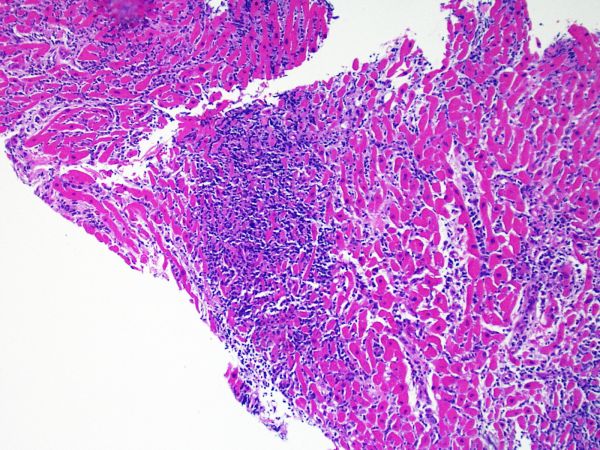
Rechazo moderado (2R)
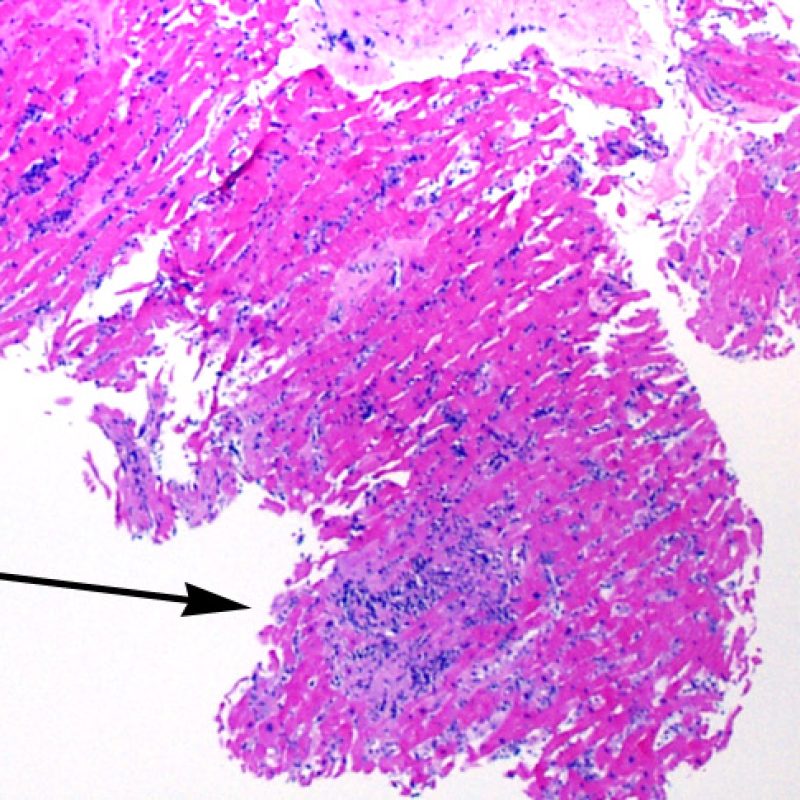
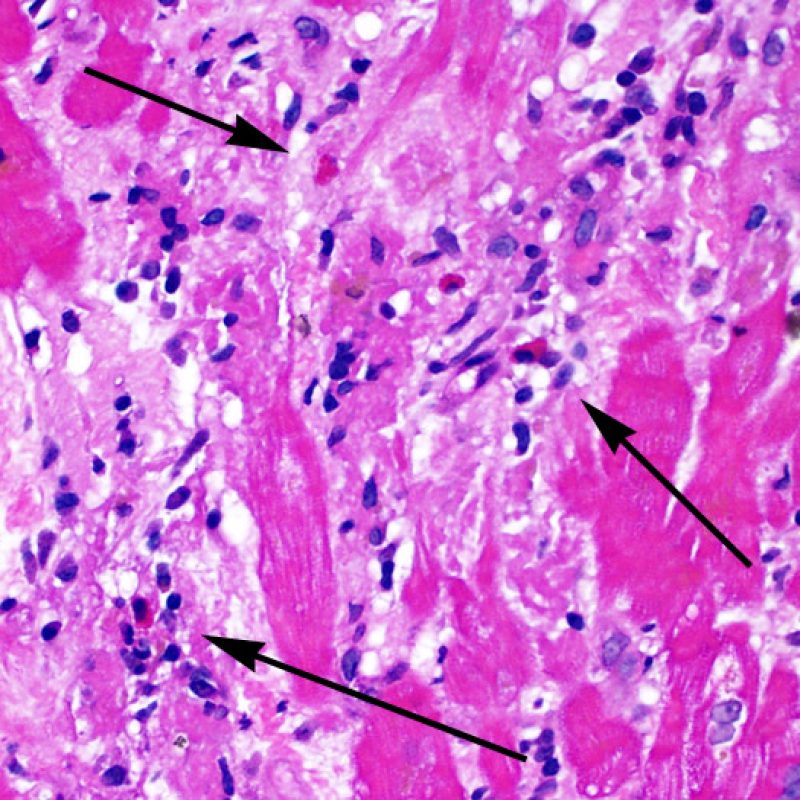
El rechazo moderado (2R) se caracteriza por dos o más focos de infiltrado inflamatorio con lesiones miocíticas asociadas. Estos focos pueden hallarse en el mismo fragmento de biopsia, a corta distancia uno de otro, o aparecer en distintos fragmentos o a diferentes niveles de corte de las muestras. Este grado de rechazo suele asociarse a un infiltrado celular moderado en toda la biopsia. En ausencia de un infiltrado difuso significativo, deberíamos preguntarnos si no estamos sobrestimando el daño miocítico y por lo tanto deberíamos considerar la posibilidad de otras lesiones que simulan el rechazo. En caso de rechazo 2R es de buena práctica comunicar personalmente a los clínicos este diagnóstico para garantizar el tratamiento oportuno.
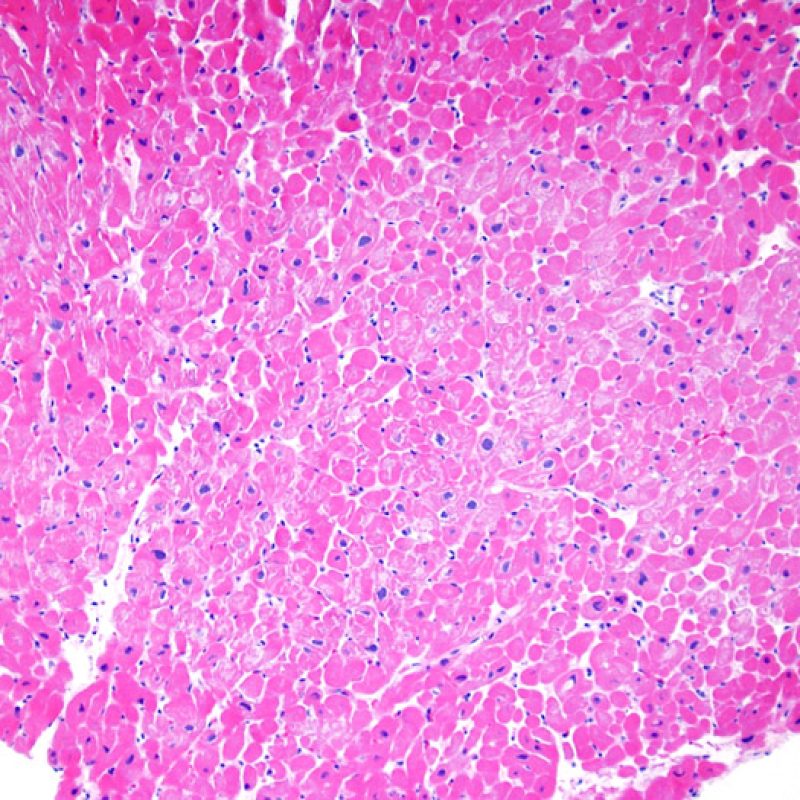
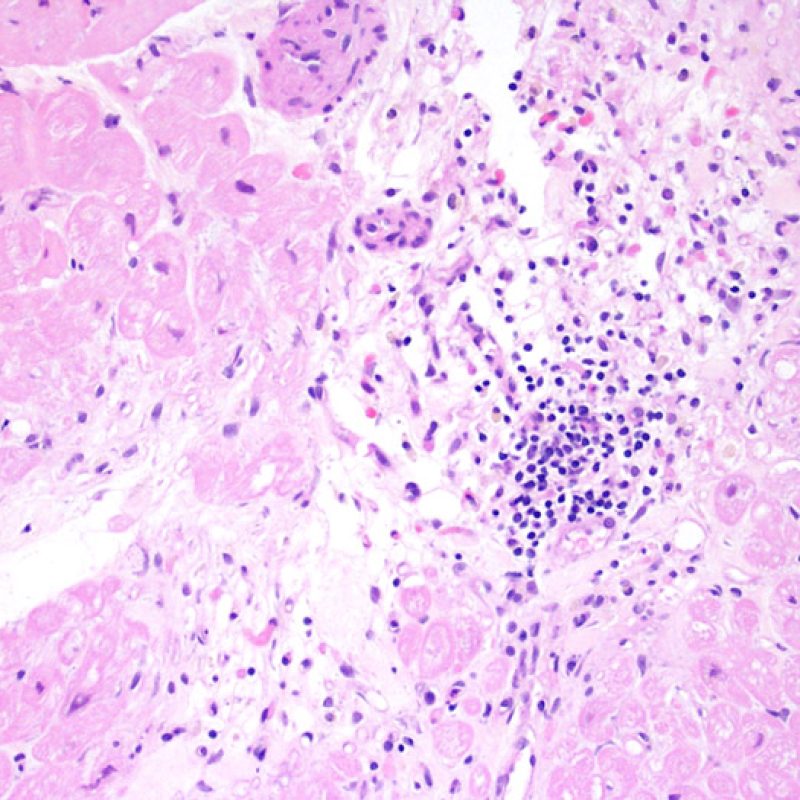
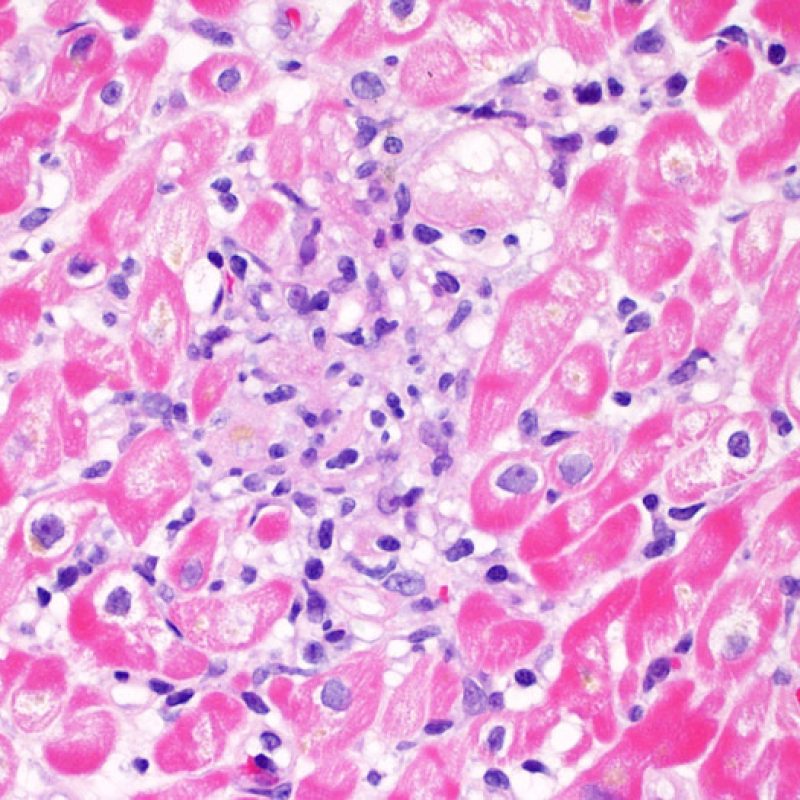
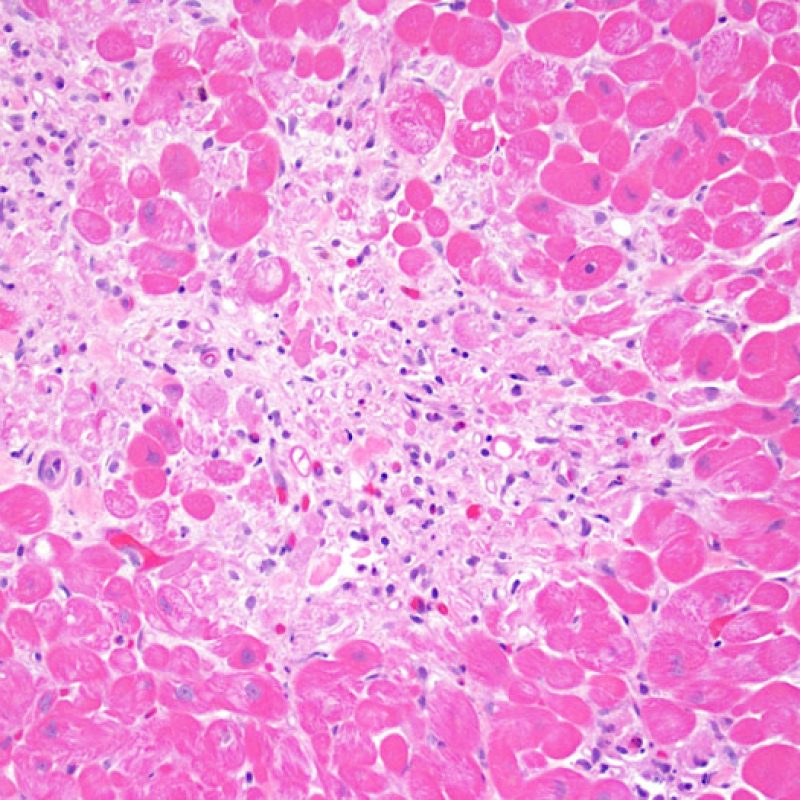
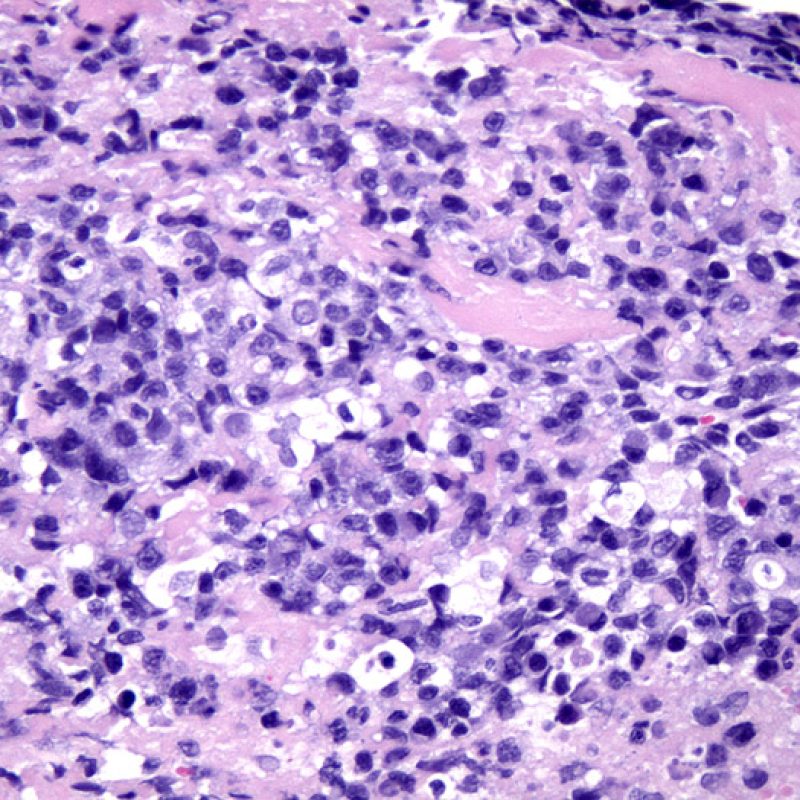
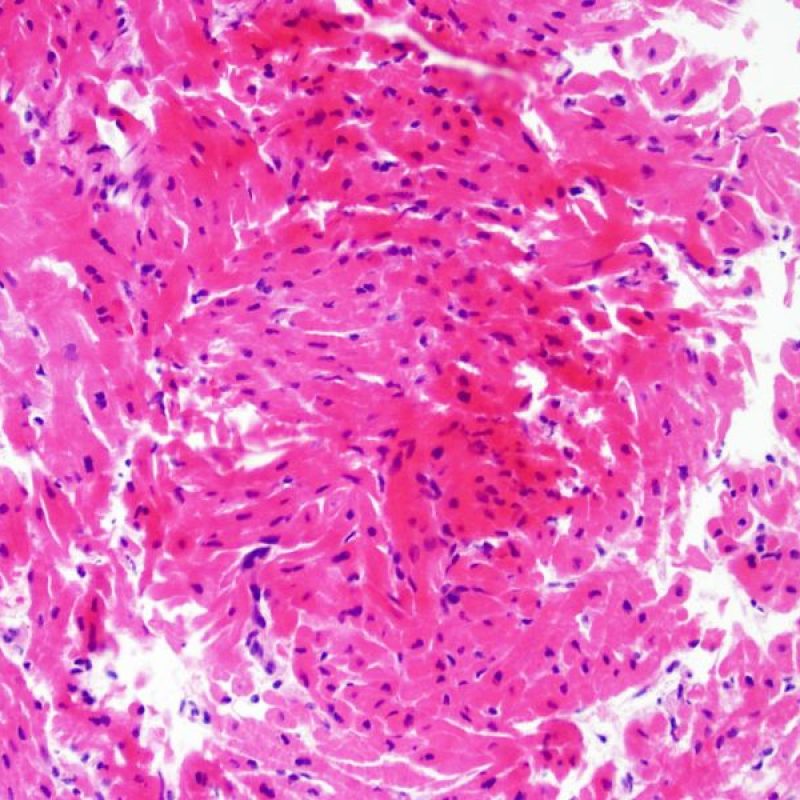
Rechazo grave (3R)
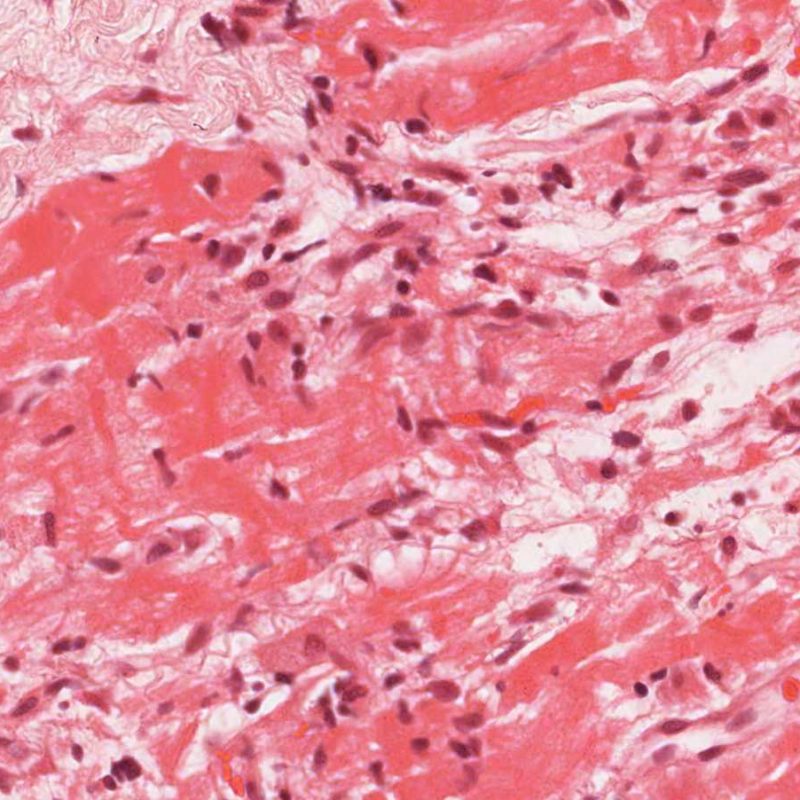
El rechazo grave (3R) es un proceso de daño miocítico difuso donde es difícil de distinguir individualmente los focos de daño miocárdico. Típicamente hay numerosos eosinófilos y algunos neutrófilos. En general existe un marcado infiltrado inflamatorio que puede asociarse a edema, hemorragia y vasculitis. Con los protocolos de inmunosupresión actuales, el rechazo 3R es poco frecuente pero puede ocurrir cuando los pacientes dejan el tratamiento por su cuenta. Este grado de rechazo a menudo se acompaña de disfunción clínica. Por ello siempre debe comunicarse a los clínicos, ya que es necesario iniciar el tratamiento rápidamente.
Rechazo mediado por anticuerpos
El rechazo mediado por anticuerpos (RMA, también conocido como rechazo humoral) presenta unas características diferentes de las de rechazo celular, excepto en las formas graves, en las que los hallazgos histológicos se pueden superponer. Los cambios histopatológicos de este tipo de rechazo en la microscopía óptica son edema, tumefacción de las células endoteliales y macrófagos ocupando la luz de capilares miocárdicos. Para el diagnóstico de este tipo de rechazo se debe realizar la tinción inmunohistoquímica para el factor de complemento C4d. Un segundo tutorial dedicado específicamente al rechazo mediado por anticuerpos está en preparación.
Diferencias de criterios entre las clasificaciones ISHLT 1990 y 2004
Como ya se ha mencionado, la ISHLT emitió dos sistemas diferentes de clasificación de rechazo celular. La clasificación de ISHLT-2004 ha simplificado los criterios adoptados en la ISHLT-1990. En la práctica, ha eliminando aquellas categorías carentes de importancia pronóstica (grados 1A vs 1B y grados 3B vs 4 de la clasificación ISHLT-1990). La decisión más controvertida fue unir la antigua clasificación grado 2 de la ISHLT-1990 (un brote de daño miocítico) a la nueva categoría leve 1R. De hecho, en muchos centros, el grado 2 ISHLT-1990 recibe un trato diferente del 1R ISHLT-2004, ya sea realizando un seguimiento más cercano del paciente o bien tratándole con un aumento de la terapia inmunosupresora. Por esta razón es importante comunicar a los clínicos el hallazgo de daño miocítico.
Observación a poco aumento
Esta sección del tutorial le guiará a través de las observaciones a poco aumento (de 2x a 10x). Se tratarán temas como la celularidad, el intersticio, los miocitos y la vasculatura.
Adecuación de la biopsia
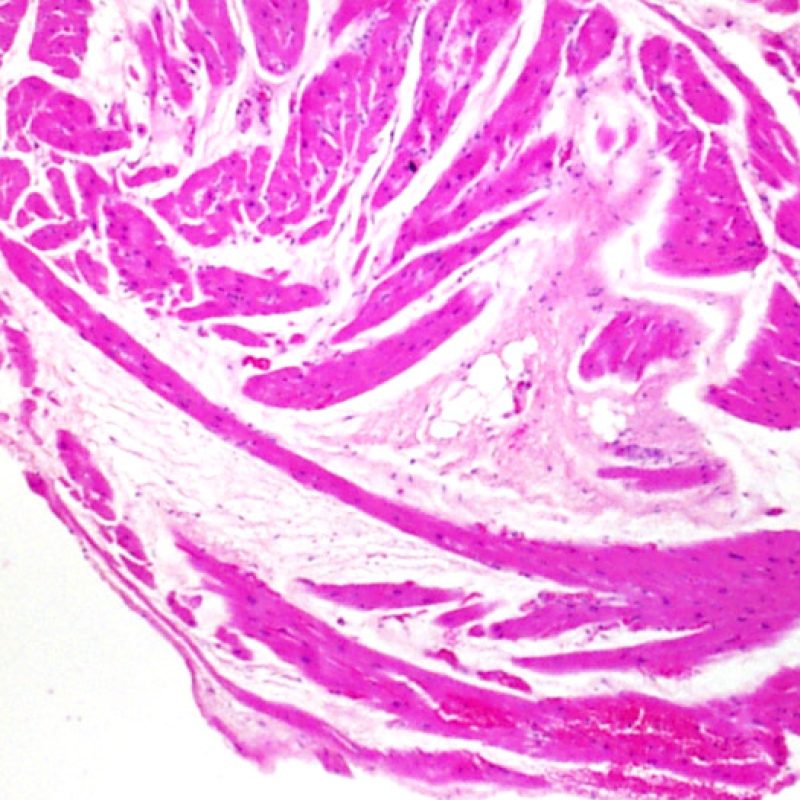
La primera observación a poco aumento es para asegurar que la muestra incluye una cantidad adecuada de miocardio para la evaluación del rechazo celular. Debido a que muchos pacientes con trasplante de corazón son sometidos a múltiples biopsias repetidas, parte o la totalidad de una pieza de biopsia puede consistir en cambios de sitio de biopsia previa. Si se observa material trombótico, tejido de granulación o áreas de fibrosis con miocitos ausentes o distribuidos de una manera desordenada, lo más probable es que ésta sea un una zona de biopsia previa. Consideraremos una biopsia adecuada la que incluya al menos 3 fragmentos de biopsia, cada uno de los cuales contenga miocardio no alterado por lesiones de sitio previo de biopsia en el 50% de la superficie. También debería ser notificada la presencia de otros tejidos no miocárdicos (valvas de válvula, cuerdas tendinosas, tejido adiposo, etc…).
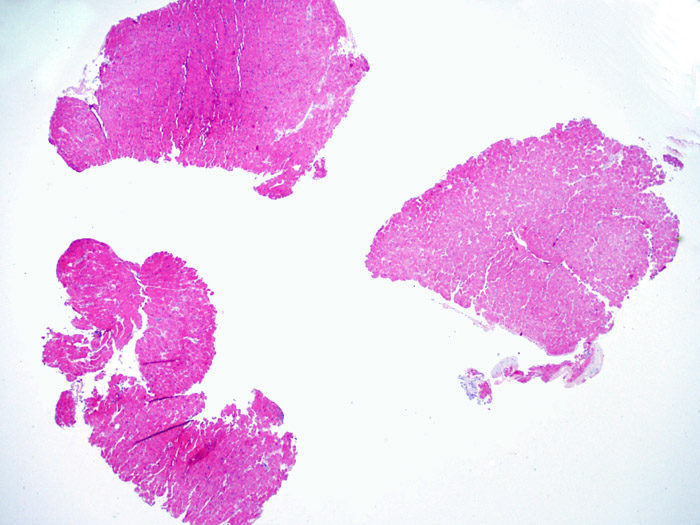
Consideraciones generales de celularidad de la biopsia
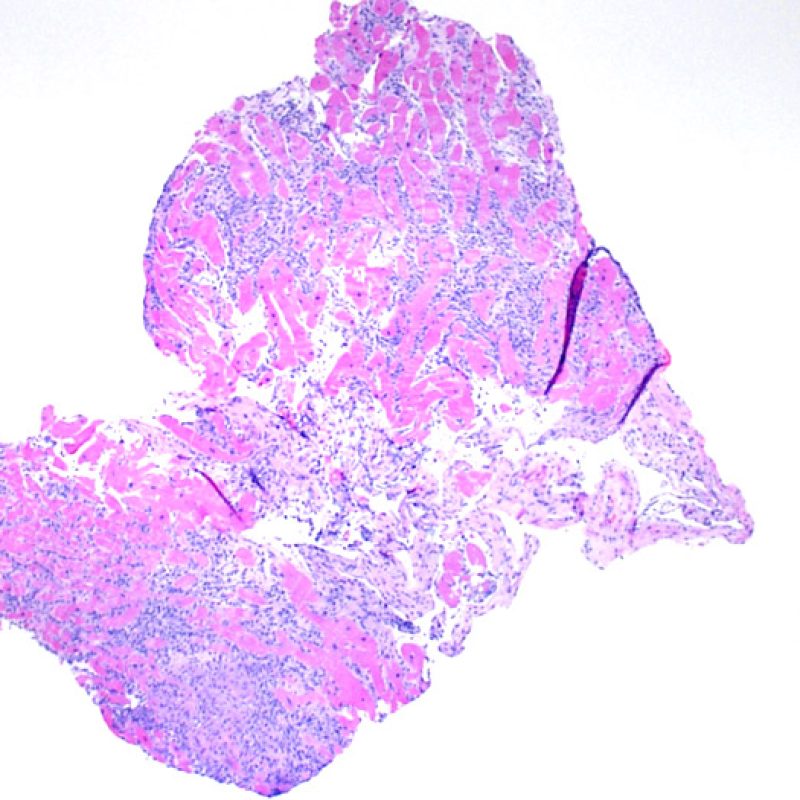
Una vez establecido que la biopsia es adecuada, los demás objetivos a poco aumento son: 1) Detectar incrementos de celularidad en las muestras, 2) Definir el patrón y la distribución de los infiltrados celulares, 3) Hacerse una idea general del grado de inflamación y 4) Identificar las áreas con incremento de celularidad y evaluarlas a mayor aumento. Ya que las alteraciones histológicas de rechazo celular no están distribuidas de manera uniforme, una observación general del conjunto a poco aumento es útil para seleccionar las zonas más afectadas. El examen del tejido a diferentes niveles es crucial para la precisión diagnóstica.
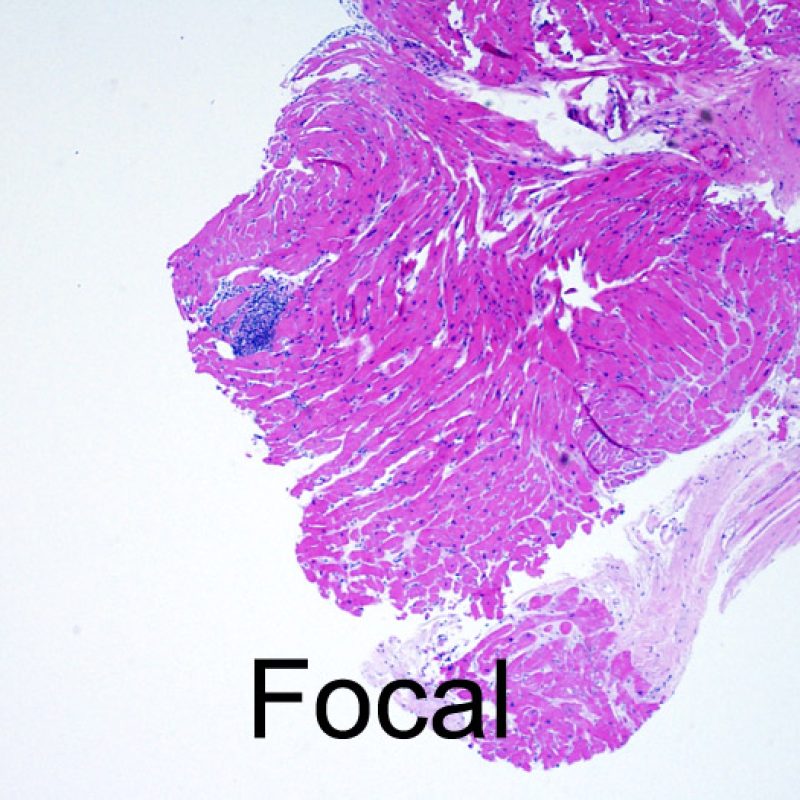
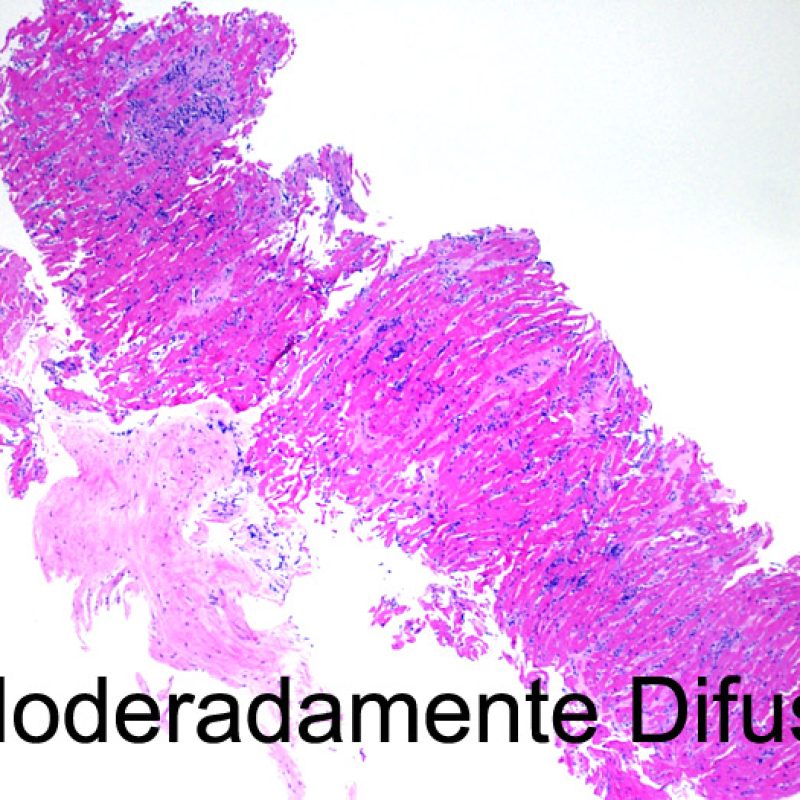
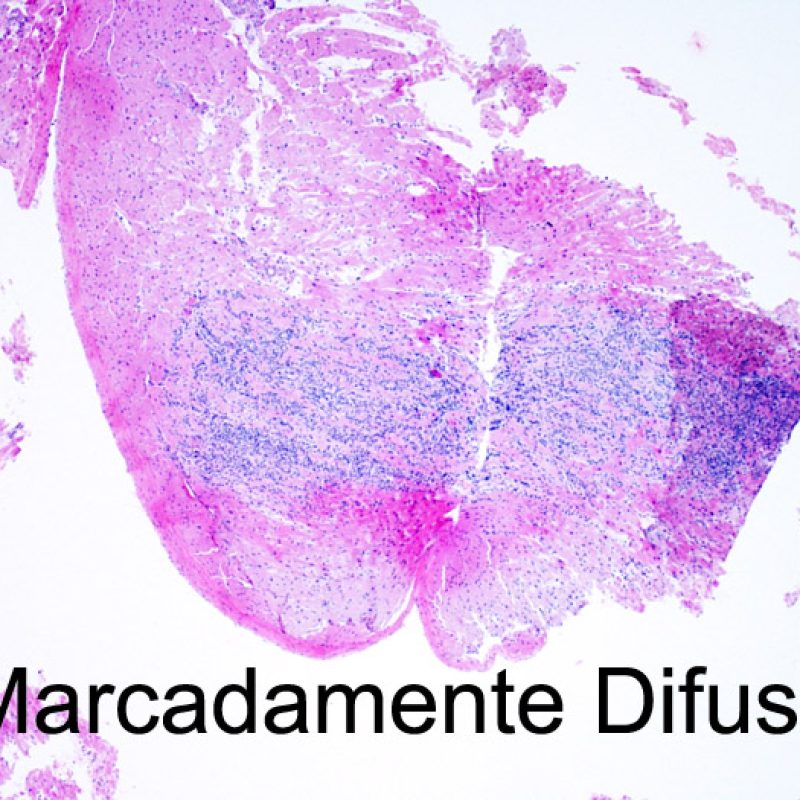
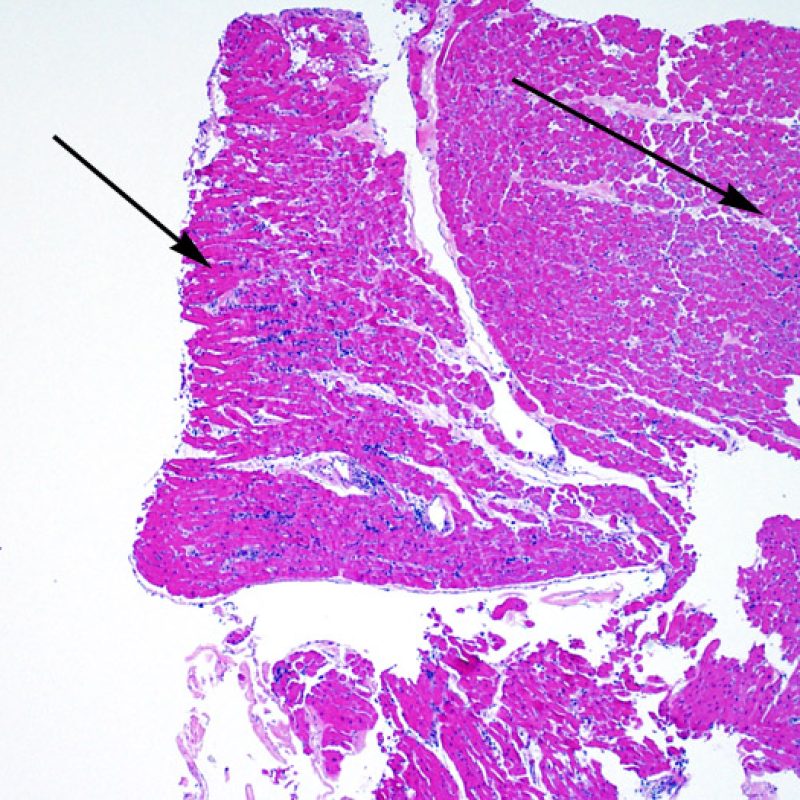
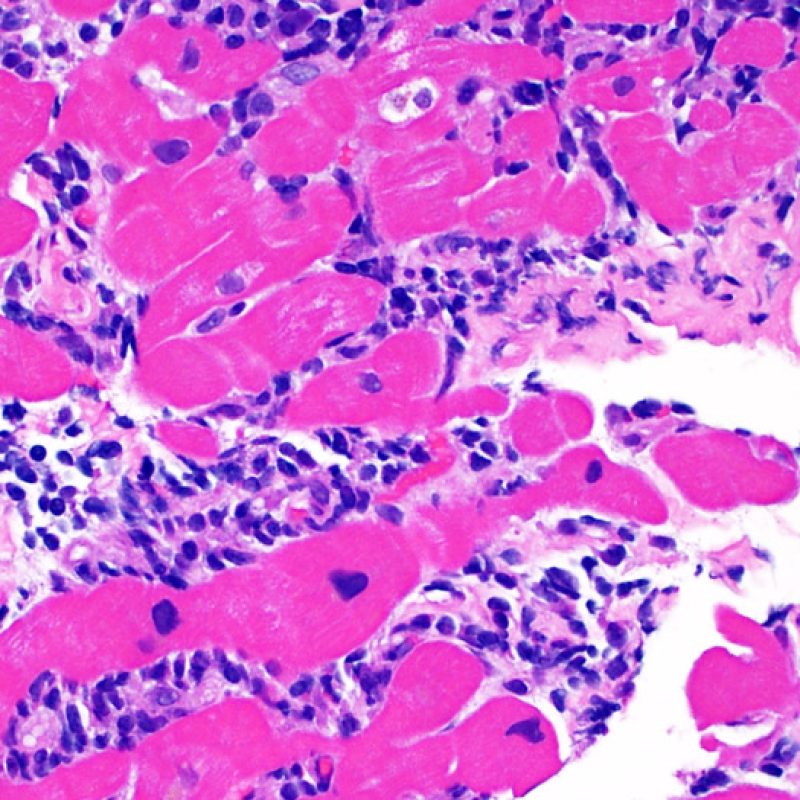
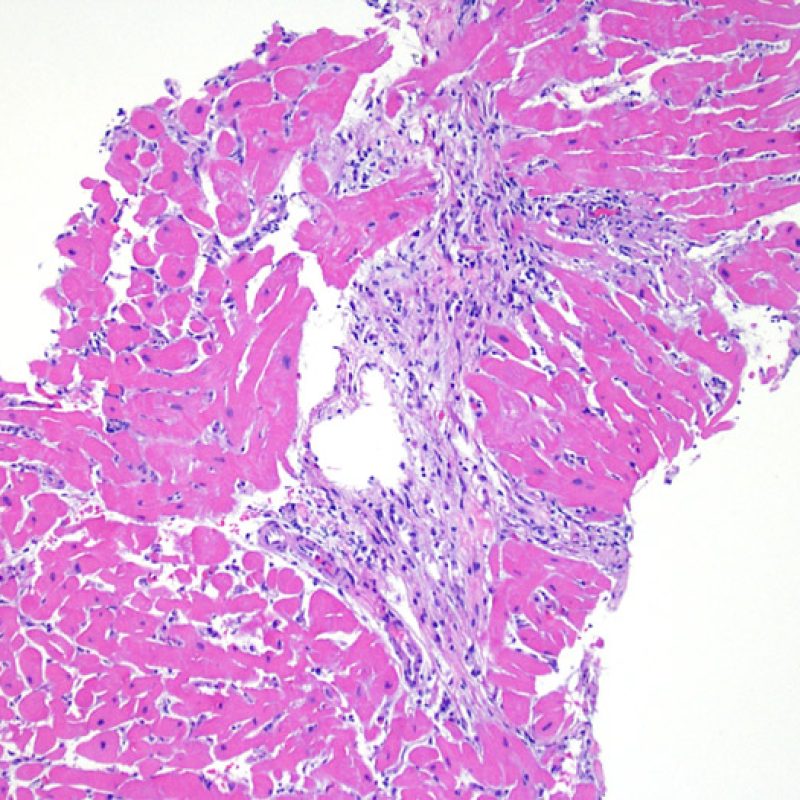
El aumento de celularidad en BEM es, por lo general, fácil de identificar. El patrón de distribución de los infiltrados celulares puede ser focal o difuso. Normalmente es posible evaluar a bajo aumento si la inflamación se distribuye alrededor de pequeños vasos (perivascular) o alrededor de los miocitos (perimiocítica) con el típico patrón de “red metálica de gallinero”. Esta distinción, como muchas otras características morfológicas, es a veces subjetiva.
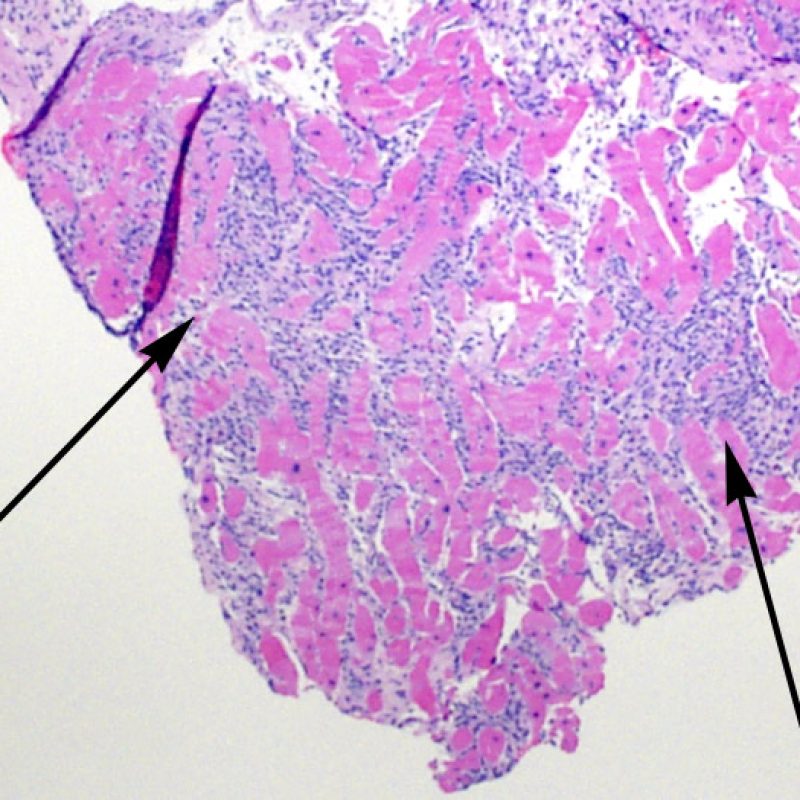
La localización de los infiltrados y su relación con los miocitos suelen indicar el tipo de patología subyacente. En rechazo celular agudo (RCA), el infiltrado linfocitario se distribuye alrededor de los cardiomiocitos (perimiocítico) o pequeñas arteriolas (perivascular). Si la infiltración se localiza principalmente en el subendocardio o en el contexto de tejido fibroso, se debe considerar etiologías alternativas tales como el daño isquémico, infiltrados Quilty o lesiones de sitio previo de biopsia. En ocasiones, los infiltrados linfocitarios se distribuyen de modo lineal a lo largo de la superficie del endocardio o cerca de él. En casos de rechazo en que estos infiltrados aparecen aislados son difíciles de distinguir de un efecto Quilty. No obstante si ocurren en grados más severos de rechazo se asocian a infiltrados perimiocíticos.
Los agregados nodulares prominentes de linfocitos en el endocardio son típicos de los efectos “Quilty”. En cuanto a las lesiones Quilty intramiocárdicas o las que se extienden desde el endocardio hacia el miocardio deben ser evaluadas a poco aumento para una interpretación adecuada, representada por infiltrados linfocitarios densos, con márgenes expansivos y relativamente bien delimitados de los miocitos adyacentes. Todas los infiltrados linfocitarios perimiocíticos deben ser evaluados a mayor aumento para comprobar si hay daño miocítico.
Los miocitos
Identificar el “daño miocítico ” en la BEM es a veces una tarea difícil, porque este concepto abarca un amplio espectro de trastornos, que van desde la muerte celular a cambios degenerativos apenas perceptibles. Para asegurar el diagnóstico preciso, la mayoría de estas alteraciones deben evaluarse cuidadosamente a gran aumento.
A poco aumento, la evidencia de daño miocítico está representado por la invasión del espacio miocítico por células inflamatorios, o bien por una clara sobreposición de los linfocitos sobre los miocitos. Las células inflamatorias causan la pérdida de la regularidad del contorno del miocito y la distorsión de la arquitectura normal del miocardio. En la práctica, la presencia de células inflamatorias dentro de los miocitos son biomarcadores muy útiles que implican una examinación más profunda de la lesión. Debe tenerse cuidado al evaluar la relación entre linfocitos y miocitos en el artefacto de aplastamiento del biotomo.
En ocasiones el daño isquémico (perioperatorio o isquemia tardía secundaria a la vasculopatía de injerto) puede inducir necrosis coagulativa focal de los cardiomiocitos. A poco aumento, focos que incluyen pocos miocitos pueden ser difíciles de distinguir de lesiones de RCA. Los focos más amplios son reconocidos sin dificultad, debido a la apariencia típica de la necrosis coagulativa, caracterizado por miocitos sin núcleo y de grados de reabsorción variable del miocito. Independientemente del tamaño, los focos isquémicos están a menudo rodeados por un pequeño número de macrófagos y linfocitos y raramente por neutrófilos. En algunos casos, estas lesiones tienen forma estrellada y están bien delimitadas del miocardio circundante. La tinción de tricrómico resalta la necrosis de miocitos, dándoles un color púrpura.
La presencia de miocitos vacuolados refleja la miocitolisis secundaria a isquemia crónica. El artefacto de bandas de contracción puede simular miocitolisis, especialmente en los miocitos cortados transversalmente. Cuando en una evaluación cuidadosa a poco aumento, detectamos un patrón miocítico en “tablero de ajedrez”, formado por la alternancia de zonas densas con elementos contraídos, y otras zonas hiperlucentes, de apariencia lítica, debemos sospechar de isquemia crónica.
Intersticio
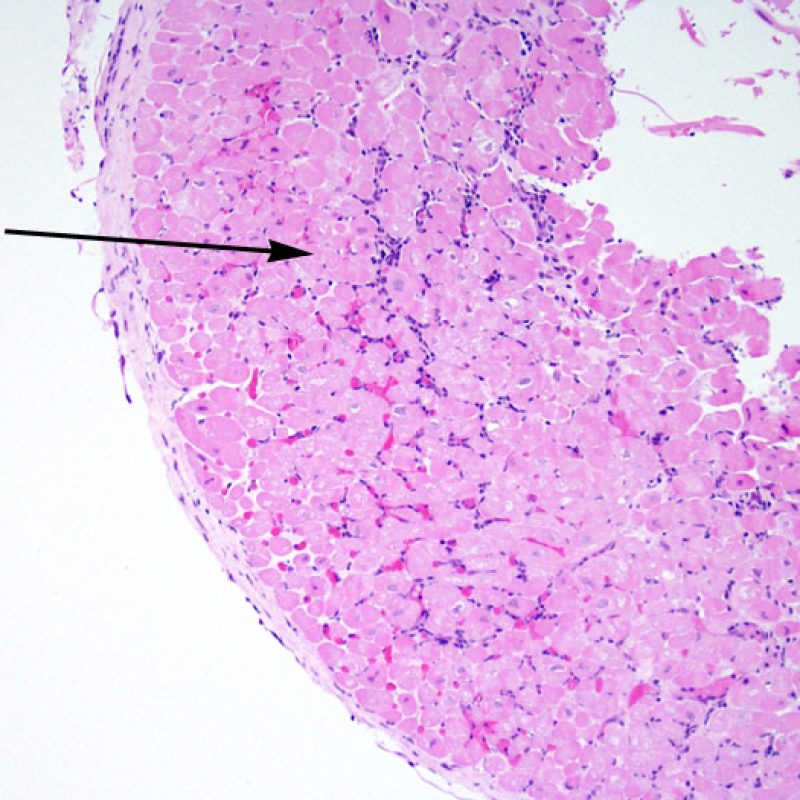
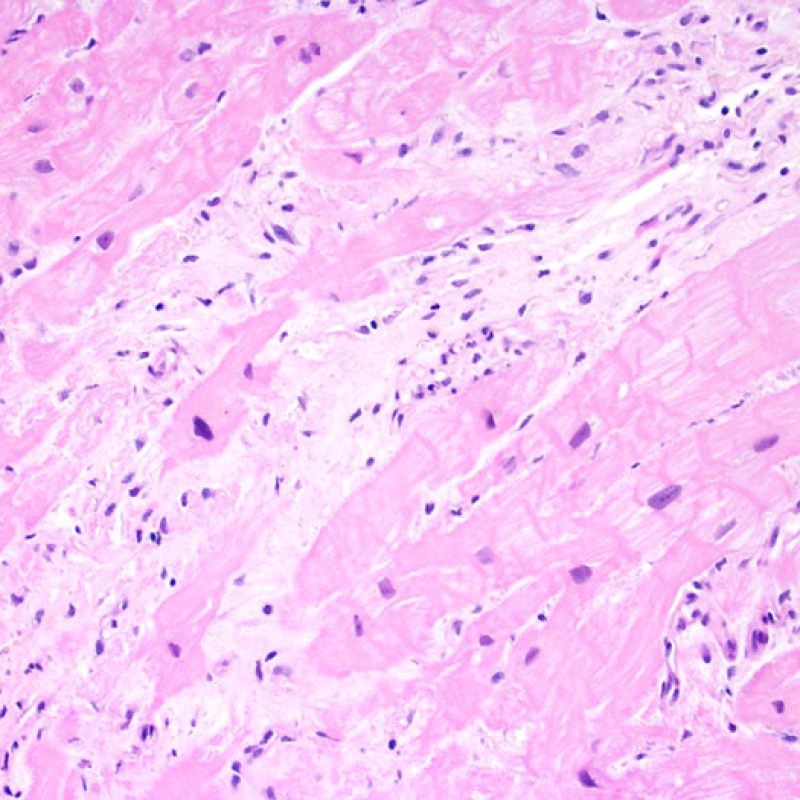
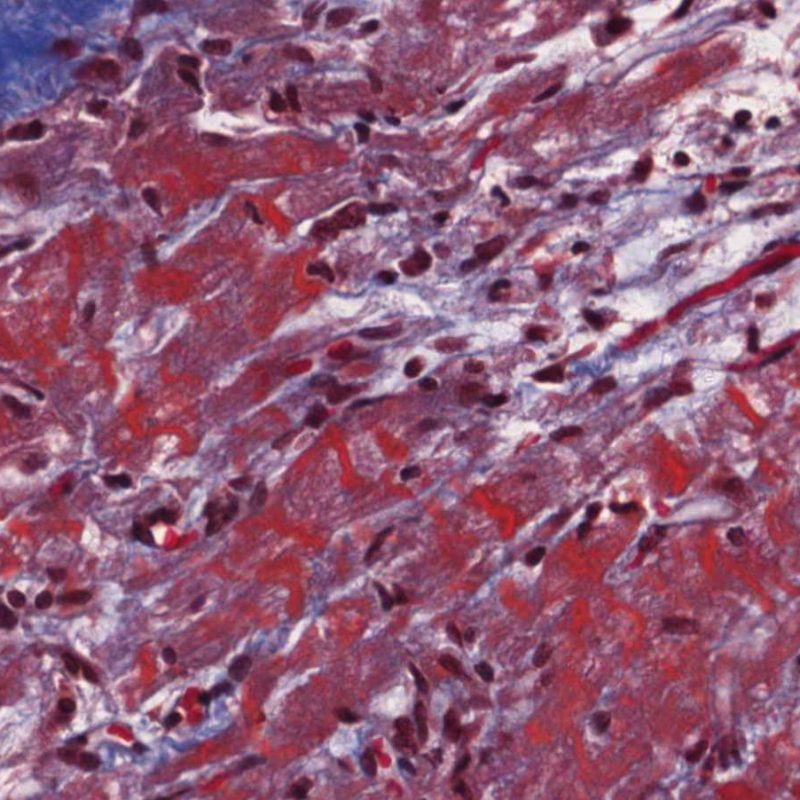
Además del incremento de celularidad, ya discutida, otras alteraciones importantes en el intersticio del miocardio que pueden identificarse a poco aumento son fundamentalmente el edema y la fibrosis. El edema por lo general está presente en casos de RCA grave (grado 3R), insuficiencia cardiaca y/o daño vascular debido a rechazo mediado por anticuerpos. En casos de edema, el intersticio adquiere un aspecto basófilo pálido, evidente en los espacios perivasculares y/o perimiocíticos. En estos casos, es conveniente evaluar la microcirculación a gran aumento para descartar alteraciones de rechazo mediado por anticuerpos. El edema no debe ser confundido con alteraciones artefactuales causadas por el procedimiento de la biopsia o en el procesamiento. Estos artefactos están constituidos por espacios ópticamente vacíos, pequeños o grandes, entre los miocitos, pero desprovistos de la matriz extracelular presente en el edema.
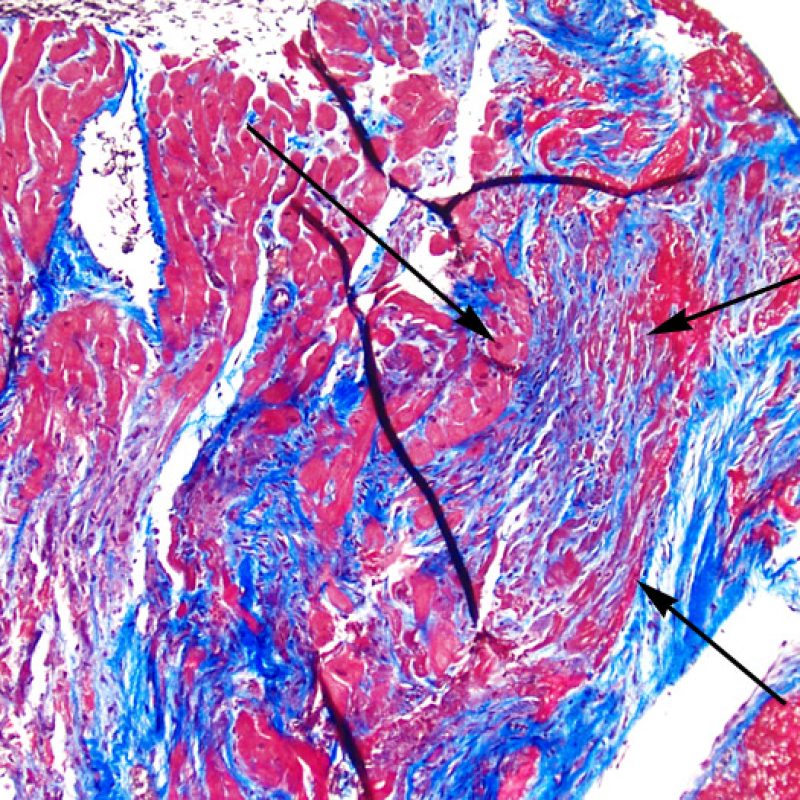
El aumento en el tejido fibroso intersticial es a menudo en forma de extensas áreas de fibrosis que reemplazan la pérdida de miocitos. Estas lesiones suelen estar relacionadas con biopsias previas realizadas directamente en estas zonas o adyacentes a ellas (sitios de biopsia previa). Las características histológicas de los sitios de la biopsia previa son tratadas en otro lugar del tutorial. Puede ser problemático distinguir los sitios de biopsia previa de cicatrices debido a la isquemia miocárdica crónica. Cicatrices de forma estrellada a bajo aumento obligan a un estudio a mayor aumento para evaluar otros aspectos de isquemia crónica. Sea como fuera, la fibrosis intersticial no es una característica de RCA.
Presencia de vasculatura
La evidencia de la vasculopatía del injerto cardiaco raramente se observa en la BEM y se puede confundir fácilmente con el efecto telescópico de naturaleza artefactual de los vasos sanguíneos. La presencia de vasos de gran tamaño, sobre todo si van acompañados por el tejido adiposo o nervioso, obliga a una evaluación a mayor aumento para descartar la presencia de una posible perforación. Los cambios patológicos vasculares son evaluados con mayor precisión a gran aumento.
Observaciones a gran aumento
Tras examinar la muestra a poco aumento (objetivos de 4x o 10x), el patólogo suele ir a mayor aumento para evaluar las áreas que contienen un infiltrado inflamatorio. Generalmente se utiliza un objetivo de 20x. A este aumento, el elemento principal a investigar es la lesión miocítica en áreas de infiltrados linfocitarios. No es particularmente necesario revisar a mayor aumento las zonas en las que no se han observado alteraciones de los miocitos a poco aumento. En esta parte del tutorial se explica la observación a gran aumento, dirigiéndose específicamente a los siguientes temas: el daño miocítico, identificación celular del infiltrado y los hallazgos intersticiales.
Confirmación de lesión miocítica
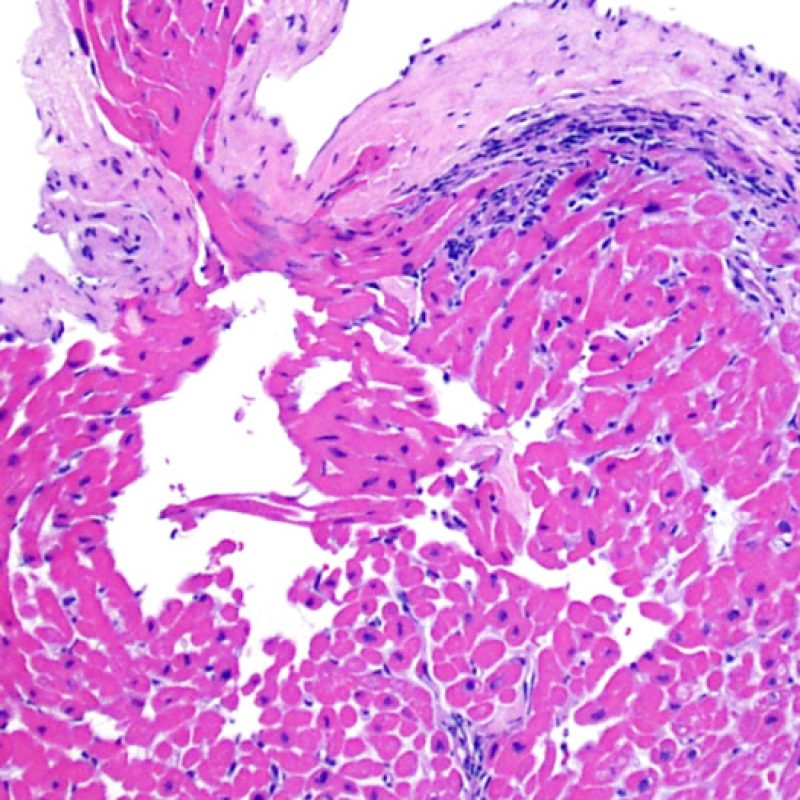
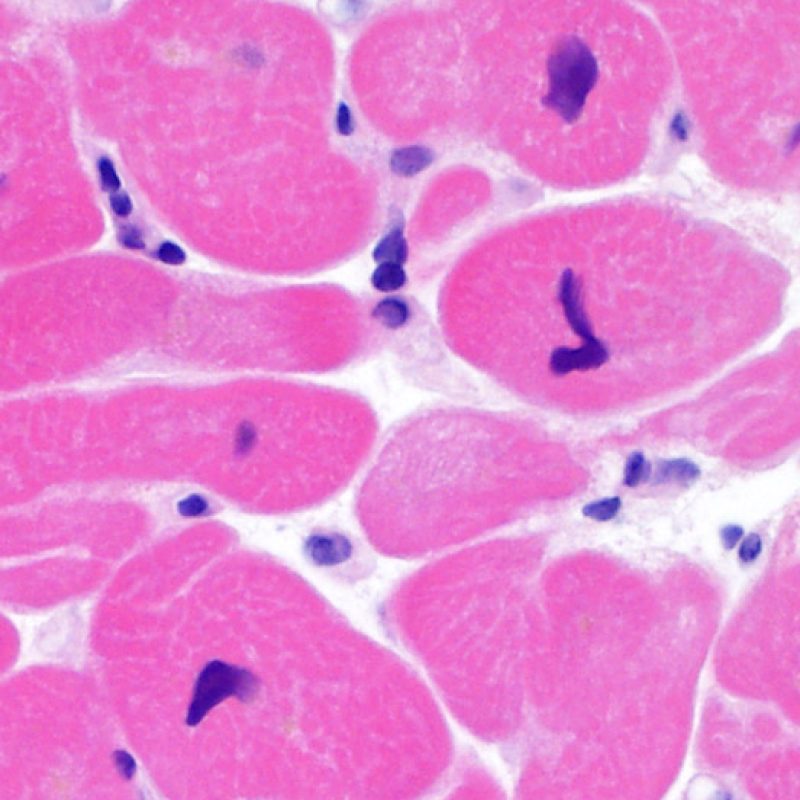
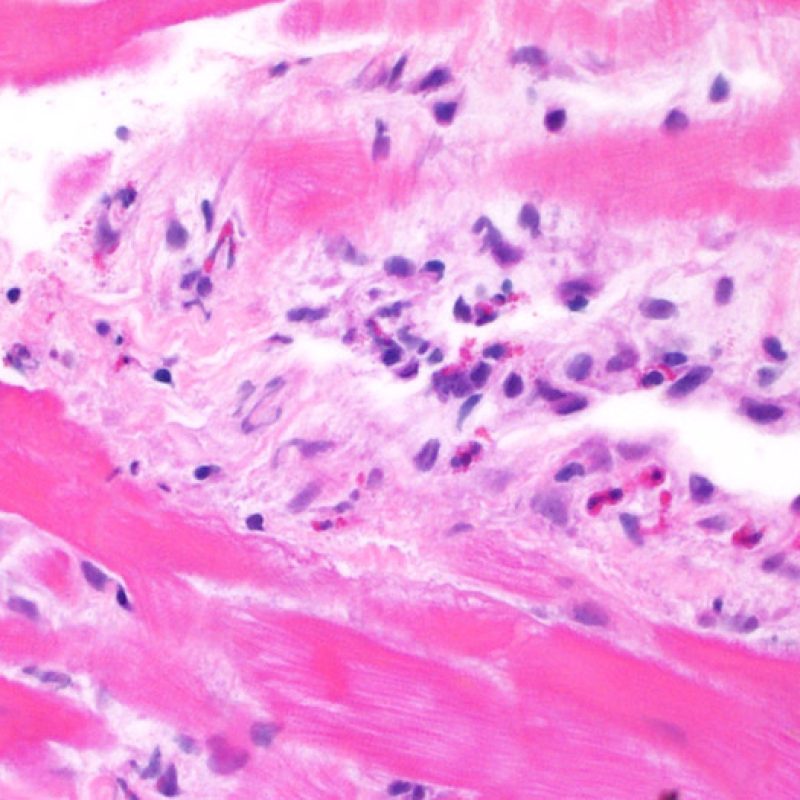
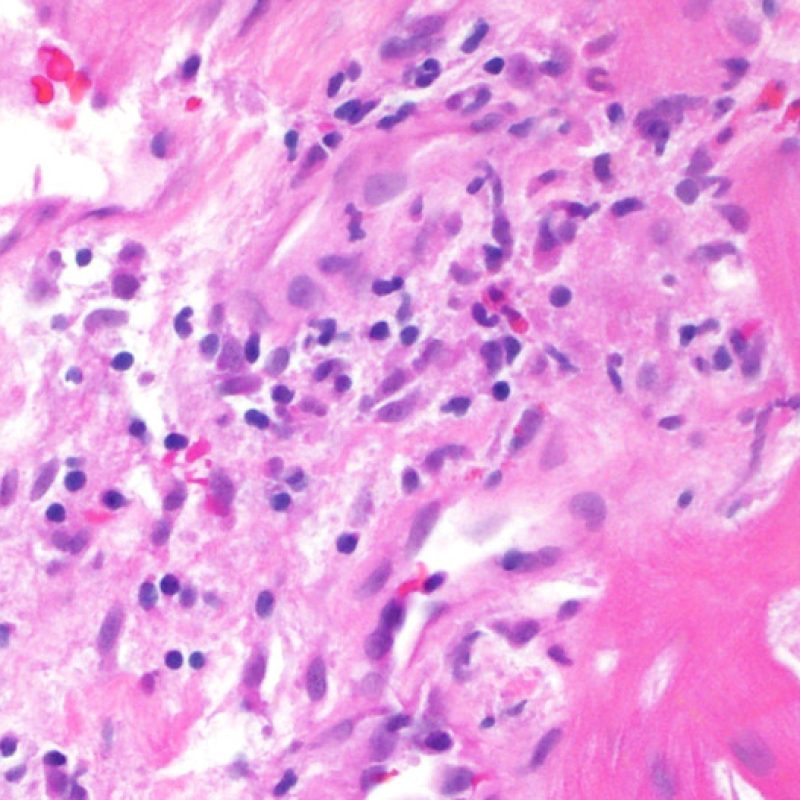
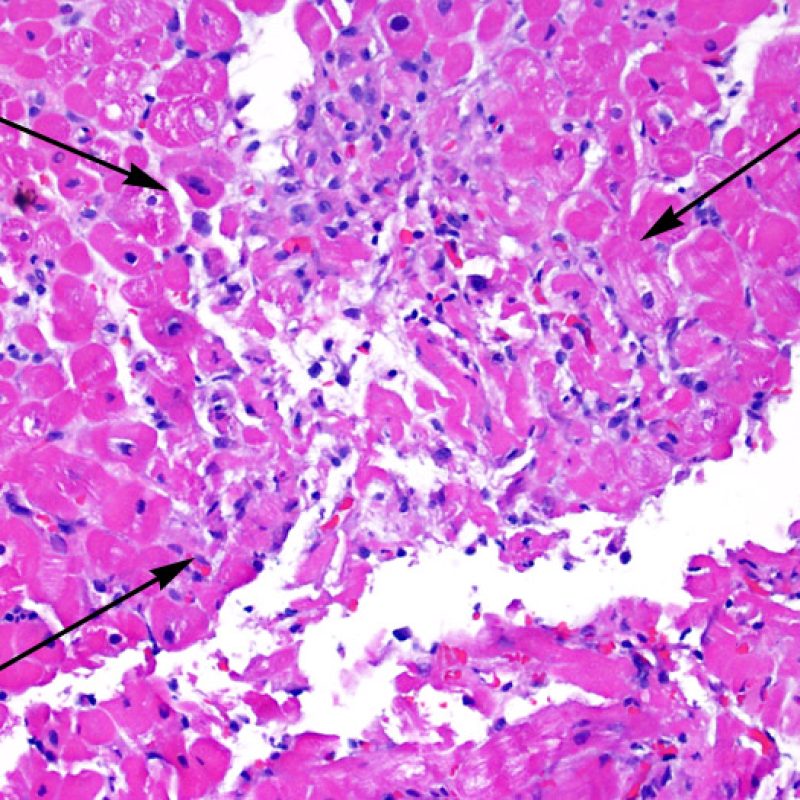
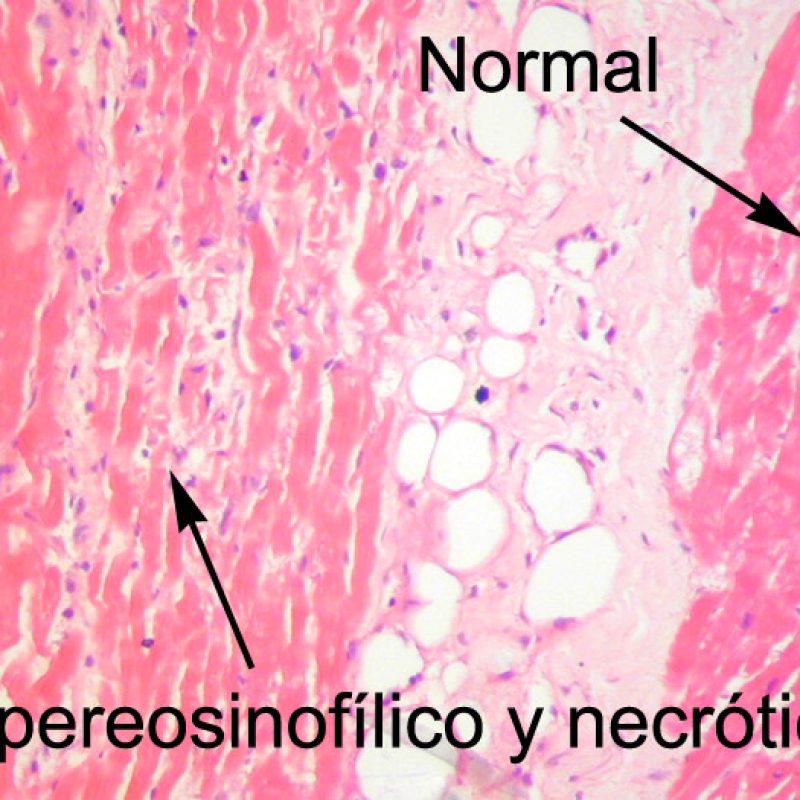
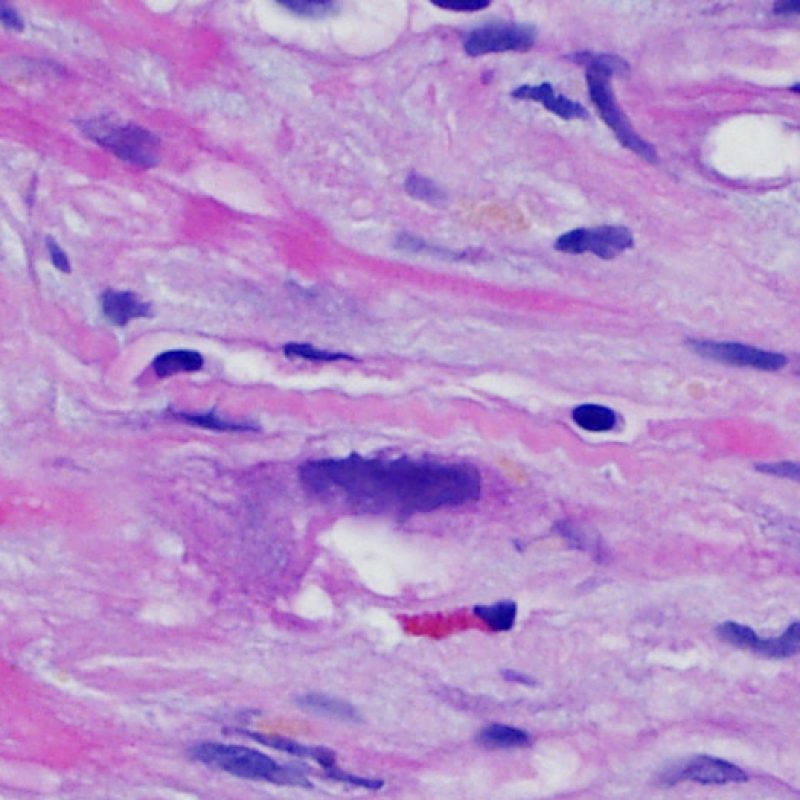
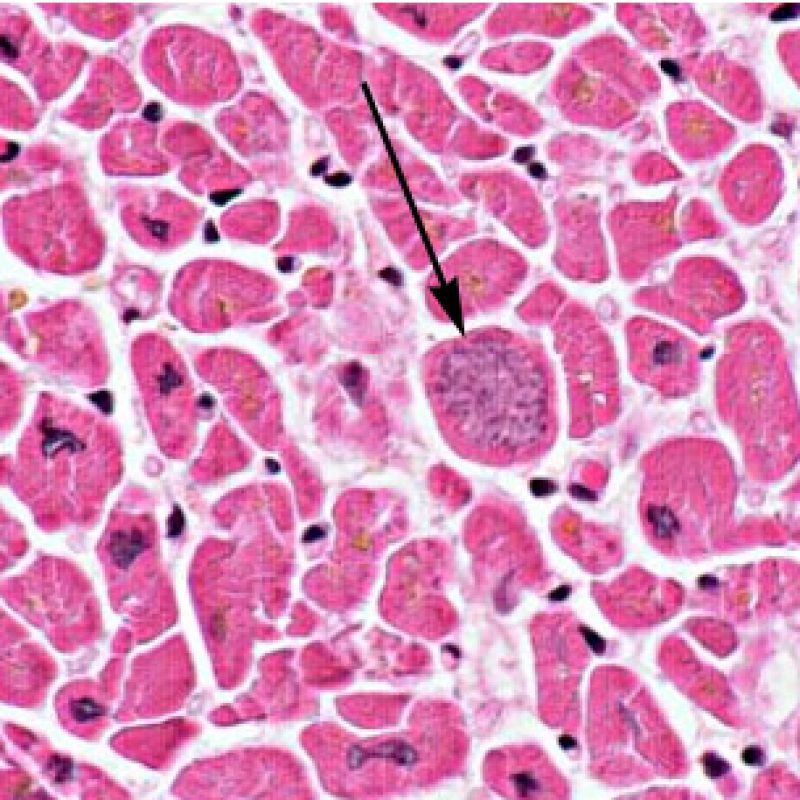
Después de identificar la presencia de un infiltrado linfocitario, el siguiente paso es buscar lesiones miocítico. No es fácil de reconocer las lesiones de los miocitos (i.e. daño / necrosis) asociadas al rechazo agudo, o distinguirlas de otras alteraciones, tales como por ejemplo las debidas a la mala fijación. El daño miocítico es discreto y se aprecia mejor observando la misma área en secciones de diferentes niveles. Algunas de las características histológicas del daño miocítico consisten en: vacuolización, halo perinuclear, núcleos de miocitos sin citoplasma circundante, invasión del espacio miocítico por parte de los linfocitos ocasionando unos límites citoplasmáticos miocíticos irregulares y desaparición de algunos miocitos reemplazados por una inflamación severa y matriz extracelular. Otros buenos indicadores de daño miocítico son la hipereosinofilia y la picnosis nuclear. En la Formulacion de trabajo revisada (Revisited Working formulation) se aceptaron como criterios de daño miocítico la miocitolisis y necrosis de coagulación del miocito.
Otro elemento indicativo de daño miocítico es la modificación de la estructura del sarcómero. Si el patrón miofibrilar es normal, el miocito no está dañado. Pero si el patrón miofibrilar ha desaparecido y el citoplasma aparece hipereosinófilo y denso, existe una alta probabilidad de que el miocito esté lesionado. El tricrómico de Masson puede ser útil para poner de relieve los daños del miocito. Las miocélulas dañadas aparecen encogidas y de color gris azulado, perdiendo la habitual eosinofilia observada en miocitos normales.
Todos estos cambios deben acompañarse de la presencia de linfocitos adyacentes. Si los linfocitos no están presentes, la lesión miocítica no es causada por el rechazo celular y por lo tanto sería el resultado de otro proceso, como por ejemplo debido a la lesión por isquemia que se puede ver en las primeras semanas después del trasplante.
Para confirmar la presencia de daño miocítico, es una buena idea examinar la lesión potencial en distintos niveles del fragmento de biopsia, ya que el examen de un solo corte histológico puede dar lugar a interpretaciones erróneas.
Identificación de células intersticiales
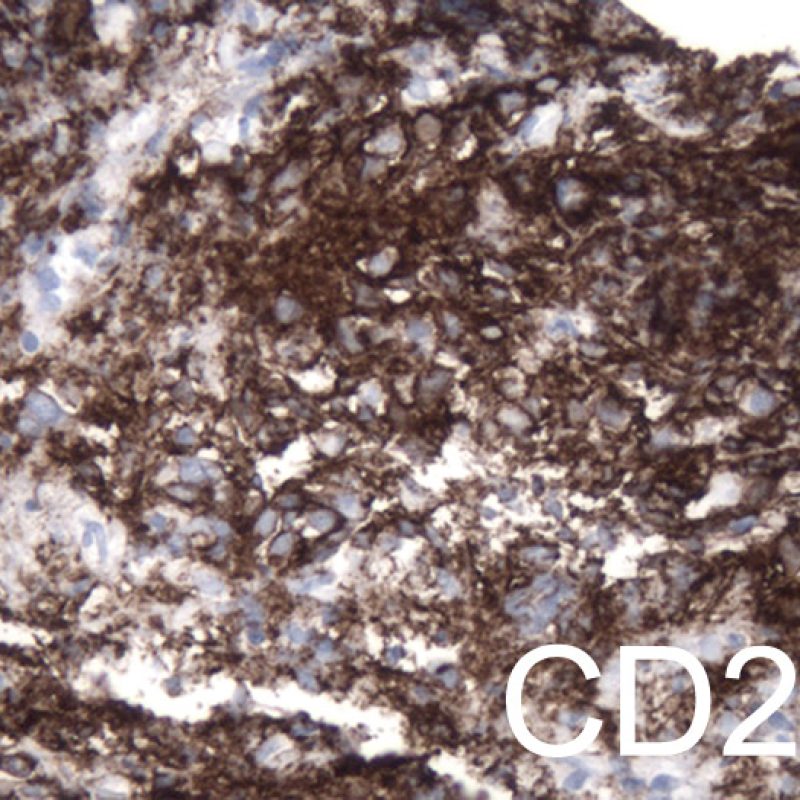
Además de los miocitos, pueden verse muchas otras células en la biopsia endomiocárdica. Las más importantes son las del infiltrado en el rechazo celular, compuesto principalmente por linfocitos T (CD4 + o CD8 +), un menor número de macrófagos y ocasionales eosinófilos. En el rechazo moderado o grave aumentan significativamente las células B activadas y células asesinas naturales.
No todos los núcleos que se pueden ver en el intersticio representan linfocitos, y por ello la observación a mayor aumento puede ser necesaria para identificar la naturaleza exacta del “infiltrado” para excluir el rechazo celular. Otros componentes celulares del intersticio miocárdico incluyen fibroblastos y miofibroblastos, células mesenquimáticas primitivas, células dendríticas, mastocitos, células endoteliales y pericitos. Linfocitos aislados y ocasionales macrófagos puede verse en el miocardio normal. En general, los linfocitos son las únicas células que se agrupan en el miocardio.
Naturaleza del infiltrado inflamatorio
El tipo de células inflamatorias observadas en las biopsias endomiocárdicas de pacientes trasplantados es importante para distinguir si un infiltrado es expresión de rechazo o por el contrario representa otros procesos. Así mismo también ayuda a determinar el grado de rechazo. El rechazo celular agudo siempre se caracteriza por la presencia de linfocitos (células T). Los linfocitos activados, más prominentes en los grados más graves de rechazo, poseen un citoplasma más amplio.
En un contexto apropiado, la presencia de un infiltrado inflamatorio mixto con neutrófilos y eosinófilos, puede ser indicativo de un grado de rechazo severo (3R). Los neutrófilos también pueden observarse en las biopsias con necrosis isquémica, la cual puede persistir durante varias semanas después del trasplante.
Los eosinófilos aparecen en grados moderado (2R) y grave (3R) de rechazo, en asociación con necrosis de miocitos. Por lo general son escasos y distribuidos de manera dispersa. Ya que estas células no se encuentran casi nunca en el rechazo leve (1R), su presencia debe hacer sospechar de que en realidad pueda tratarse de un rechazo moderado o grave (2R y 3R).
Los eosinófilos también pueden verse en las miocarditis por hipersensibilidad, frecuentemente relacionadas a agentes farmacológicos. En este escenario, dichas células típicamente constituyen una proporción sustancial del infiltrado mixto y a menudo forman grupos. Este infiltrado inflamatorio también incluye linfocitos, células plasmáticas y macrófagos. Si bien la miocitolisis focal puede verse en la miocarditis por hipersensibilidad, la necrosis miocítica no es una característica importante de este proceso. Los eosinófilos en BEM también pueden verse en infecciones parasitarias del miocardio.
Análisis del intersticio
El intersticio se debe examinar a gran aumento para detectar la presencia de restos celulares y edema. La presencia de restos celulares y demás material amorfo (“sucio”) basofílico o eosinofílico en el contexto de una infiltración marcada es consistente con daño miocítico y apoptosis celular. En etapas iniciales después del trasplante, estos cambios suelen estar asociados a lesión isquémica peri-trasplante. Sin embargo en biopsias más tardías biopsias, constituyen un hallazgo histológico útil de rechazo.
El edema intersticial en una BEM de trasplante puede ser un signo de rechazo mediado por anticuerpos. Sin embargo, la separación entre miocitos puede ser debida a la manipulación de las biopsias durante el procesamiento del tejido, y por lo tanto pueden simular el edema. En el edema auténtico, los miocitos están separados por una tenue matriz eosinofílica. Por otra parte, en el rechazo mediado por anticuerpos, deben estar presentes también otros cambios, como la prominencia de las células endoteliales de los capilares, macrófagos intersticiales y/o hemorragia.
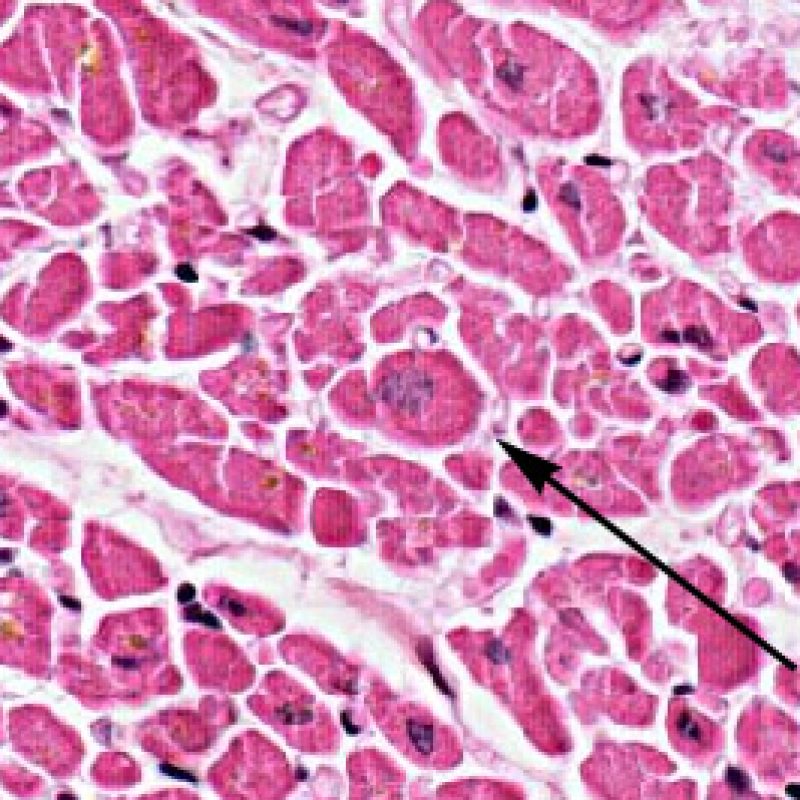
Miocitólisis (por enfermedad coronaria del injerto)
La vacuolización subendocárdica de miocitos (miocitolisis), focal o difusa, pueden ser indicativo de una lesión isquémica reversible. La miocitolisis es un espacio claro (carente de tinción) del sarcoplasma, acompañado de aumento nuclear y de nucléolo prominente. Si esta lesión está presente en una biopsia endomiocárdica realizada al cabo de un año o más del trasplante, podría estar indicando una estenosis acelerada de las arterias coronarias, la cual se produce en los corazones trasplantados.
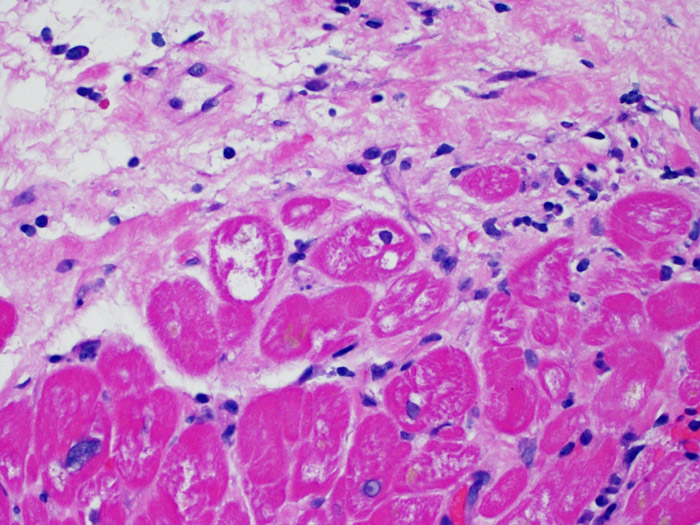
Cambios en las células endoteliales (en RMA)
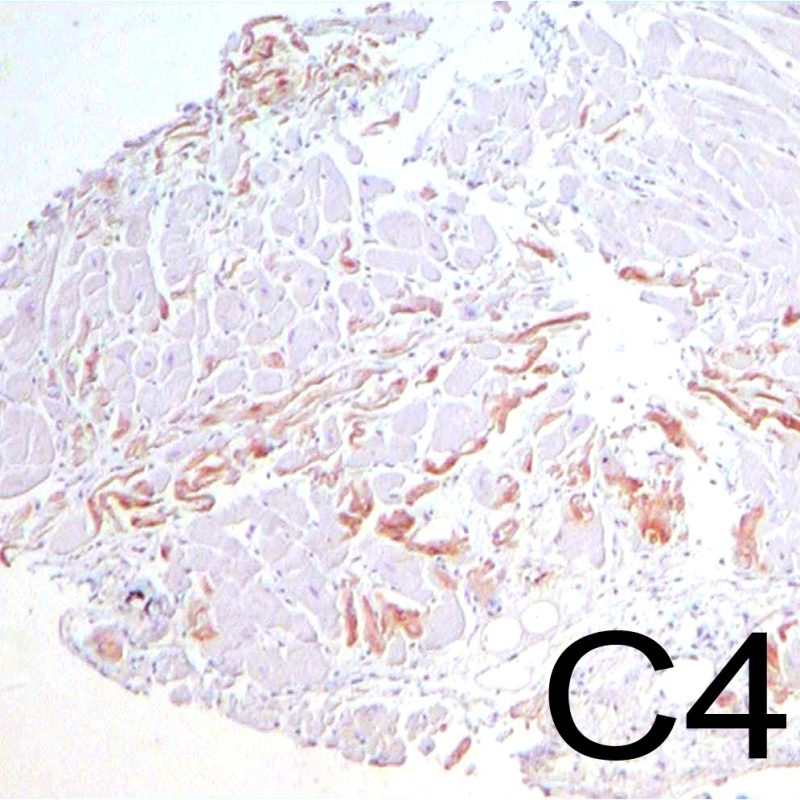
Los criterios para el diagnóstico de rechazo agudo mediado por anticuerpos es expuesto en otra sección del tutorial. Observando a poco aumento las secciones teñidas con hematoxilina-eosina, uno de los hallazgos que pueden inducir a la sospecha de RMA, es la prominencia de los capilares y vénulas. A mayor aumento, en el RMA, las células endoteliales aparecen prominentes (“hinchadas”), con núcleos agrandados e hipercromáticos. Estos hallazgos sugieren RMA y requieren investigación adicional para evaluar la presencia de inmunoglobulinas y complemento.
Rechazo
Esta sección del tutorial abarca los hallazgos primordiales utilizados para hacer el diagnóstico de rechazo celular agudo. También cuenta con unas breves palabras sobre el rechazo mediado por anticuerpos, que se tratará en más detalle en un próximo tutorial. Se consolidarán los conceptos clave que ya se han tratado en los apartados de poco aumento y gran aumento.
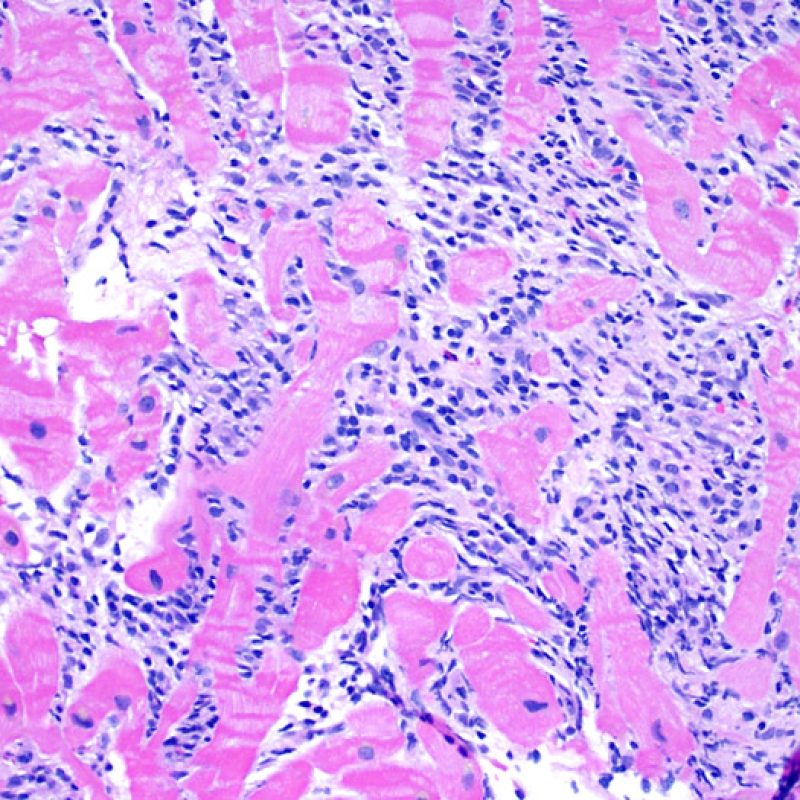
Infiltrado linfocitario
Un infiltrado linfocitario es el hallazgo histológico clave que indica que el procesos que estamos observando es rechazo celular agudo. A poco aumento, se presenta como una zona con aumento de celularidad. A gran aumento debe evaluarse la capacidad de los linfocitos de lesionar al miocito. Los linfocitos activados asociados con el daño miocítico generalmente tienen el núcleo agrandado y el citoplasma ampliado en comparación con linfocitos quiescentes.
Daño Miocítico
El daño miocítico la característica histológica clave para discriminar entre bajo y alto grado de rechazo. Se consideran alto grado de rechazo a los grados 2R y 3R. El daño miocítico se aprecia mejor a gran aumento, donde podemos identificar las diversas características de dicho daño. Éstas incluyen hipereosinofilia, picnosis nuclear, miocitolisis, necrosis por coagulación, vacuolización citoplasmática perinuclear de los miocitos y la ocupación linfocitaria del espacio citoplasmático miocítico periférico. A veces, la lesión miocítica puede manifestarse como una zona de marcada inflamación linfocítica que ha causado la destrucción de los miocitos (espacio vacío donde deberían estar los miocitos) o la fragmentación miocítica por el proceso destructivo.
Rechazo mediado por anticuerpos
El rechazo mediado por anticuerpos (RMA, también denominado rechazo humoral) tiene características diferentes a las del rechazo celular agudo, excepto en los casos graves, en los que los hallazgos histológicos se pueden solapar. Los cambios histopatológicos de rechazo mediado por anticuerpos, observados al microscopio óptico, son la inflación de las células endoteliales, la presencia de agregados de células mononucleares que llenan la luz de los vasos pequeños y edema. Para la identificación de este tipo de rechazo debe realizase la inmunotinción para el producto de escisión C4d del sistema complemento. Próximamente se lanzará un segundo tutorial acerca sólo del RMA.
Hallazgos no relacionados con el rechazo (hallazgos de no-rechazo)
Esta sección del tutorial se ocupa de tratar diversas alteraciones no relacionadas con el rechazo, que pueden ser detectadas en las muestras de biopsia. Algunos hallazgos son frecuentes, otros son extremadamente raros. Debido a que muchos de ellos son fáciles de confundir con los de rechazo, es fundamental saber cómo identificarlos y distinguirlos del rechazo y así evitar sobrediagnosticar este último.
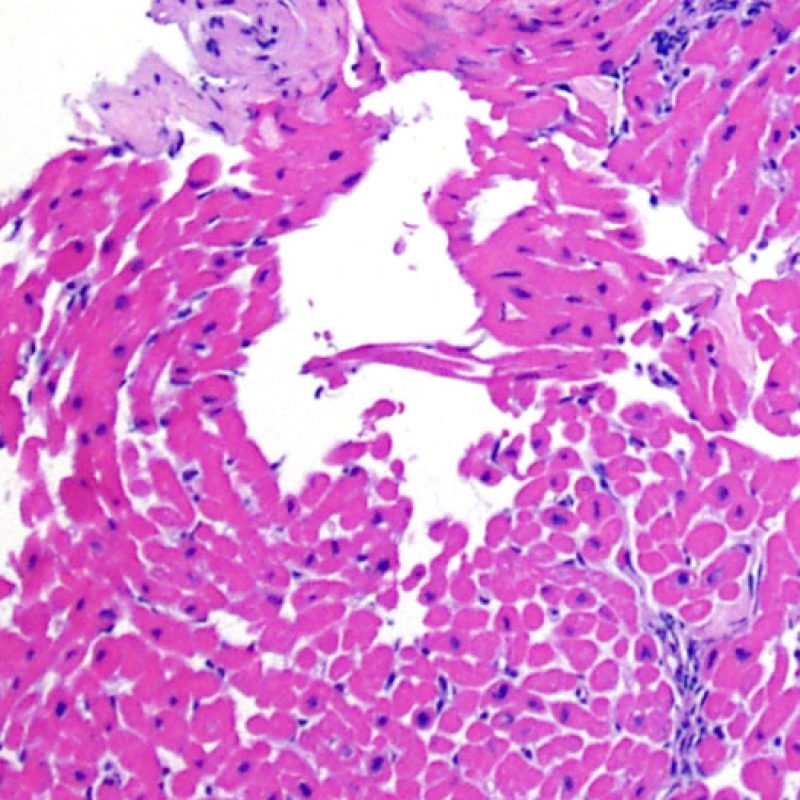
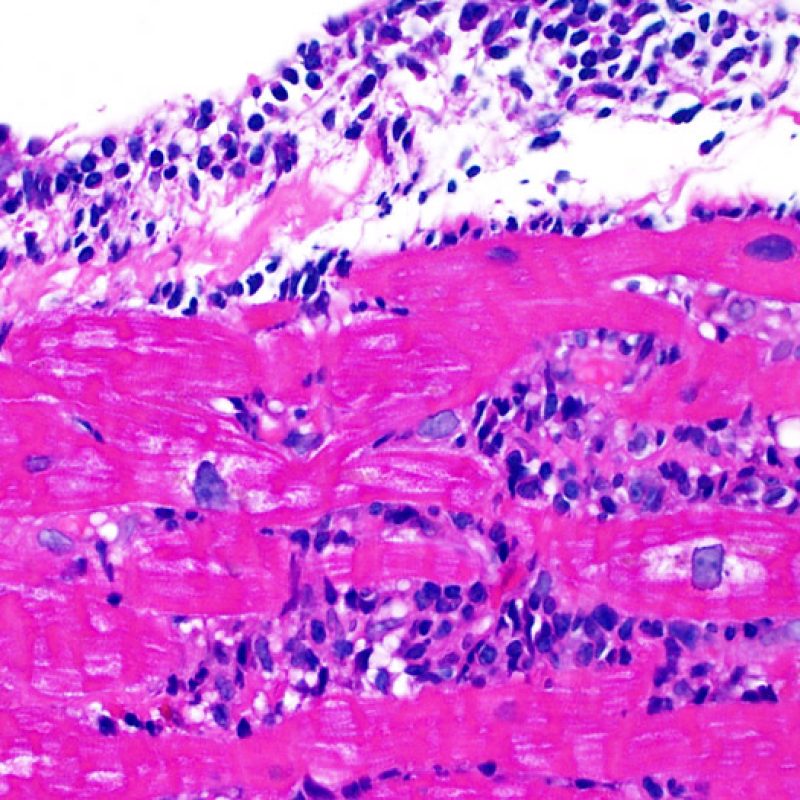
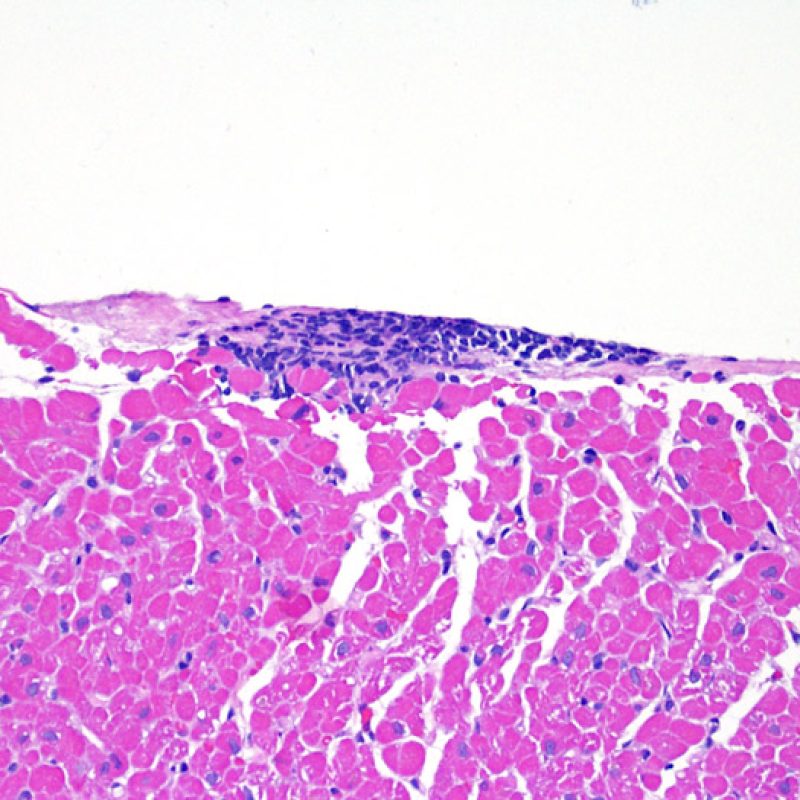
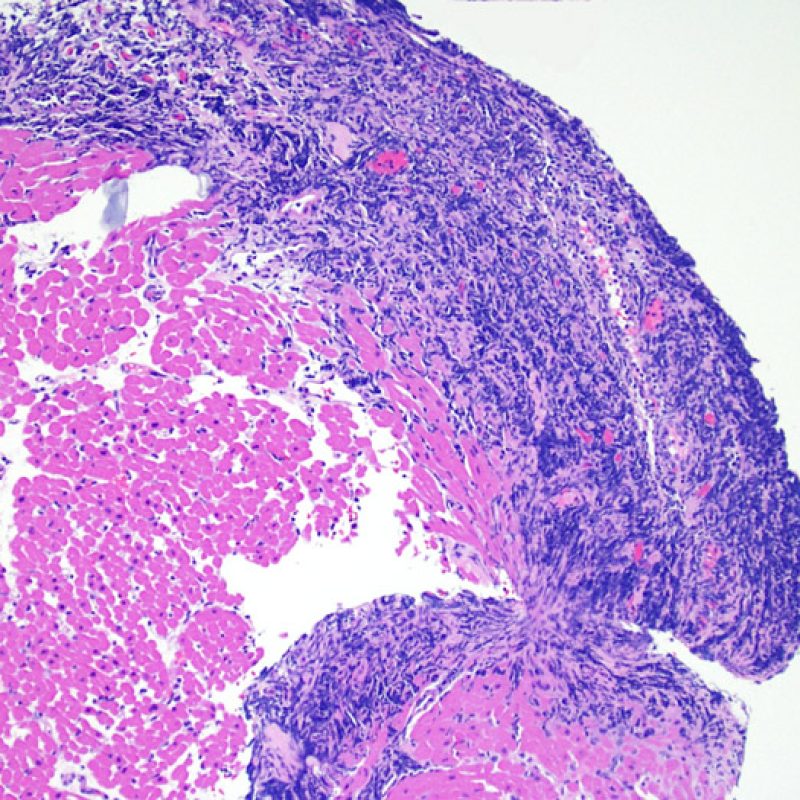
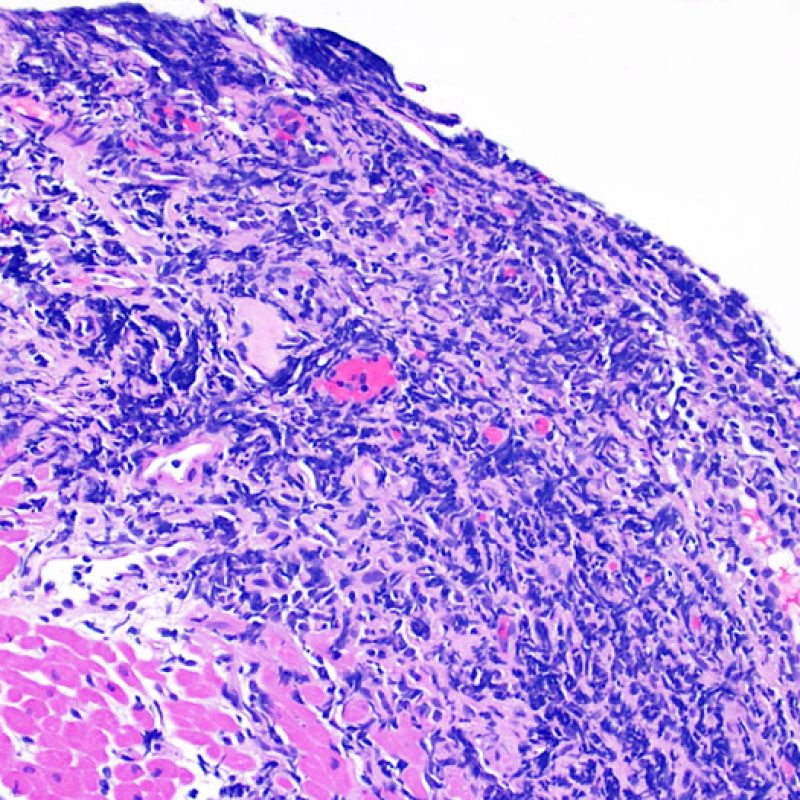
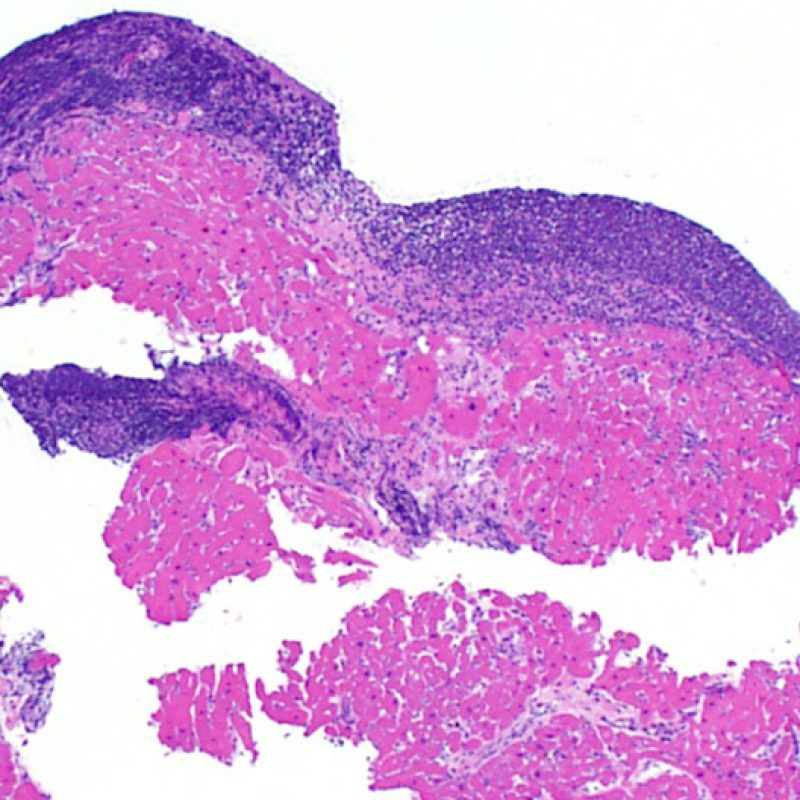
Efecto Quilty
Aproximadamente el 50% de las biopsias endomiocárdicas de los pacientes trasplantados puede presentar colecciones endocardiales densas y compactas de linfocitos que a veces se extienden al miocardio adyacente. Estos hallazgos tan comunes se denominan “efecto Quilty” (denominada Quilty por el nombre de la primera paciente en el que se describió). Estas lesiones están constituidas por una mezcla de linfocitos T y B, así como ocasionales células dendríticas. Algunos de estos infiltrados pueden contener vasos de pequeño calibre.
La patogénesis del efecto Quilty es desconocida, pero algunas hipótesis incluyen protocolos inmunosupresores basados en la ciclosporina, respuestas idiosincrásicas a la ciclosporina A e infección concomitante por el virus de Epstein-Barr. El efecto Quilty no aparece en los corazones de pacientes sometidos a trasplante de otros órganos sólidos (i.e. riñón, hígado) tratados con ciclosporina A. Diversos grupos de investigación han estudiado las posibles relaciones entre el efecto Quilty y otras variables, tales como el grado de rechazo celular, infecciones virales, rechazo mediado por anticuerpos y/o el desarrollo de la vasculopatía del injerto. Los resultados de estos estudios son discordantes, lo que convierte a esta lesión en un área de investigación interesante. En resumen pues, no hay consenso acerca de las posibles asociaciones entre el efecto Quilty y otros hallazgos histopatológicos ni como predictores del desenlace del injerto.
El efecto Quilty puede limitarse al endocardio, pero puede extenderse al miocardio adyacente. Algunos efectos Quilty, sobre todo cuando son muy grandes, se extienden por entre los miocitos subyacentes, ocasionando daño miocítico peri-Quilty. Se cree que este fenómeno, imitando el rechazo, a menudo constituye el sustrato de la clasificación histológica de grado 2 ISHLT -1990. En este escenario debemos determinar si se trata efectivamente de rechazo agudo. El diagnóstico diferencial requiere varias secciones en serie del bloque de parafina, en busca de un componente endocardial (aunque un rechazo agudo puede tener una distribución endocardial). Identificar pequeños vasos o capilares dentro del infiltrado inflamatorio es de gran utilidad para reconocer un efecto Quilty. Además, el estroma perimiocitario suele ser más fibroso en el efecto Quilty.
En algunos casos puede ser necesaria la tipificación de los linfocitos mediante técnicas de inmunoperoxidasa. En tal caso, el efecto Quilty mostrará una mezcla de linfocitos B y T y macrófagos, a diferencia de rechazo celular agudo en la que predominan las células T. También podemos utilizar el marcador CD21, cuya positividad es muy sugestiva de efecto Quilty. Sin embargo la negatividad para este anticuerpo no tiene ningún significado.
Si observamos efectos Quilty en diferentes fragmentos de biopsia, es muy probable que un foco inflamatorio dentro del miocardio corresponda también a un efecto Quilty. El diagnóstico de rechazo no puede sin embargo excluirse sobre esta base. Cuando las lesiones Quilty sanan, forman pequeñas cicatrices que simular sitios de biopsia previa. Por lo general, las cicatrices resultantes de los efectos Quilty tienden a ser más regulares y lineales, mientras que las cicatrices en sitio de biopsia previa dibujan unos márgenes más irregulares.
Daño isquémico (Peri-trasplante)
El daño isquémico, también denominado lesión isquémica o lesión peritrasplante, se observa frecuentemente en las biopsias realizadas durante las 6 primeras semanas siguientes al trasplante, aunque puede estar presente hasta los tres meses postrasplante. En ocasiones esta lesión es difícil de distinguir de rechazo celular agudo. Durante el periodo isquémico, cuando el corazón se transfiere desde el donante al receptor, un número variable de miocitos muere durante el proceso. La muerte de miocitos ocurre generalmente en grupos (grandes o pequeños). En la primera biopsia después del trasplante, la muerte de los miocitos puede ser casi imperceptible y aparente sólo por un aumento de la eosinofilia citoplasmática y la ausencia de núcleos. La inmunotinción con C4d, ya sea con inmunofluorescencia directa o con inmunohistoquímica, pone en evidencia los miocitos muertos. Ello no debe ser confundido con el rechazo mediado por anticuerpos. También puede observarse la muerte miocitaria tardía, que distinguiremos del rechazo celular agudo por la ausencia de infiltrado linfocitario. Asimismo debe tenerse en cuenta que, debido a la fuerte inmunosupresión a la que están sometidos estos pacientes, la inflamación puede no estar presente en las primeras etapas del proceso.
El pico máximo del proceso inflamatorio ocurre generalmente entre la 2ª y la 4ª semana postrasplante, y se trata fundamentalmente de una respuesta mediada por macrófagos. Esta inflamación puede ser muy extensa y asociada a daño miocítico. La composición mixta del infiltrado inflamatorio del daño isquémico es la clave para distinguirlo del infiltrado de rechazo celular agudo, el cual por lo general se caracteriza por un infiltrado rico en linfocitos. El daño isquémico también se asocia a menudo con un intersticio “sucio”. Cuando el rechazo celular y daño isquémico coexisten en la misma biopsia, puede ser muy difícil diferenciarlos. En estos casos, existe la tendencia a sobreestimar la magnitud del rechazo, sin embargo podemos ser cautos, ya que en la mayoría de estos pacientes se repetirá la biopsia en una o dos semanas.
Después del primer mes, la mayoría de las lesiones isquémicas aparecen como pequeños infartos en resolución, caracterizados por los macrófagos cargados de pigmento, tejido conectivo laxo y pérdida focal de los miocitos. En esta fase es fácil distinguir el daño isquémico de rechazo celular, pero es difícil de diferenciar del sitio de biopsia previa.
Cambios de sitio de biopsia y trombo
La arquitectura del ventrículo derecho provoca que el biotomo sea dirigido comúnmente hacia las mismas zonas donde se realizaron biopsias previas, por lo tanto es necesario reconocer, en pacientes de trasplante, las alteraciones histológicas causadas por estas biopsias previas. La apariencia de la lesión de biopsia previa variará dependiendo del intervalo entre biopsias. Una lesión reciente de sitio de biopsia puede presentarse como un defecto endomiocárdico focal recubierto de material fibrinoplaquetario o por un trombo organizado asociado con algunas células inflamatorias (macrófagos, linfocitos T y B). La lesión de biopsia previa en fase reparadora puede consistir en la formación de tejido de granulación, y finalmente evolucionará a una cicatriz endocárdica focal. Los miocitos adyacentes a la cicatriz pueden mostrar desorganización focal y/o hipertrofia irregular, apareciendo desordenados. En casos en los que los pacientes se someten a repetidas biopsias endomiocárdicas, como ocurre en el trasplante cardíaco, la posibilidad de obtener una lesión de biopsia previa se ha informado que van desde una de cada siete hasta casi el 70% de las biopsias.
La inflamación presente en las áreas de biopsia previa no posee el significado de rechazo celular y por lo tanto no debe ser calificado como tal. Por lo tanto, una biopsia puede ser negativa para el rechazo (0R), pero presentar un área de la inflamación relacionada con un sitio de biopsia previa.
Linfocitos intravasculares
En algunos individuos, aparecen colecciones de linfocitos llenando un canal linfático. La etiología de este hallazgo es desconocida. Este fenómeno no está relacionado con el rechazo celular agudo y no necesita ser informado.
Tejido adiposo y células mesoteliales
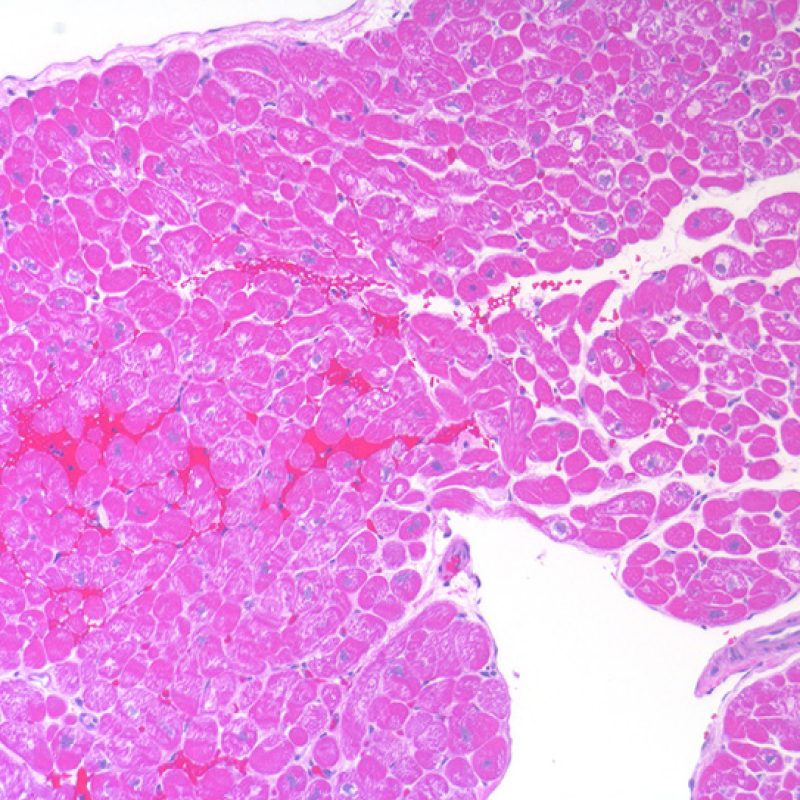
El tejido adiposo, aunque menor, es un componente normal del miocardio y con frecuencia se reparte cerca de las arteriolas de dimensiones más grandes. En ocasiones, las muestras de biopsia incluyen grupos de adipocitos o tejido adiposo puro. Con frecuencia, tendrá pequeñas porciones de miocardio no compacto adjunto. Estos fragmentos provienen de la pared libre del ventrículo derecho, por lo que no son adecuados para la evaluación del rechazo debido al lugar de donde proceden, y además tienen poca o ninguna importancia. En algunos casos, sin embargo, la presencia de tejido adiposo puede ser un mal presagio. Ello ocurre cuando se observan tiras de mesotelio, ya sea unido a tejido adiposo o simplemente hallados separados en la muestra, o cuando el tejido adiposo contiene pequeños nervios. Estos hallazgos indican perforación del ventrículo derecho, por lo que debe notificar al clínico para informarle urgentemente de este hecho, debido al riesgo de hemopericardio significativo. En la mayoría de los pacientes con trasplante cardiaco, el pericardio se ha adherido al corazón, por lo que el riesgo de hemopericardio fatal es significativamente menor en comparación con pacientes no trasplantados.
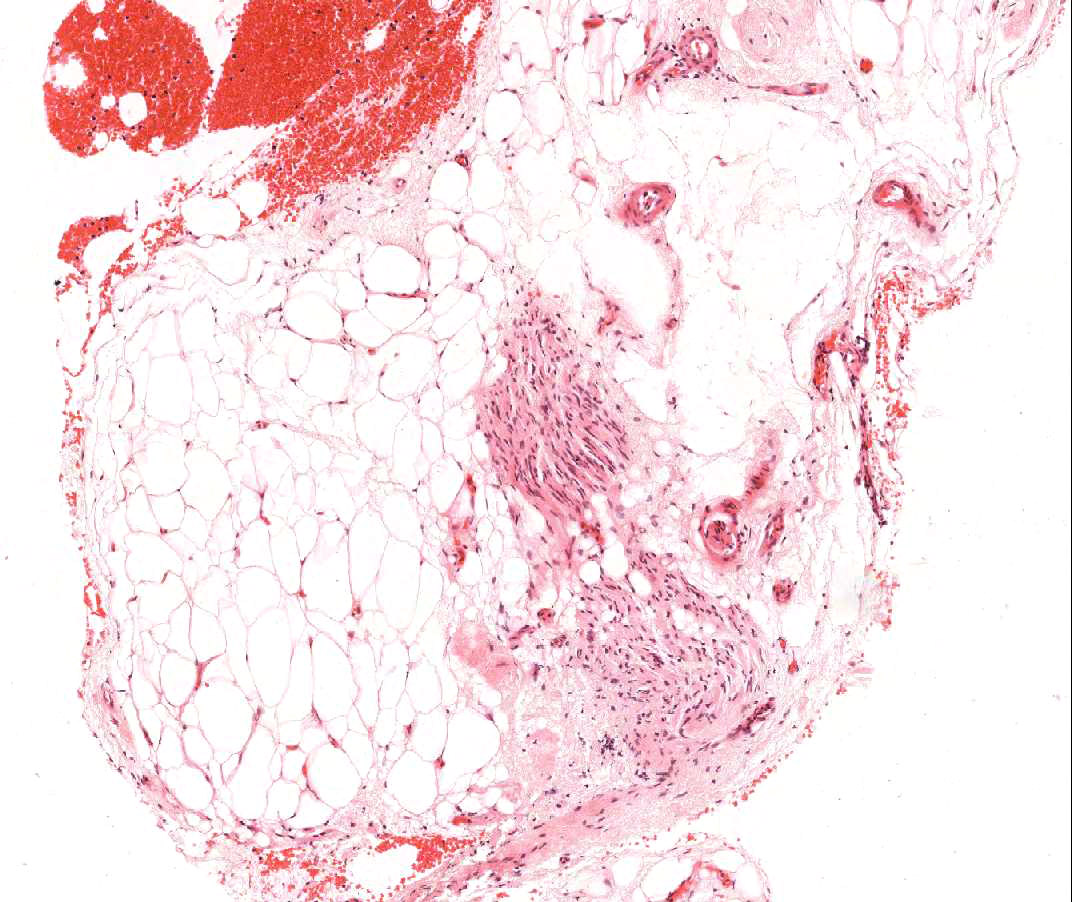
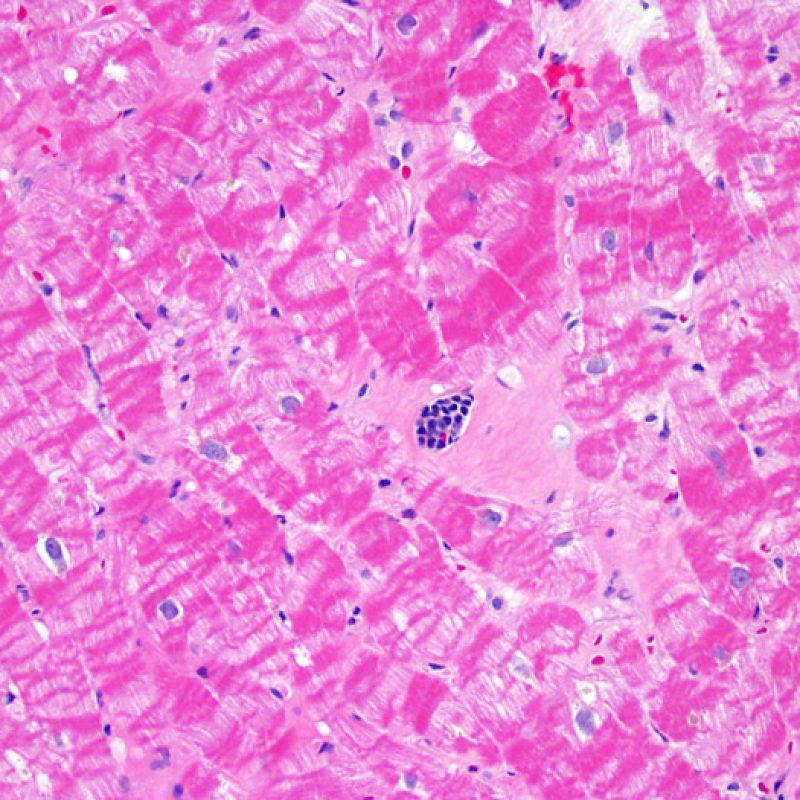
Calcificación de los miocitos
La presencia de calcificación miocítica es un hallazgo extremadamente raro en el trasplante cardíaco y probablemente está relacionada con el desarrollo de la hipercalcemia transitoria durante la cirugía del trasplante. También puede ser observado en antiguos sitios de biopsia. La calcificación miocítica ocurre con mayor probabilidad en pacientes con cuadros de insuficiencia renal aguda o crónica. Microscópicamente aparecen como calcificaciones de miocitos, individualmente o en grupos. Fibrosis puede ocurrir en estos sitios, pero la inflamación no es típica. Aunque la calcificación cardiaca extensa podría afectar negativamente a la función cardíaca, este hallazgo no está de ninguna manera relacionado con el rechazo celular agudo.
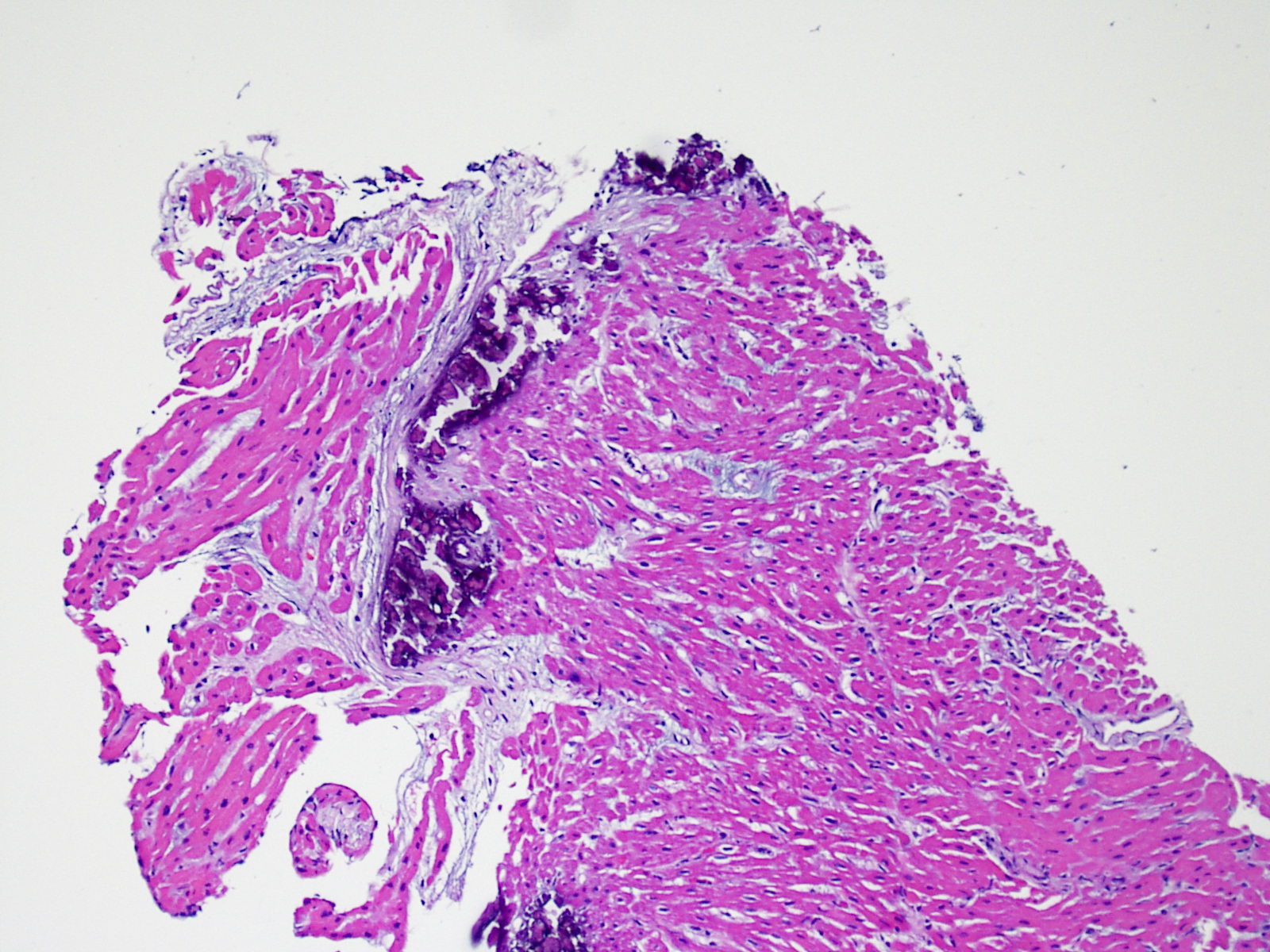
Recurrencia de la enfermedad
Se sabe que algunas enfermedades que causan insuficiencia cardíaca pueden reaparecer en el corazón trasplantado. Éstas incluyen la sarcoidosis, la miocarditis de células gigantes, la amiloidosis, la enfermedad de Chagas y los depósitos de cadenas ligeras. Por lo tanto, es importante que el patólogo este siempre informado acerca de la enfermedad subyacente que llevó al trasplante, de modo que pueda controlar posibles recurrencias. Además, cabe señalar que particularmente la sarcoidosis y la miocarditis de células gigantes pueden simular rechazo celular agudo cuando recurren.
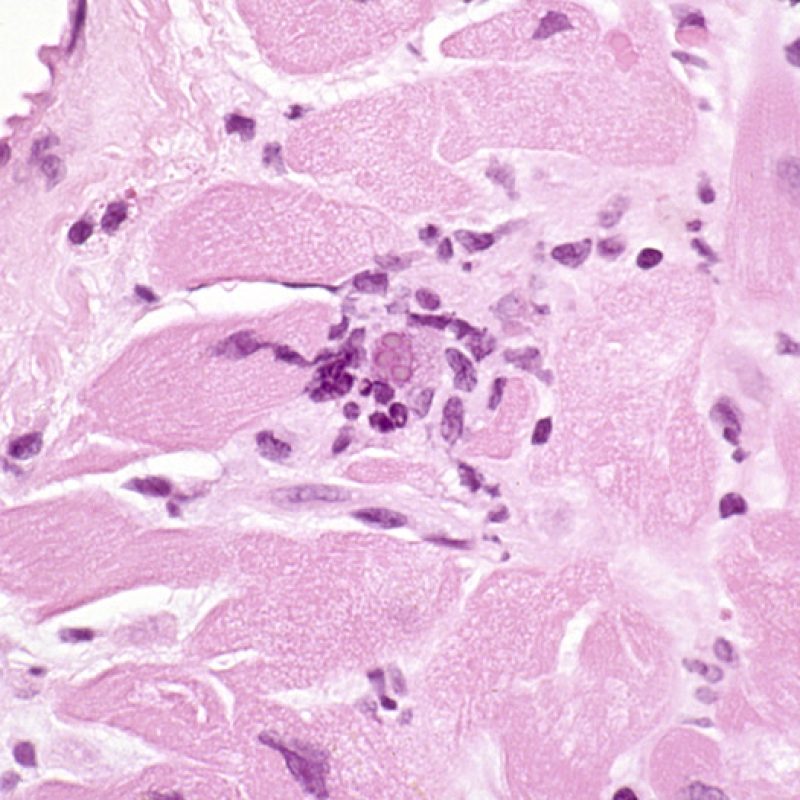
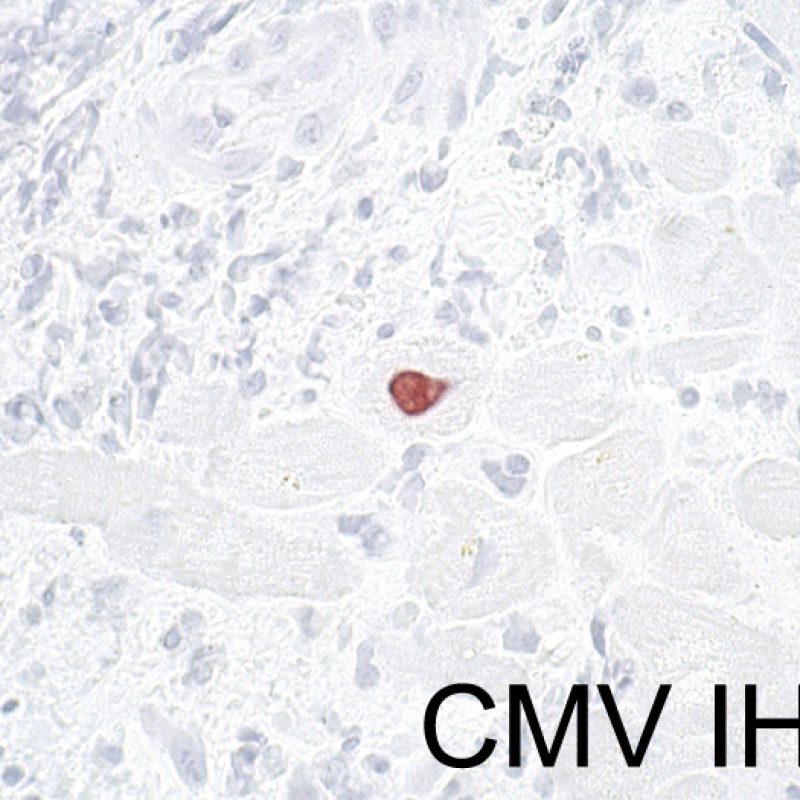
Infección
Es inusual identificar una infección en una biopsia endomiocárdica a pesar del elevado riesgo de infección que, debido a la inmunosupresión, tienen los pacientes trasplantados. La presencia de citomegalovirus (CMV) ha sido documentado en material de biopsia, sin embargo dicha infección se identifica mejor por serología (solo si el receptor era negativo para CMV antes del trasplante) o en otros tejidos (por ejemplo, el esófago). En cualquier caso, es posible identificar las inclusiones virales en el material de biopsia, las cuales deben ser caracterizados adicionalmente con tinción inmunohistoquímica para el CMV u otros virus. En caso de identificar una infección debemos informar al clínico, pero no se debe confundirse con el rechazo celular agudo. La Toxoplasmosis se ha descrito en los corazones trasplantados. Los bradizoítos pueden llenar el citoplasma de los miocitos sin provocar una reacción inflamatoria significativa. Cuando hay una sospecha en este sentido, los bradizoítos puede ser detectados con un estudio inmunohistoquímico.
Transtorno linfoproliferativo postrasplante (TLPT o PTLD [de las siglas en ingles: Post Transplant lymphoproliferative Disorder])
Aunque los trastornos linfoproliferativos post-trasplante (PTLD) ocurren en un porcentaje bastante alto (hasta un 6%) de los pacientes trasplantados, es extremadamente inusual diagnosticarlo en una biopsia endomiocárdica. Histológicamente, cuando aparecen, están constituidos por infiltrados de linfocitos B que simulan el rechazo celular agudo. Estos casos son generalmente positivos para el Virus de Epstein-Barr (EBV), por los que en los casos sospechosos, debe procederse a la hibridación in situ para EBV y a la caracterización inmunohistoquímica de los linfocitos B (anticuerpo anti-CD20). El diagnóstico de TLPT/PTLD a veces se toma en consideración cuando un paciente no responde al tratamiento de lo que se interpreta como un rechazo celular agudo. La presencia de un número significativo de células plasmáticas en la biopsia endomiocárdica es un hallazgo inusual, por lo que puede ser apropiado para evaluar al paciente para un posible TLPT/PTLD plasmacitoide. En muy raras ocasiones, también los linfomas de células T pueden causar TLPT/PTLD.
Cuerpo extraño
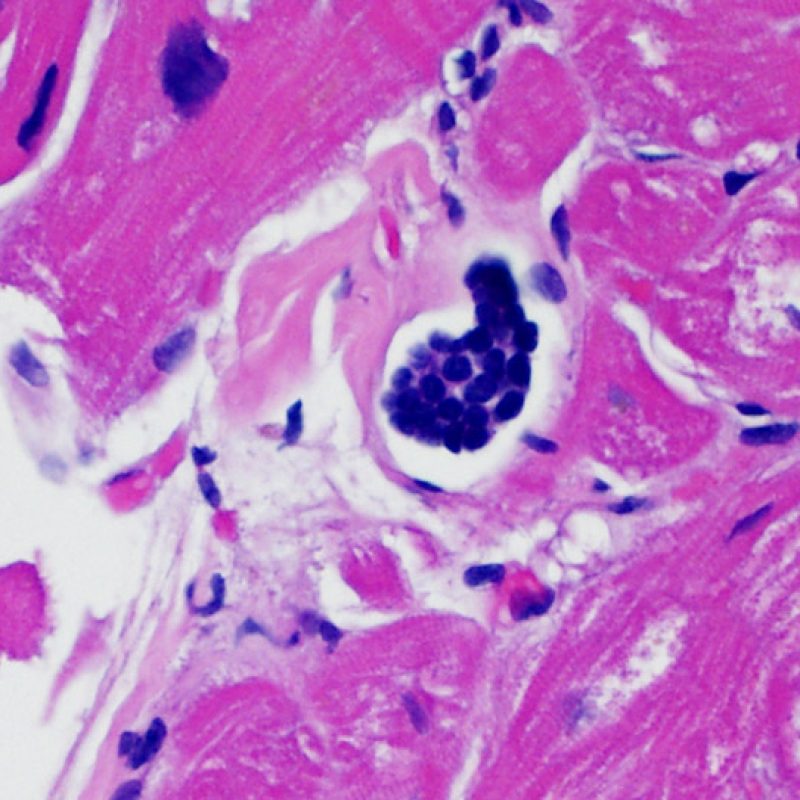
Pequeños agregados de células gigantes a cuerpo extraño pueden ser vistos en el endocardio de pacientes trasplantados a los que se les han realizado biopsias repetidas. Estas lesiones pueden contener material refráctil. Este material corresponde probablemente a fragmentos microscópicos de algodón procedentes de la gasa que se han utilizado para limpiar el biotomo entre biopsias.
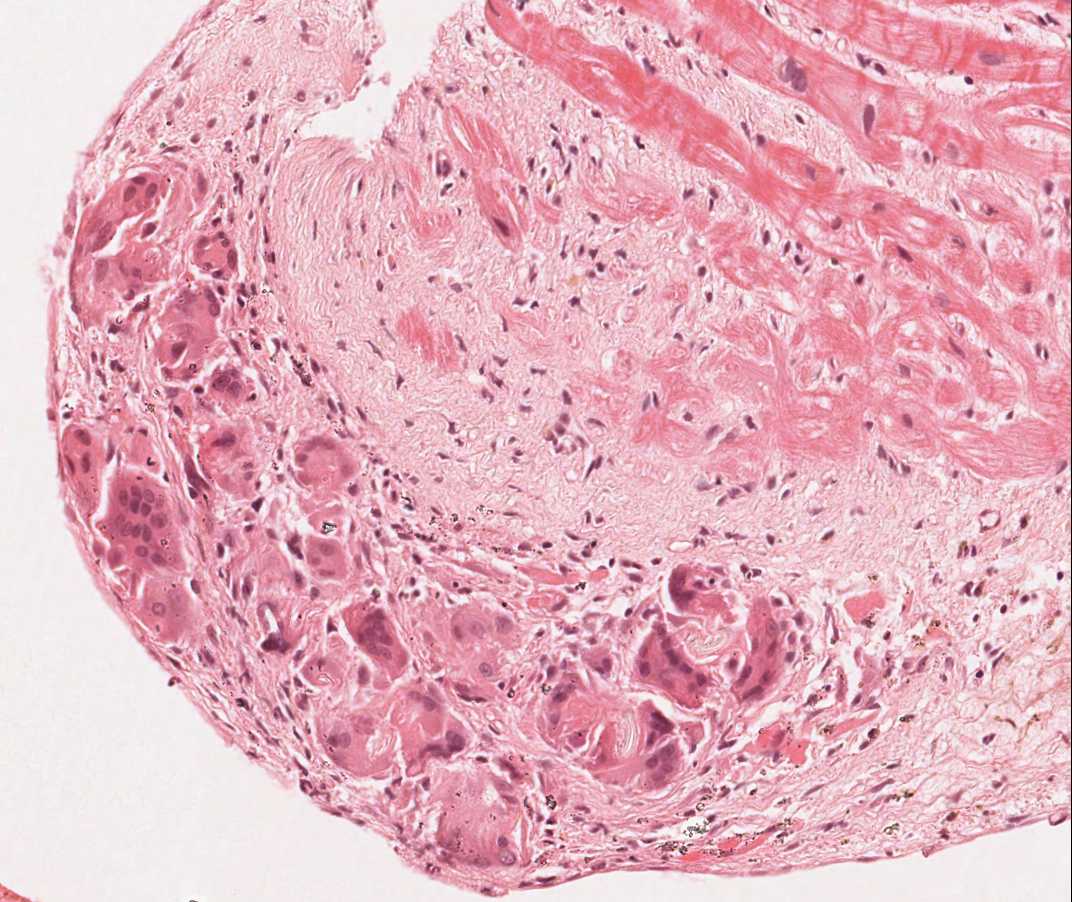
Fragmentos de la válvula tricúspide y fragmentos de hígado
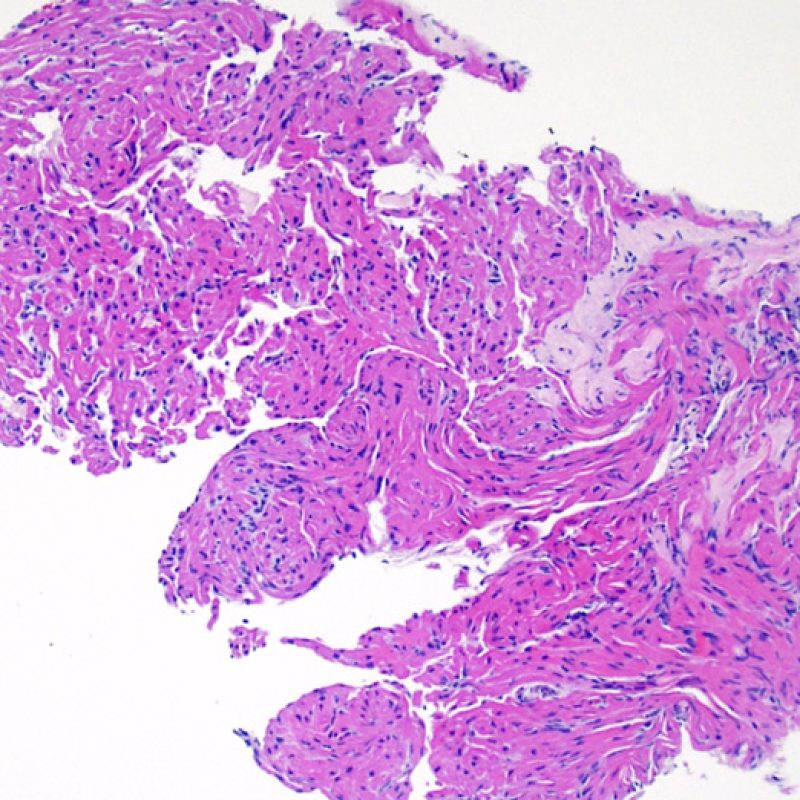
Alrededor del 12% de los pacientes trasplantados desarrollan un soplo tricúspide en los años posteriores al trasplante. Las causas más comunes de insuficiencia tricuspídea postrasplante son la insuficiencia cardíaca congestiva, la dilatación del anillo valvular o la hipertensión pulmonar. Más raramente ocurre por el rasgado accidental de alguna valva o debido al corte de una cuerda tendinosa por el biotomo al atravesar la válvula tricúspide. Cuando en la muestra de biopsia se hallan fragmentos tisulares de la válvula o de cuerda tendinosa es conveniente informar al médico. Si bien la biopsia de un tendón se tolera generalmente bien, una laceración lo suficientemente amplia de una valva puede tener un impacto significativo en la función del injerto. Histológicamente, un fragmento de una valva o de una cuerda tendinosa aparece esencialmente como un fragmento fino de tejido fibroso, con fibras elásticas alineadas paralelamente al eje longitudinal del fragmento. A diferencia de una pieza de endocardio engrosada, pueden observarse células endoteliales a ambos lados del fragmento, si bien la distinción entra ambas estructuras puede que no sea fácil.
En casos extremadamente raros, el biotomo puede pasar de la vena cava superior a la vena cava inferior, sin que el clínico lo note, de modo que en este caso las muestras se tomaran del hígado y no del corazón. Así, la presencia de tejido hepático en una sección de biopsia puede provenir del paciente o puede ser debido a una posible contaminación “tisular” producida en el laboratorio de histopatología.
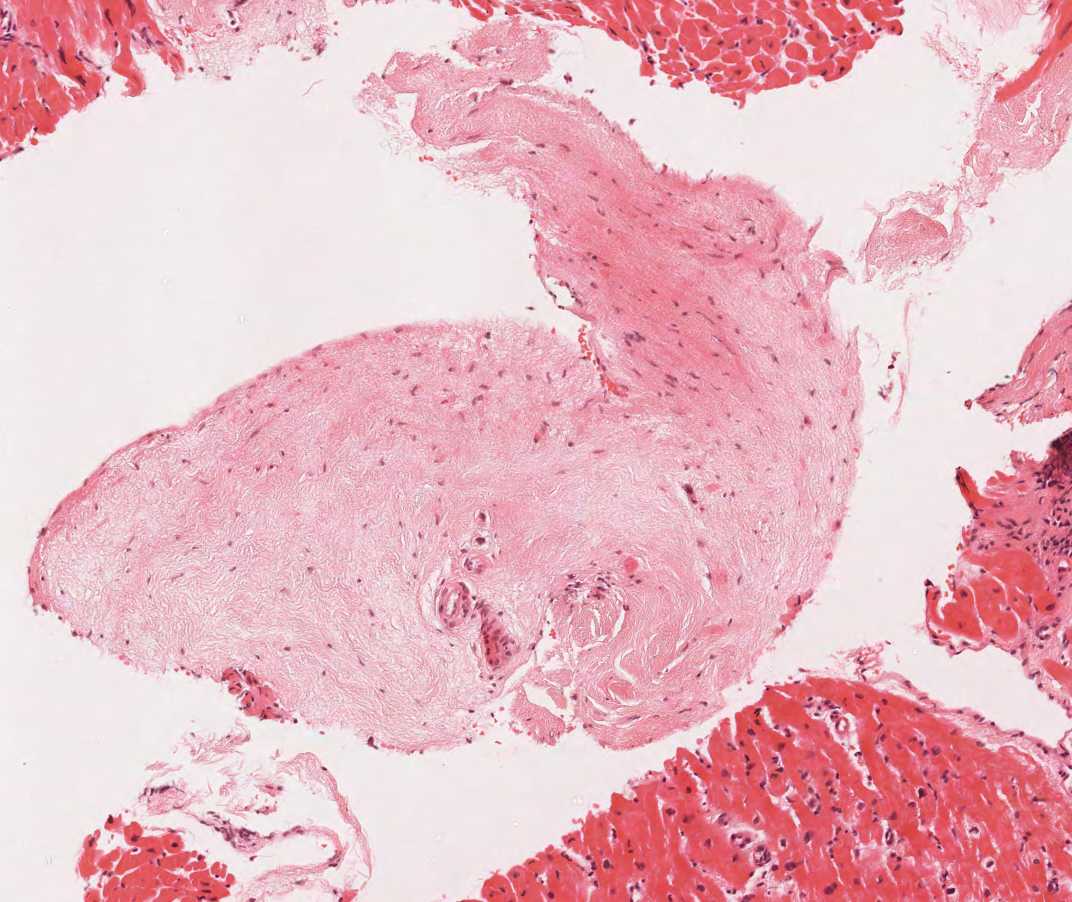
Artefactos
Las biopsias endomiocárdicas pueden presentar diversos artefactos. Los más importantes se ilustran a continuación. Estos artefactos pueden ser mal interpretados por los incautos como patologías significativas a pesar de que no lo son.
Bandas de contracción
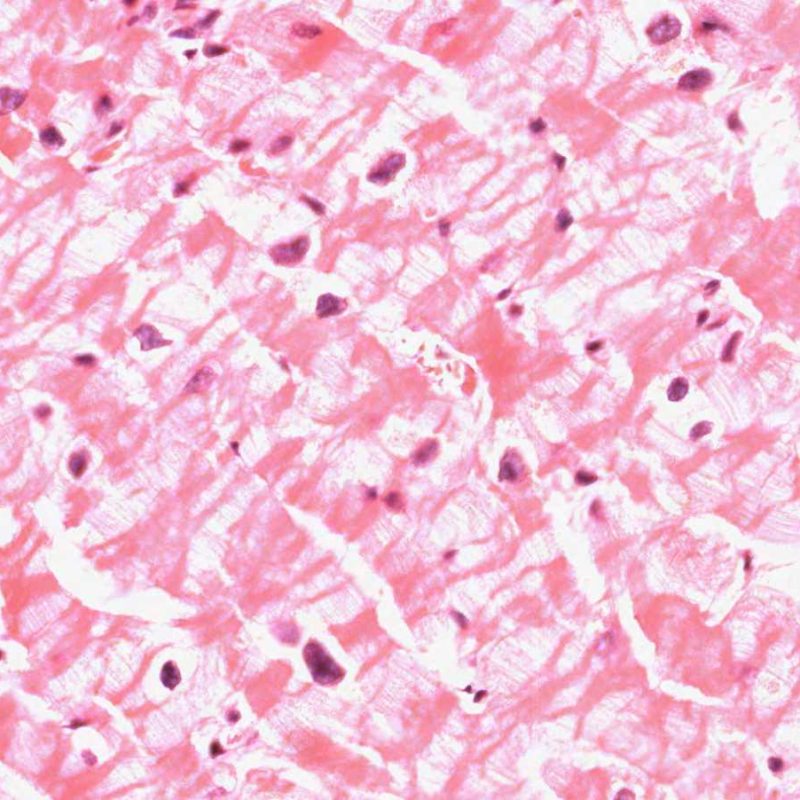
Al tomar las biopsias endomiocárdicas deben colocarse con cuidado en formalina para evitar el artefacto de aplastamiento. No obstante por muy cuidadosamente que sean tratados los fragmentos de biopsia, la retracción de los miocitos es inevitable, ya que por definición la biopsia implica cortar el miocardio. La prominencia de las bandas se agrava si el fijador está frio en lugar de a temperatura ambiente. Las bandas Z se engruesan y los sarcómeros se hipercontraen, pero las miofibrillas se mantienen intactas. El resultado es las bandas de contracción. Este fenómeno se observa comúnmente y, con frecuencia, de forma extensa, pero no tiene ninguna importancia patológica.
Las bandas de contracción deben diferenciarse de la necrosis con bandas de contracción / miocitolisis, que se observan en el daño de reperfusión del periodo post-operativo, durante tratamientos con inotrópicos en diversas circunstancias clínicas y en los corazones de los donantes que han muerto de hemorragia intracraneal. Esta forma de necrosis afecta a células individuales o a pequeños grupos celulares, rodeados de miocitos de apariencia normal. Las bandas Z que enlazan miocitos se rompen. Las miofibrillas sarcoméricas se fragmentan y adquieren un tono basófilo granular, ya que se mineralizan debido a la deposición intracelular de calcio.
Telescopaje de los vasos sanguíneos
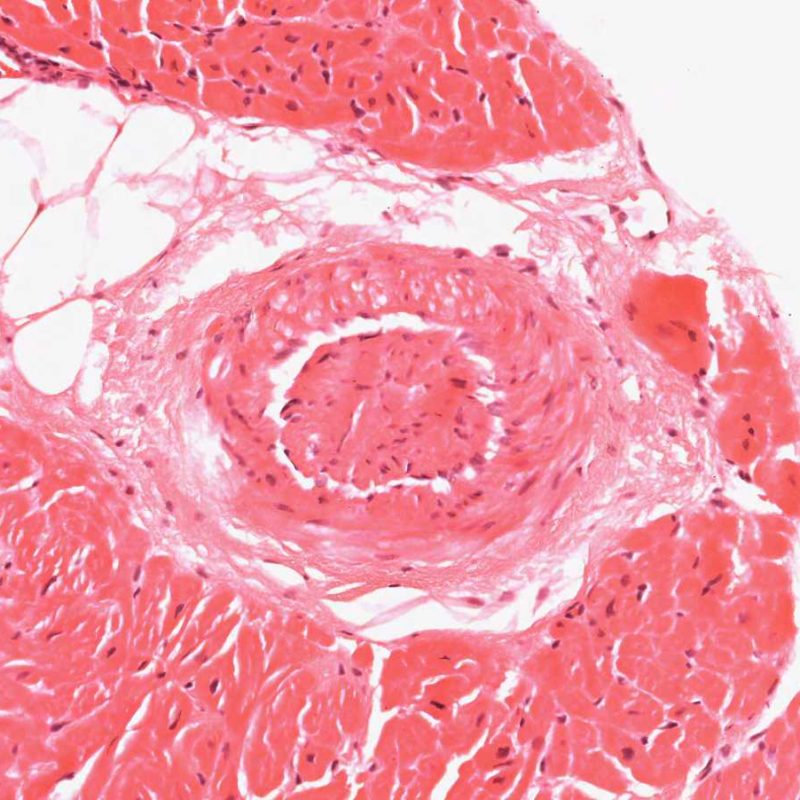
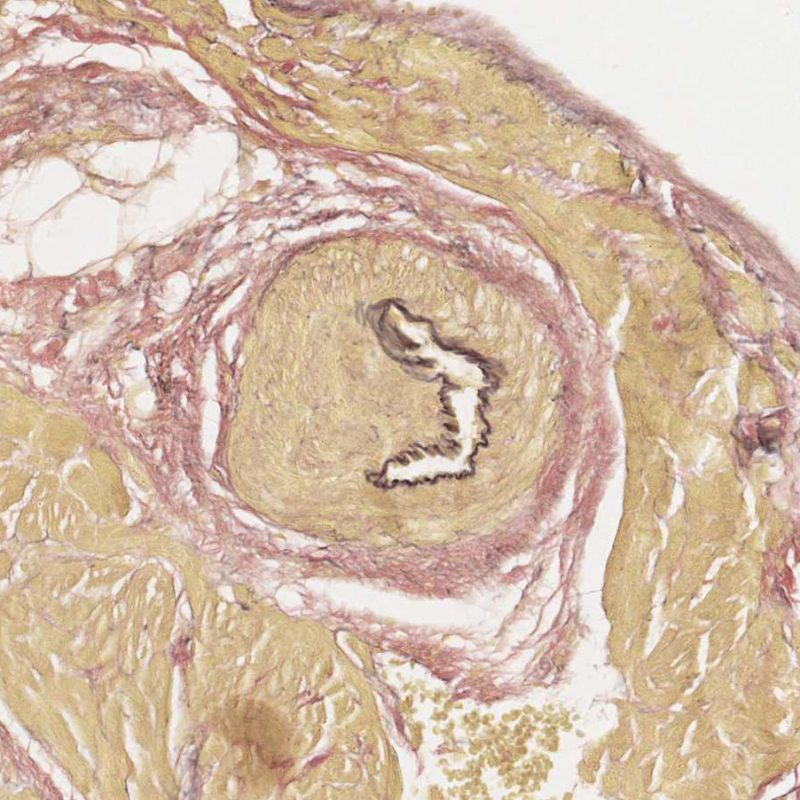
Un artefacto común intrínseco a la biopsia es el “telescopaje” de las pequeñas arterias debido a la retracción elástica de la capa media que se produce cuando el biotomo corta y tira de la biopsia desde el septo. Los vasos se recogen en sí mismos, resultando una apariencia que puede inducir a error a los incautos al malinterpretarla como cambios de vasculopatía crónica del aloinjerto cardíaco (CAV), ya que la luz vascular está inevitablemente ocluida en este proceso. Sin embargo, la inspección cuidadosa con ayuda de tinciones de tejido conectivo, como la tinción de Miller Elastic Van Gieson, mostrará una íntima normal y delineará claramente la lámina elástica interna y externa de la pared del vaso.
El telescopaje no tiene importancia clínica, simplemente refleja el sitio de la biopsia – cerca del septo interventricular donde pueden biopsiarse inadvertidamente pequeñas ramas penetrantes de la arteria coronaria izquierda descendente anterior. La vasculopatía crónica del injerto (CAV de las siglas en ingles), puede muy ocasionalmente diagnosticarse por esta vía, por lo tanto es recomendable una comprobación cuidadosa de la arquitectura de estos vasos!.
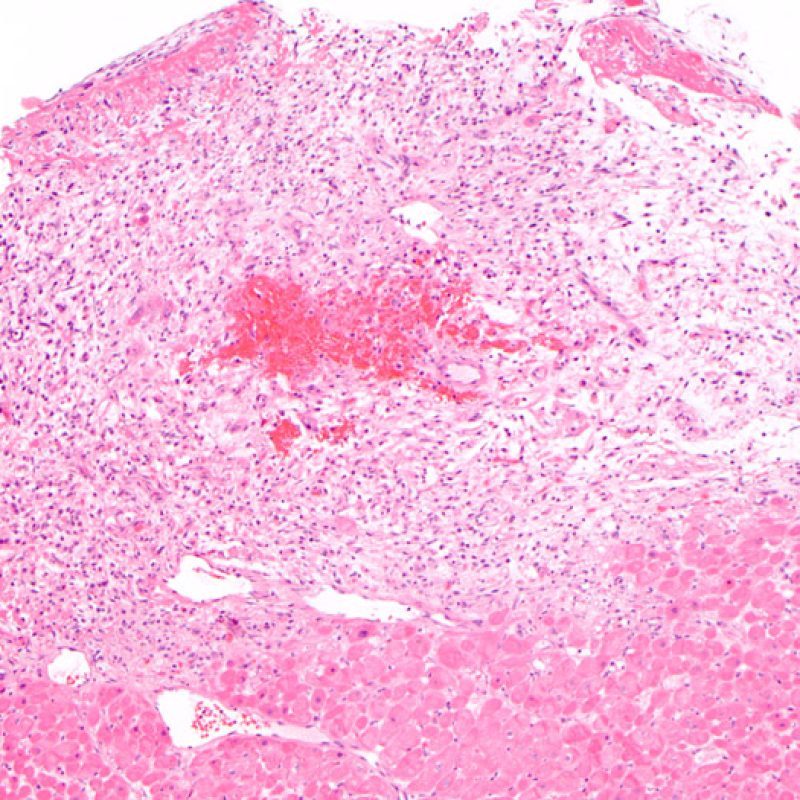
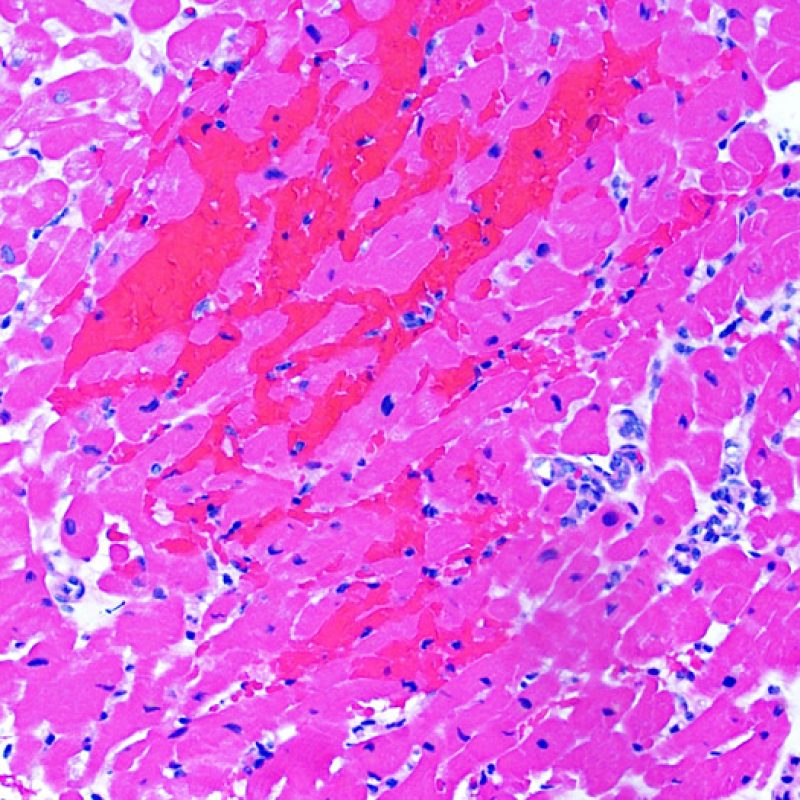
Hemorragia inducida por la biopsia
En ocasiones, la adquisición de fragmentos de biopsia puede causar hemorragia del tejido. A diferencia de la hemorragia que ocurre en el rechazo grave (grado 3R), esta hemorragia normalmente no está asociada a inflamación marcada ni a edema tisular.
Consideraciones sobre la biopsia pediátrica
Las biopsias pediátricas de trasplante cardíaco se ven generalmente en hospitales pediátricos, o en instituciones que combinan programas pediátricos y para adultos. La biopsia endomiocárdica (BEM) pediátrica rutinaria de seguimiento es menos frecuente que los trasplantes de adultos. Si bien la información que se aplica a los casos pediátricos es la misma que hemos descrito para los casos de adultos, hay algunas características especiales a tener en cuenta que se tratan aquí.
Tamaño de la biopsia
Particularmente en trasplantes infantiles, el tamaño de las piezas de biopsia puede ser considerablemente menor que en el resto de la población pediátrica. Esto es el resultado del uso de bioptomos más pequeños debido al estrecho acceso vascular y al pequeño tamaño del corazón. Aun así, los casos pediátricos deben tener un mínimo de 3 piezas de tejido para su evaluación.
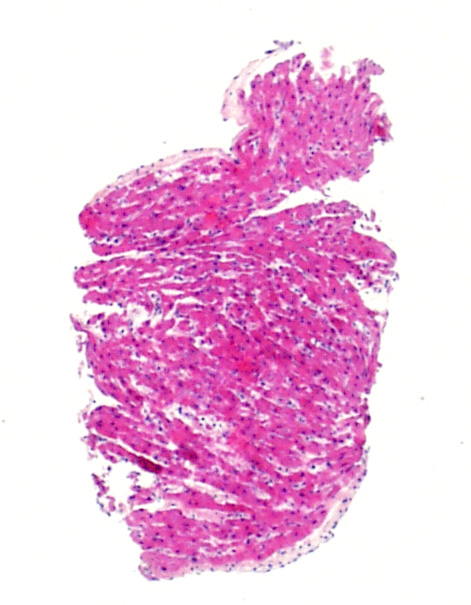
Impresión de aumento de celularidad
Los miocitos de corazones neonatales y pediátricos son significativamente más pequeños que los miocitos adolescentes y adultos. Por lo tanto, la relación núcleo/citoplasma es tal que las biopsias parecen significativamente más celular. Si usted está acostumbrado a la evaluación de biopsias de adultos, deberá tener en cuenta esta circunstancia, y buscar específicamente los linfocitos y no sólo un mayor N/C ratio. Además, las células endoteliales pediátricas pueden aparecer más prominentes y se destacan más en la biopsia. Una vez más, esto es algo a tener en cuenta en la población de esta edad.
Tasas de rechazo
En una de nuestras instituciones se observó que las tasas de rechazo en la población pediátrica (edad 1-18) fueron más o menos el doble de la población adulta. Uno de los mayores problemas era el cumplimiento de la medicación entre los pacientes trasplantados adolescentes. Una segunda causa potencial de esta tasa de rechazo en edad pediátrica es un sistema inmune más robusto en los niños que en los ancianos. Si usted nota que está diagnosticando una mayor tasa de rechazo entre la población infantil que en la población adulta, esto es razonable.