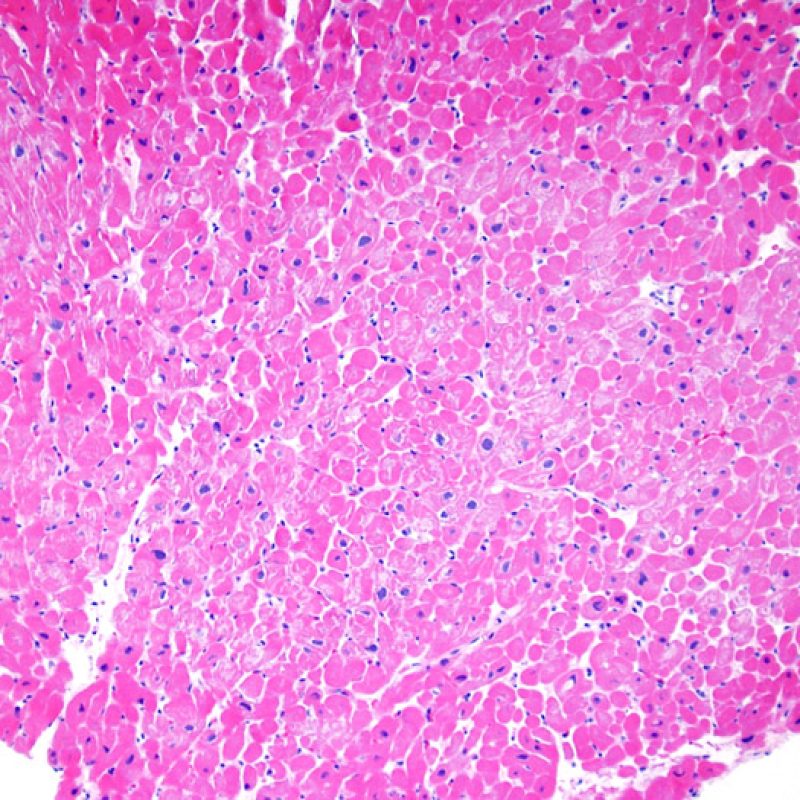
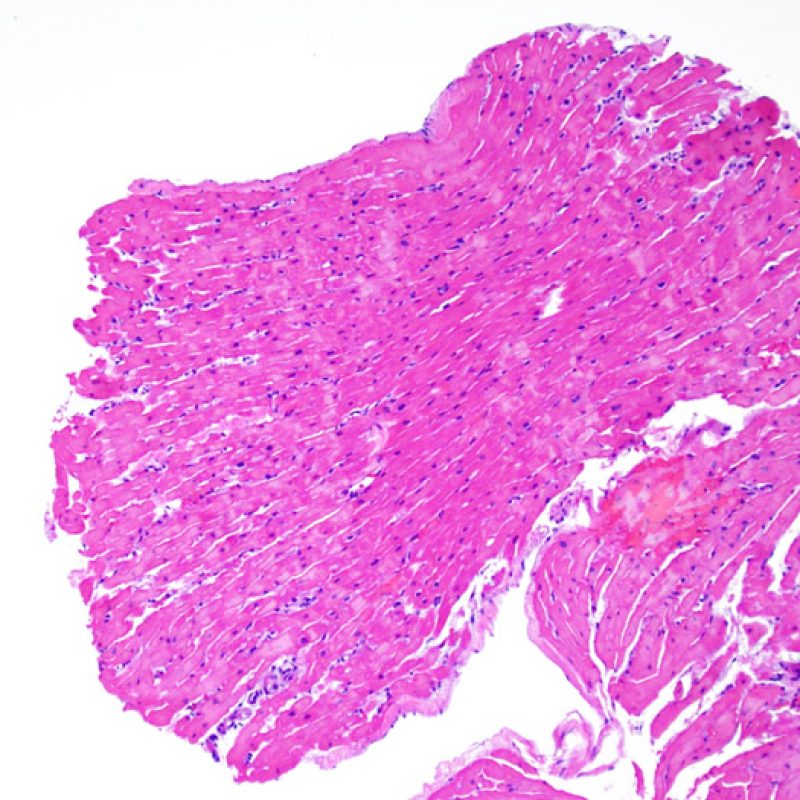
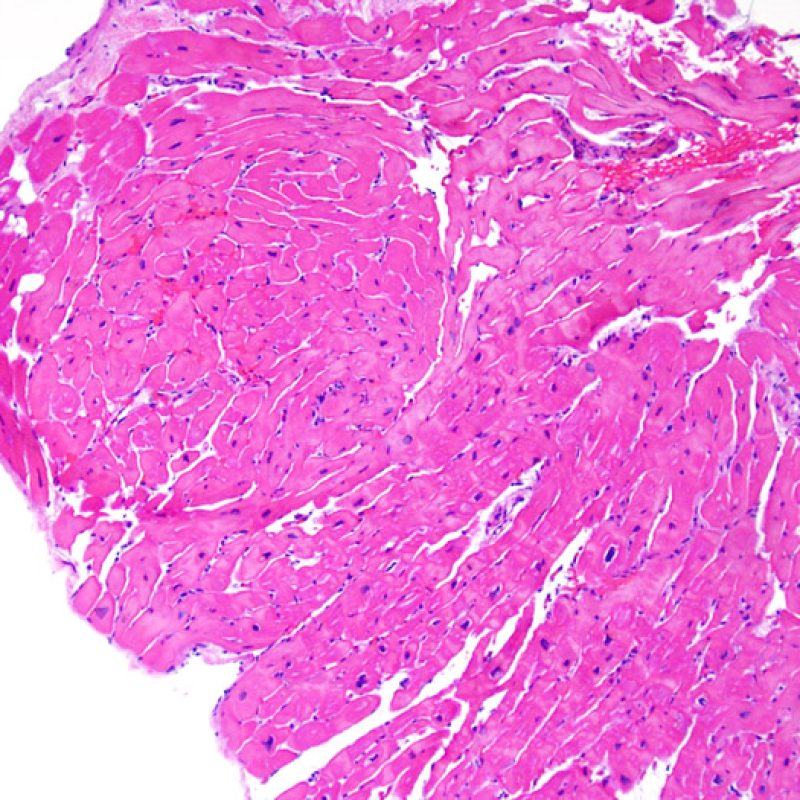
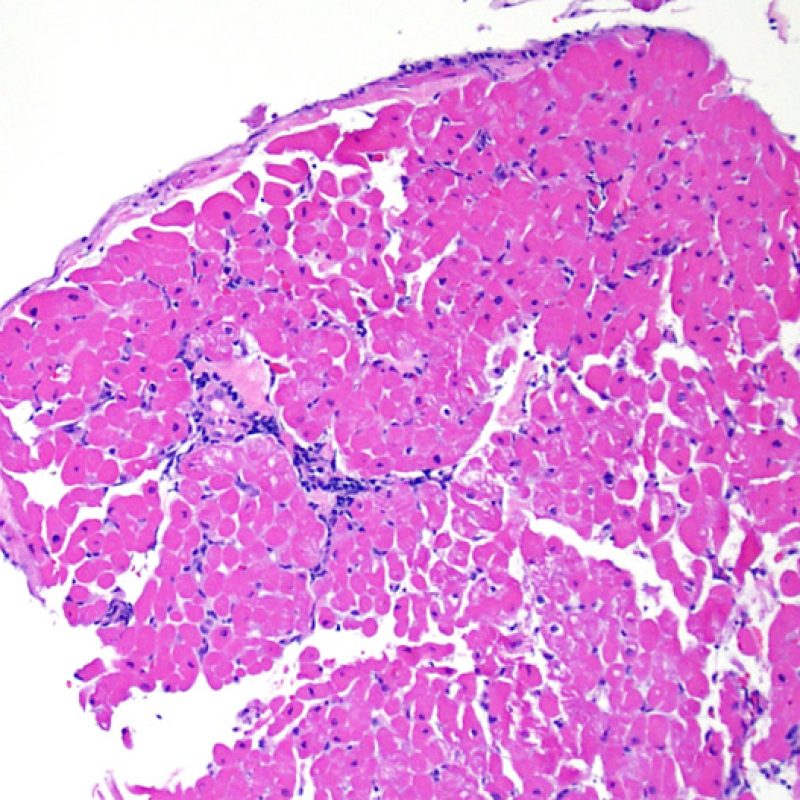
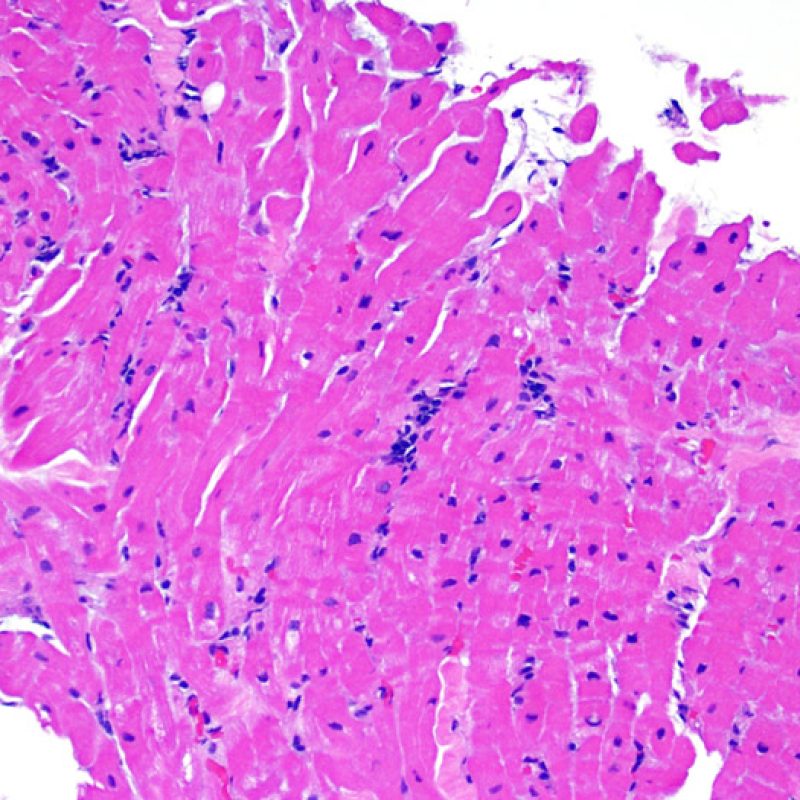
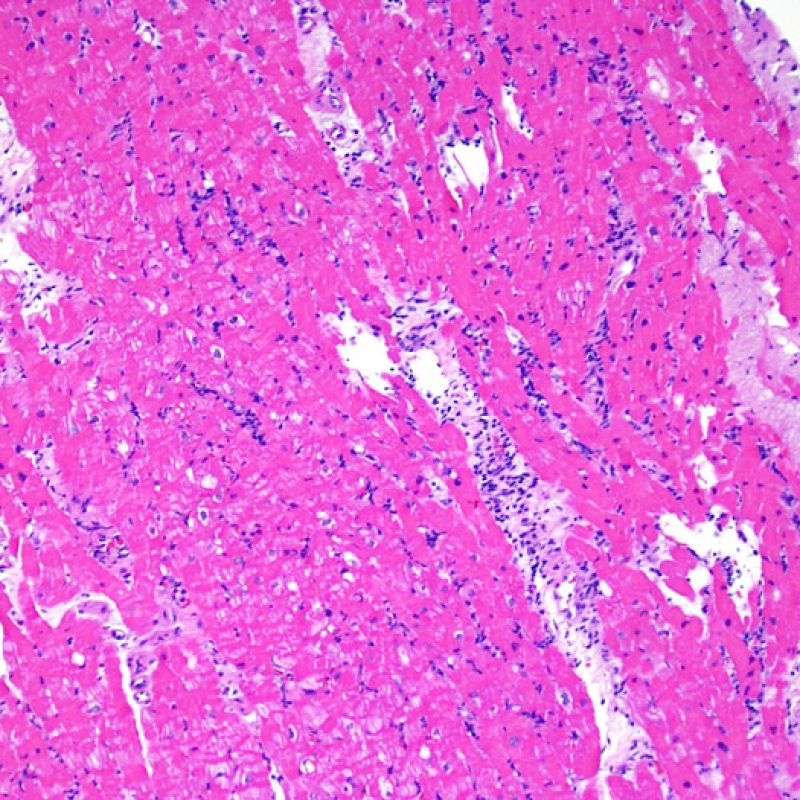
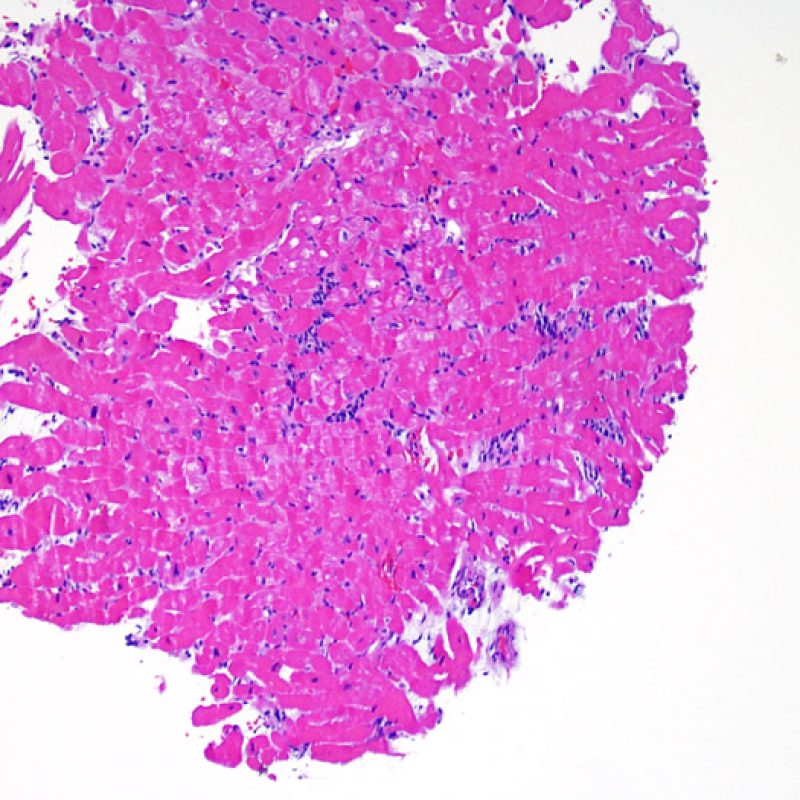
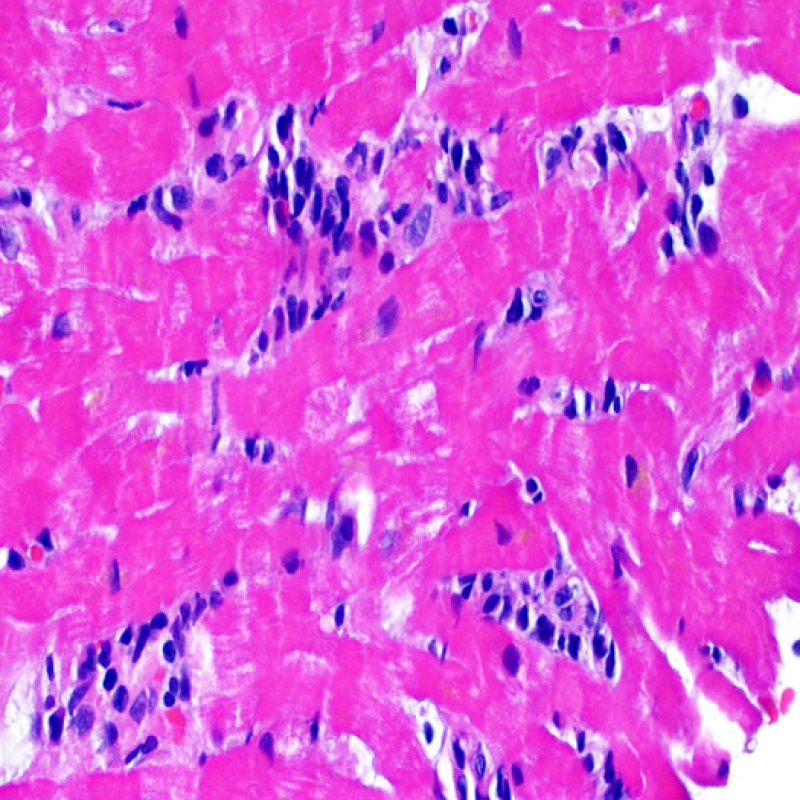
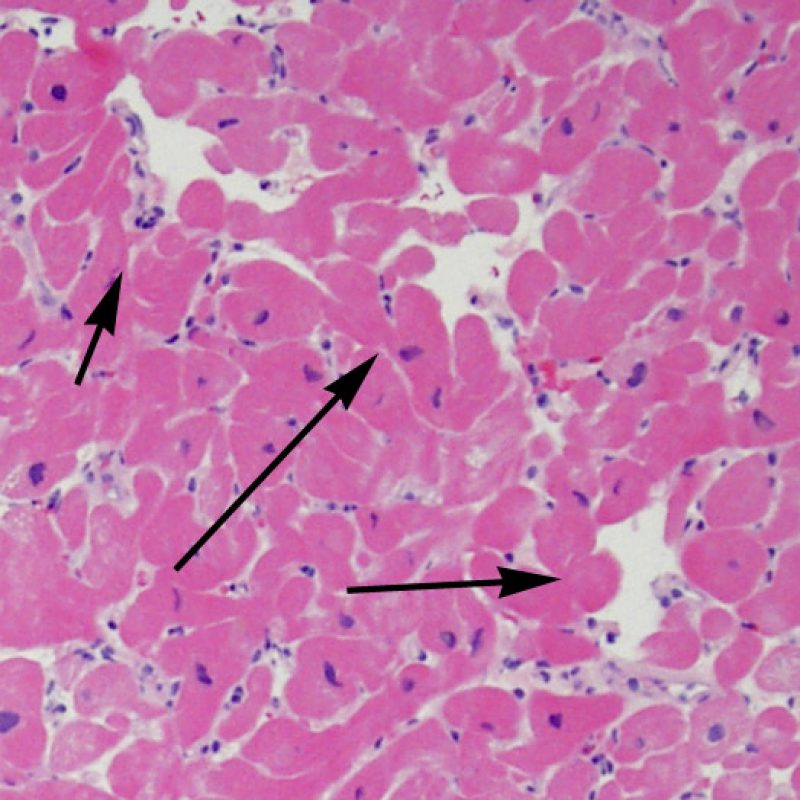
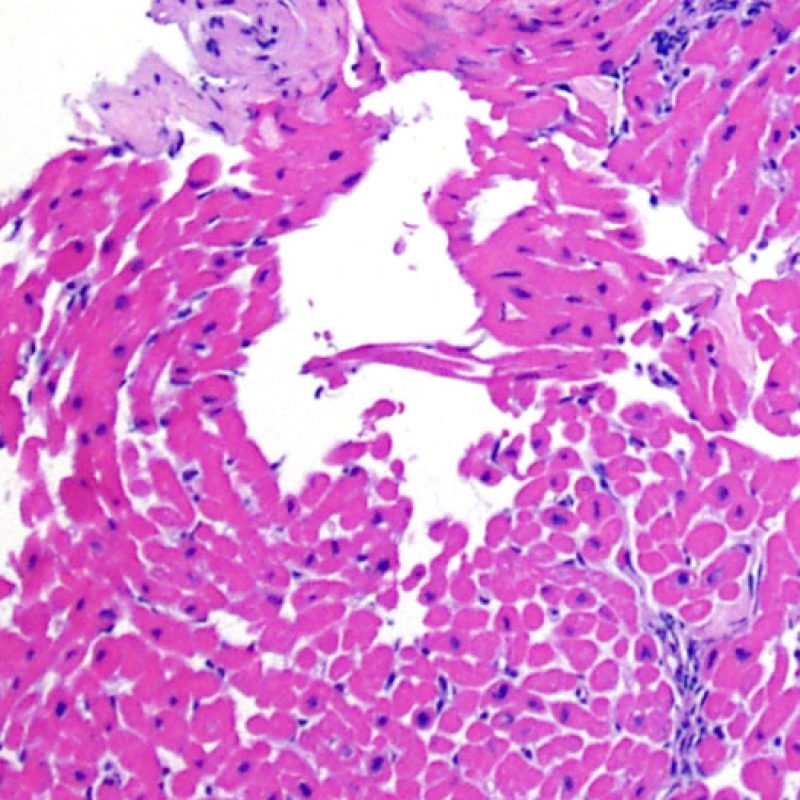
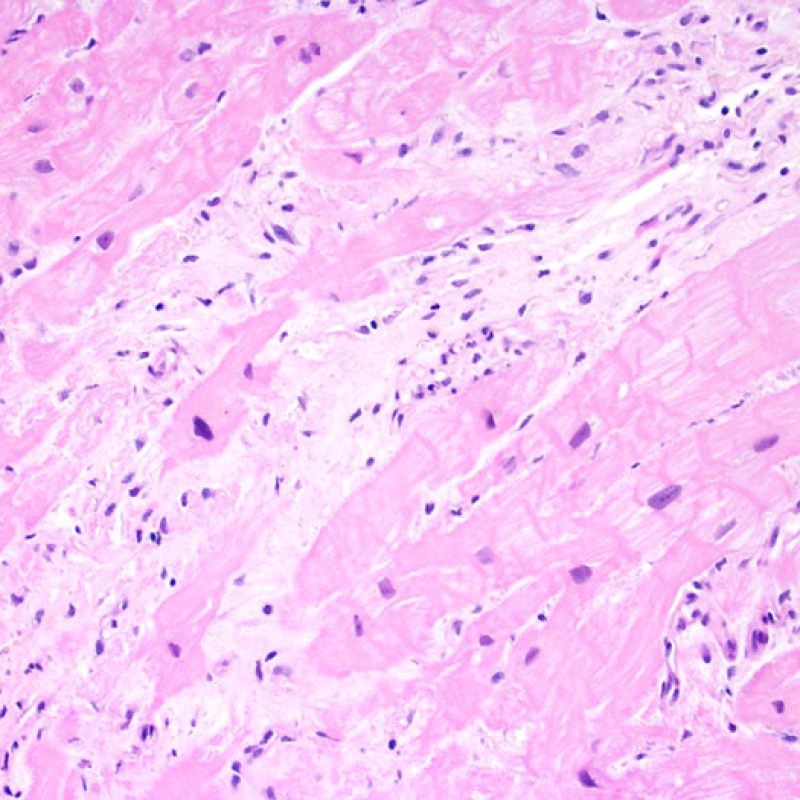
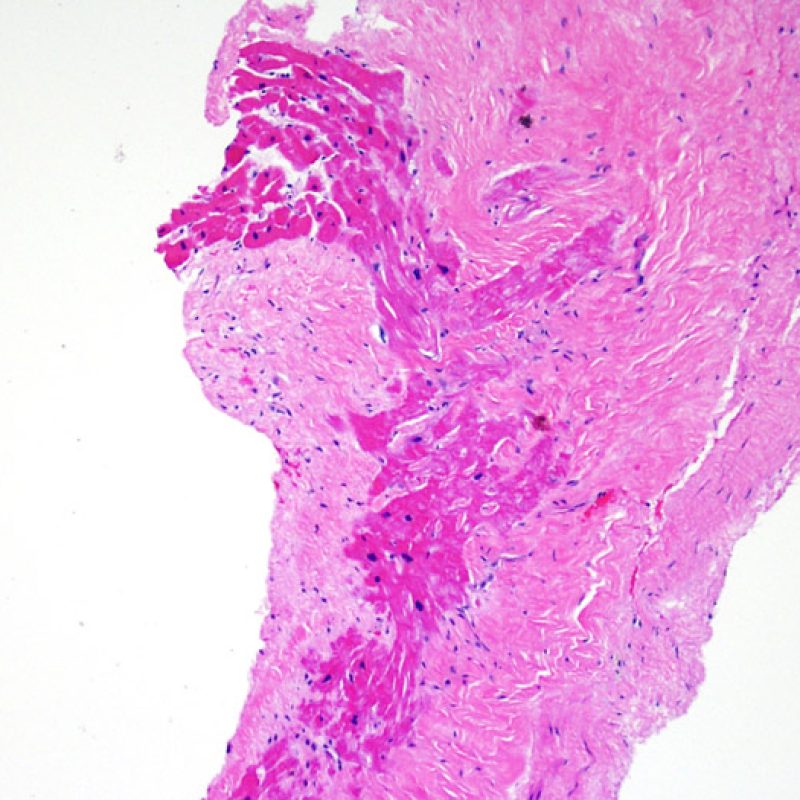
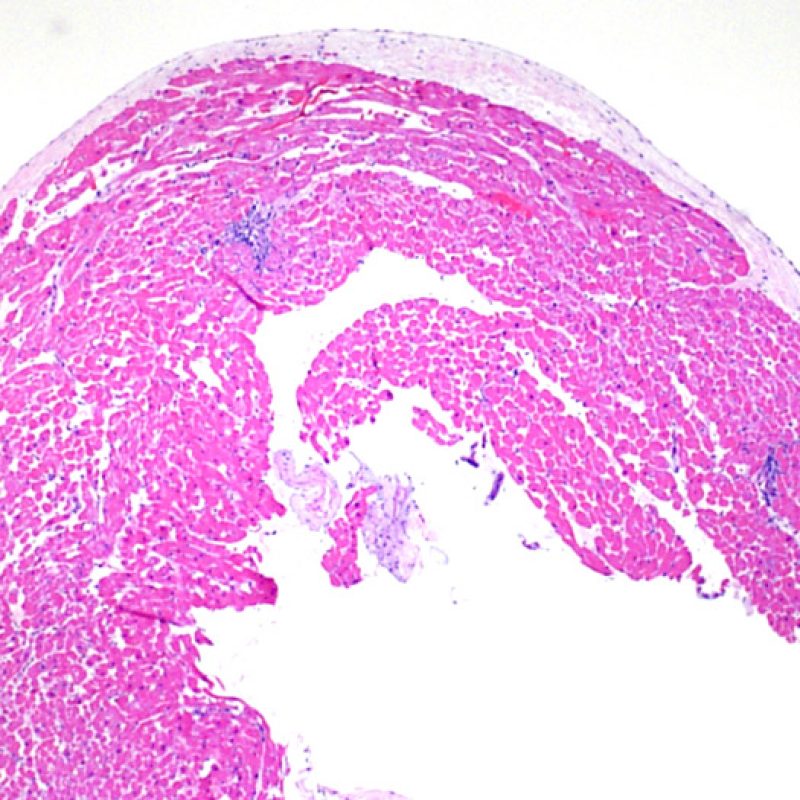
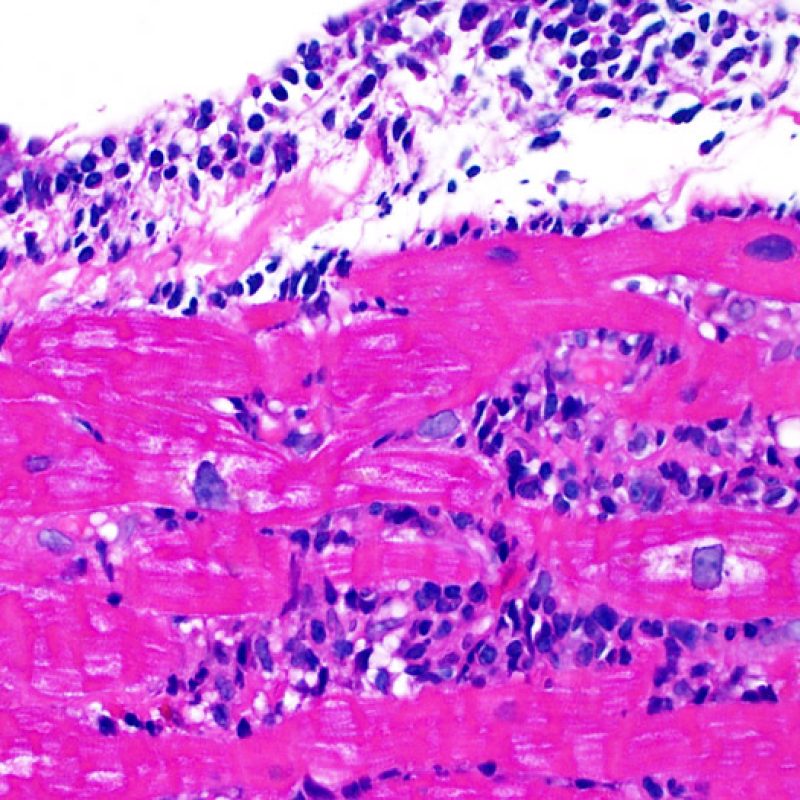
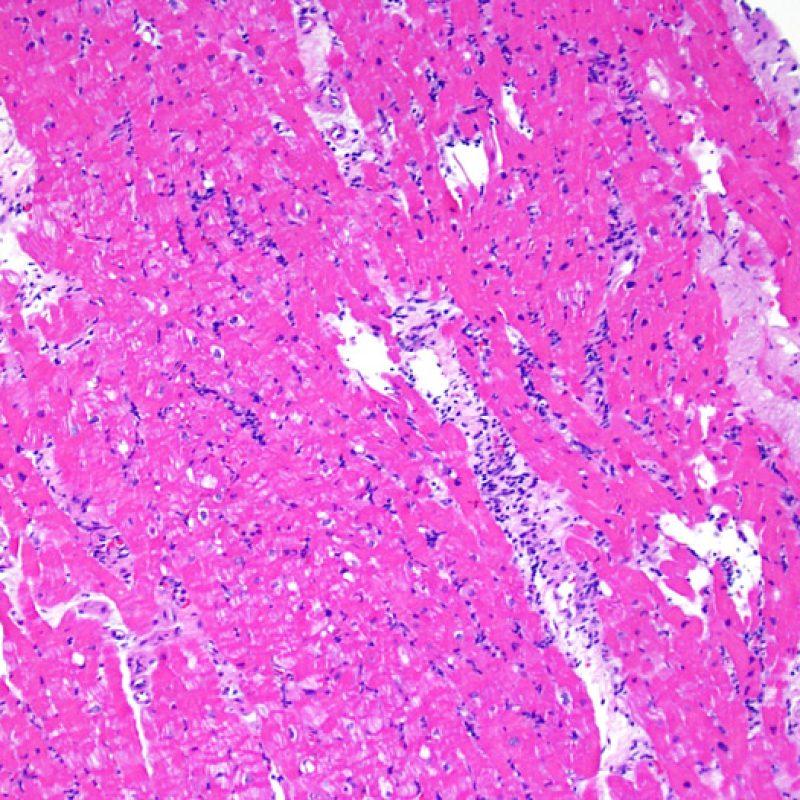
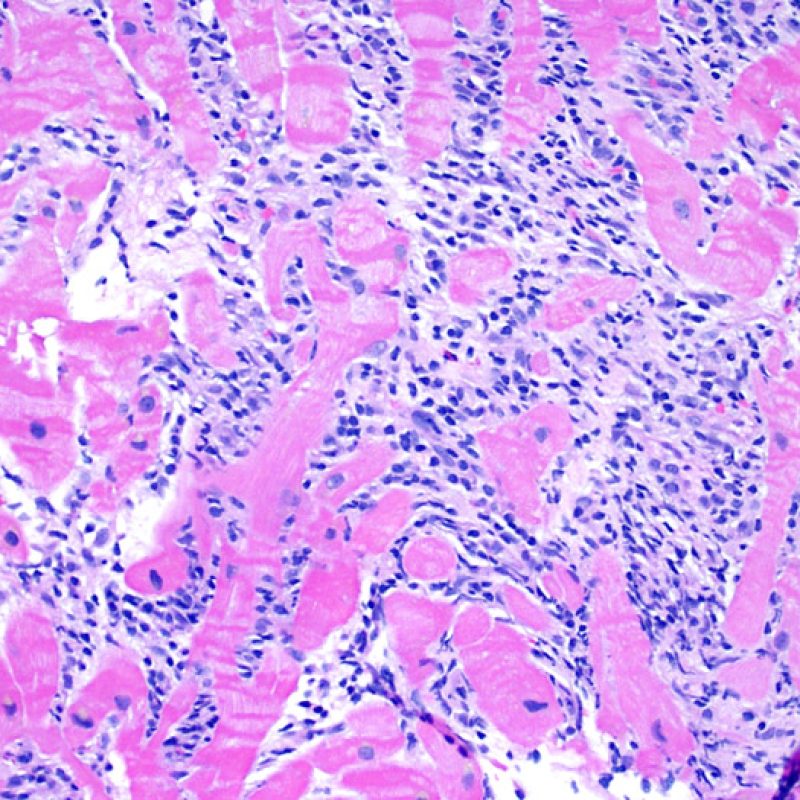
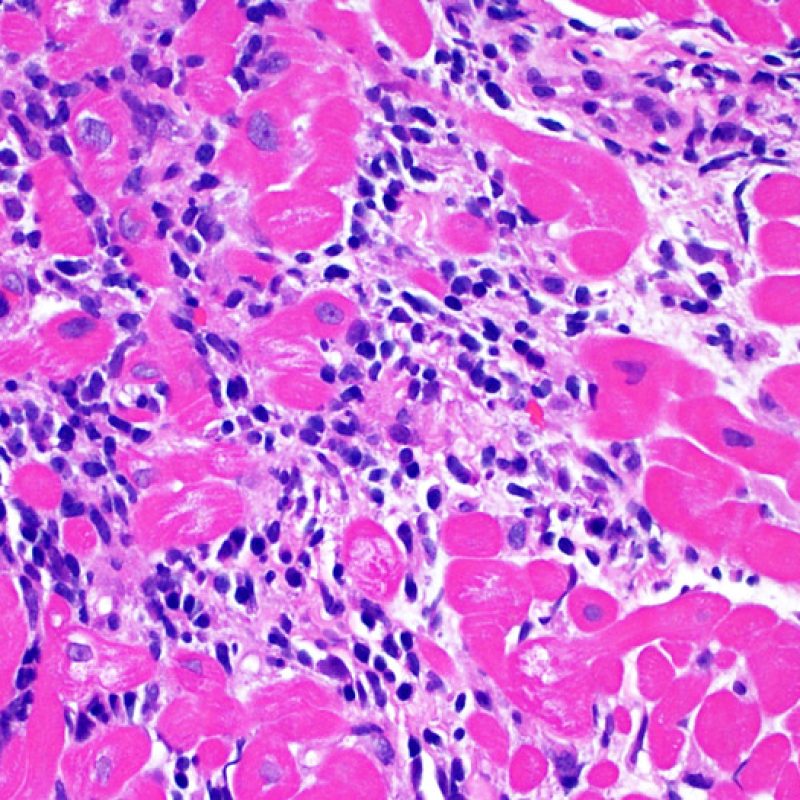
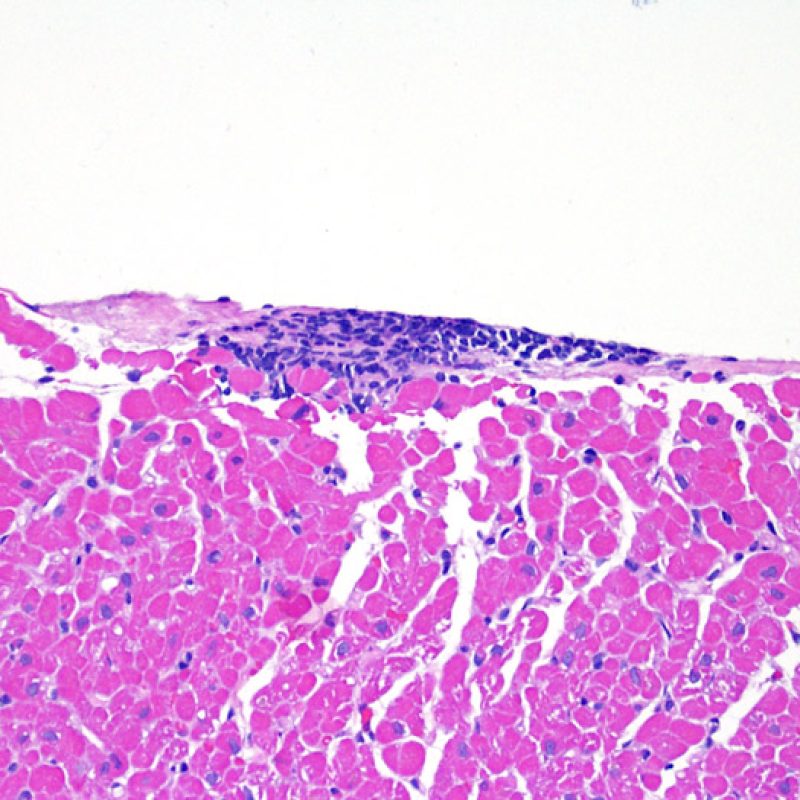
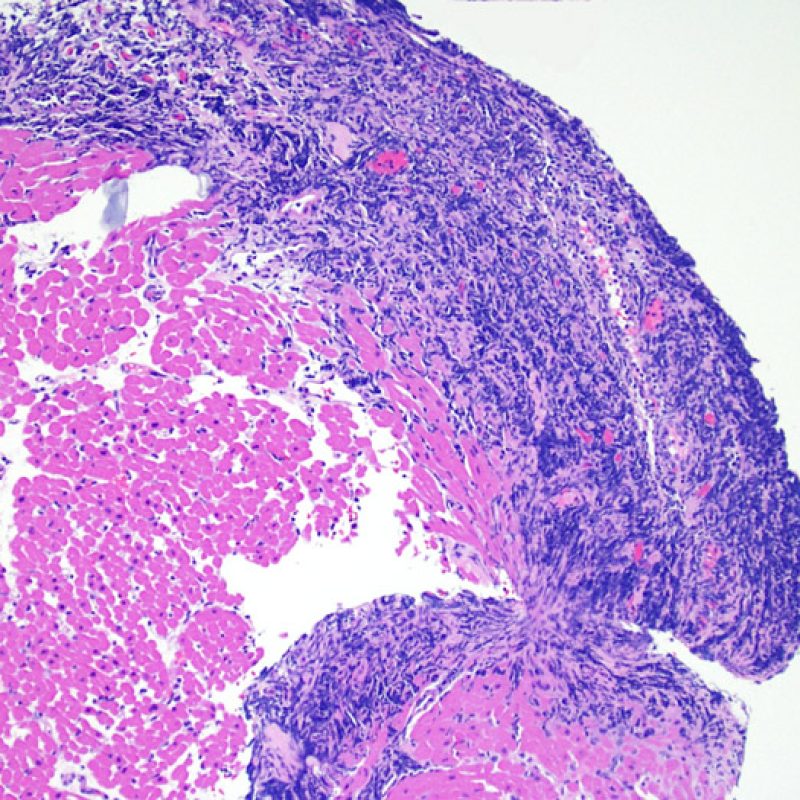
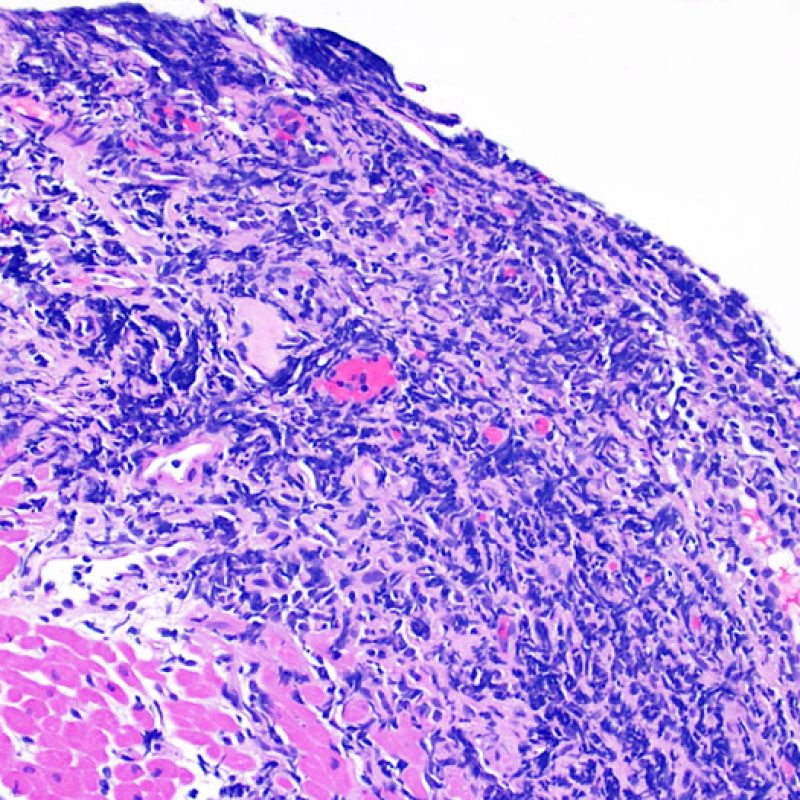
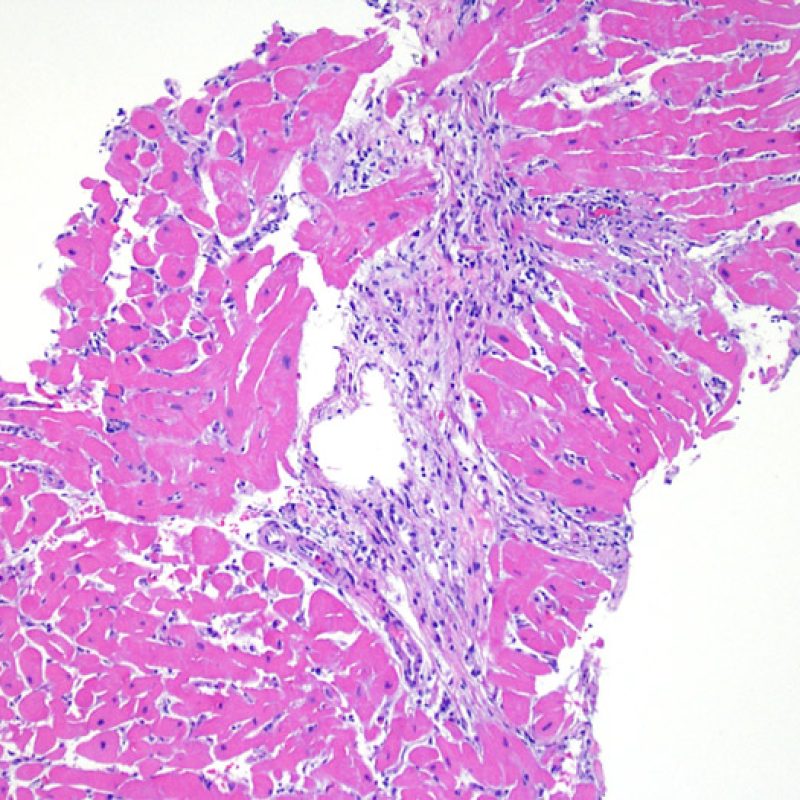
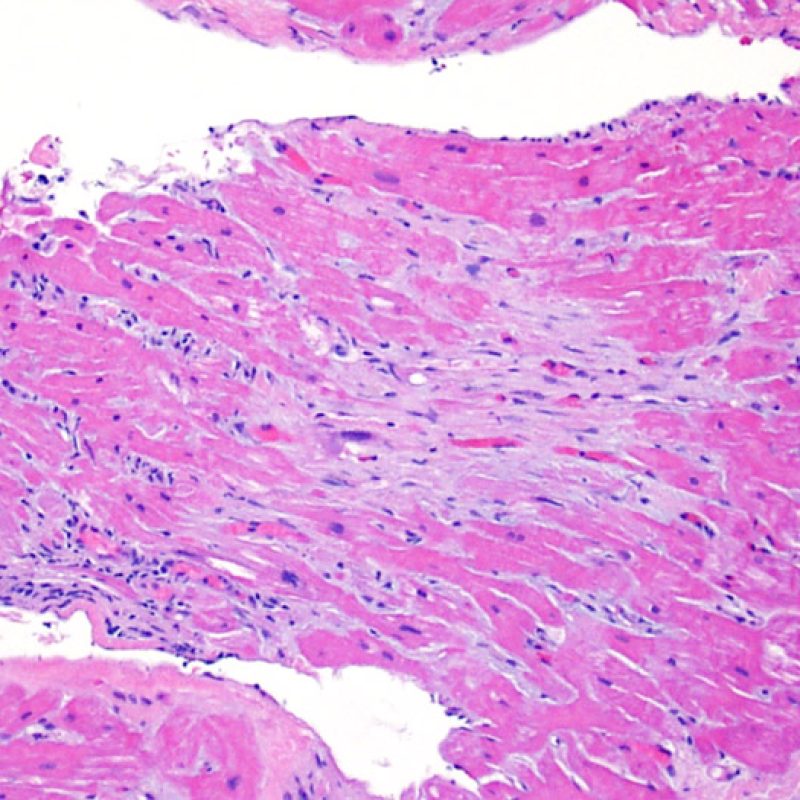
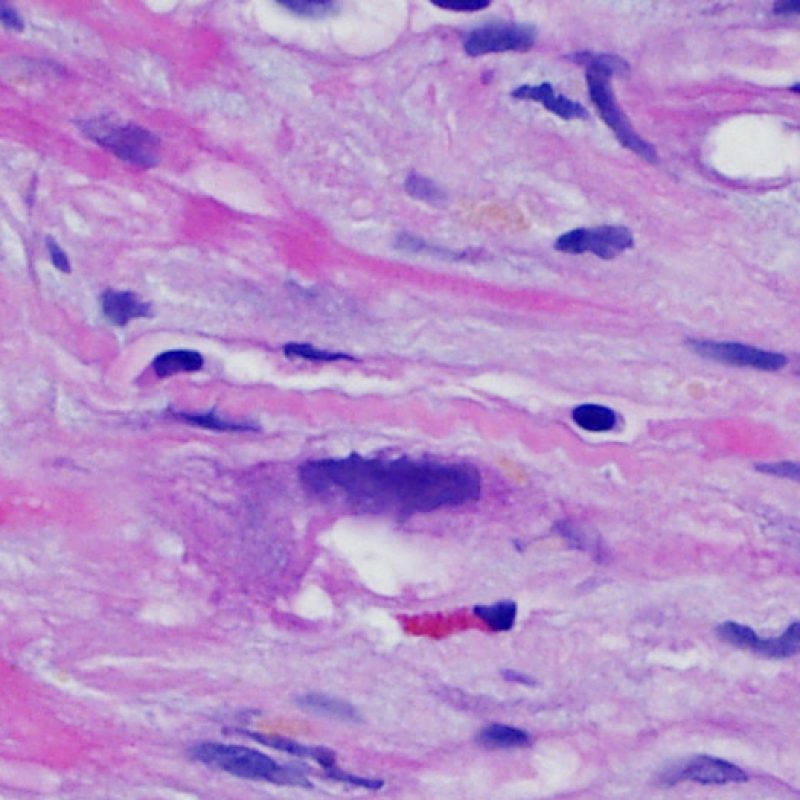
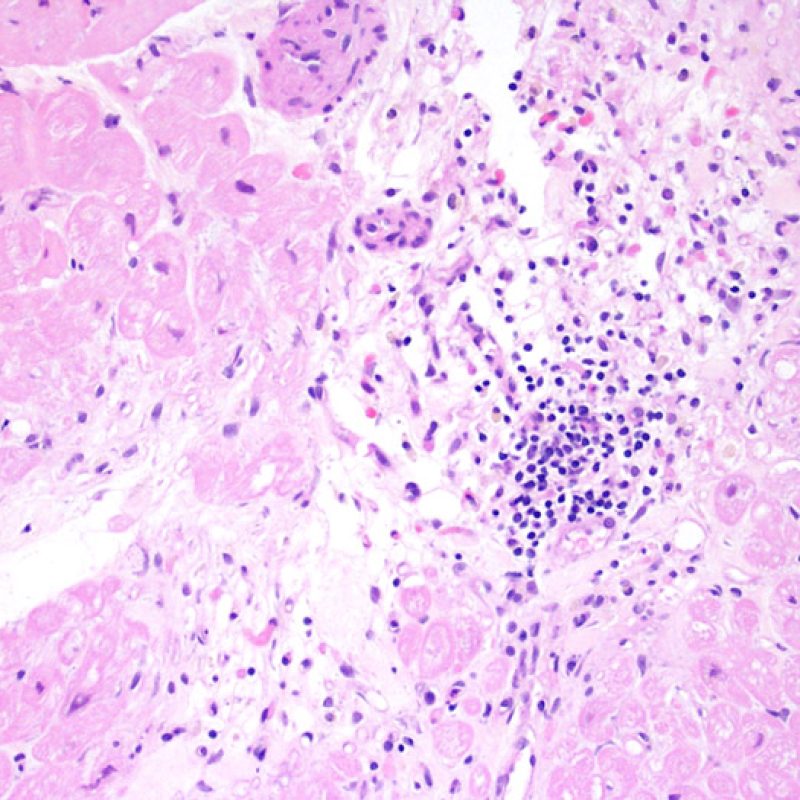
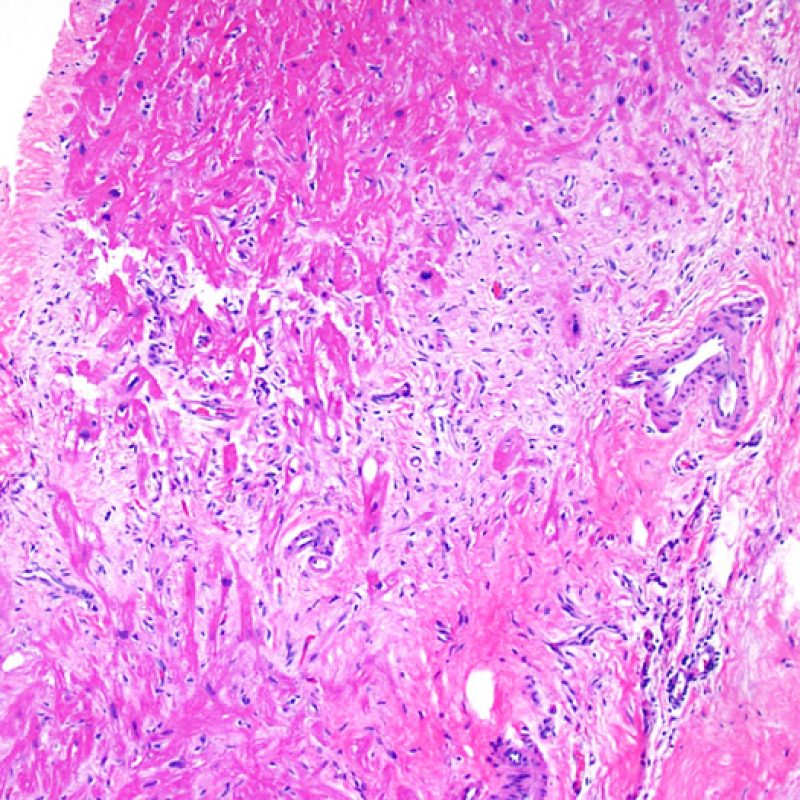
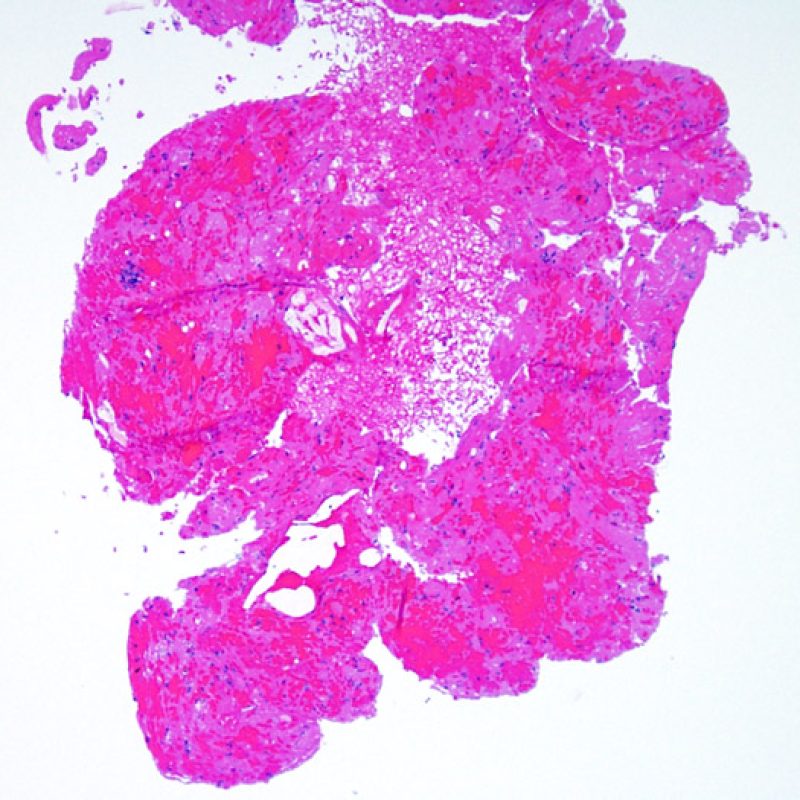
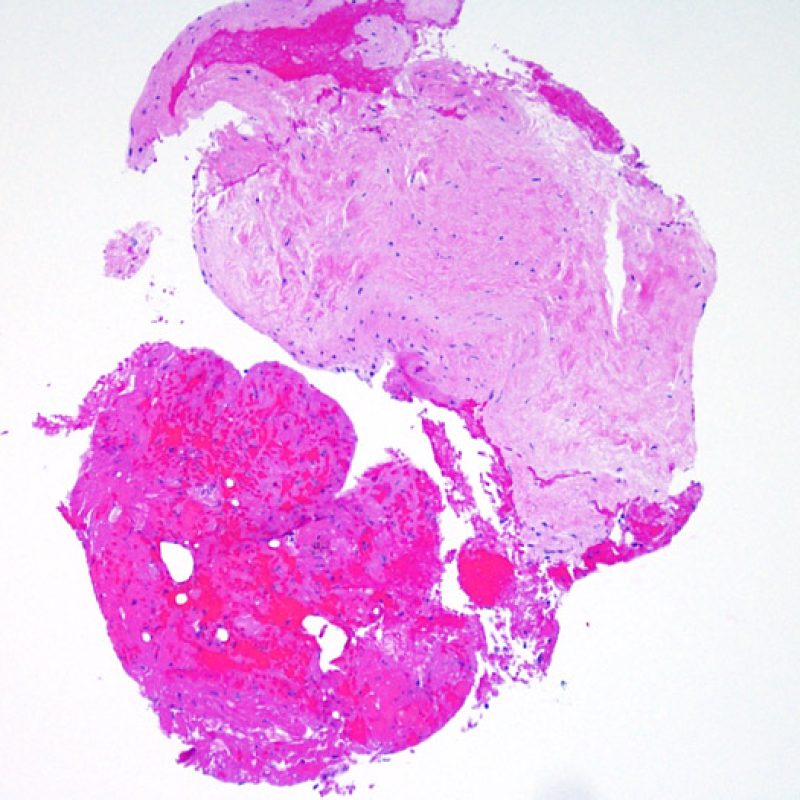
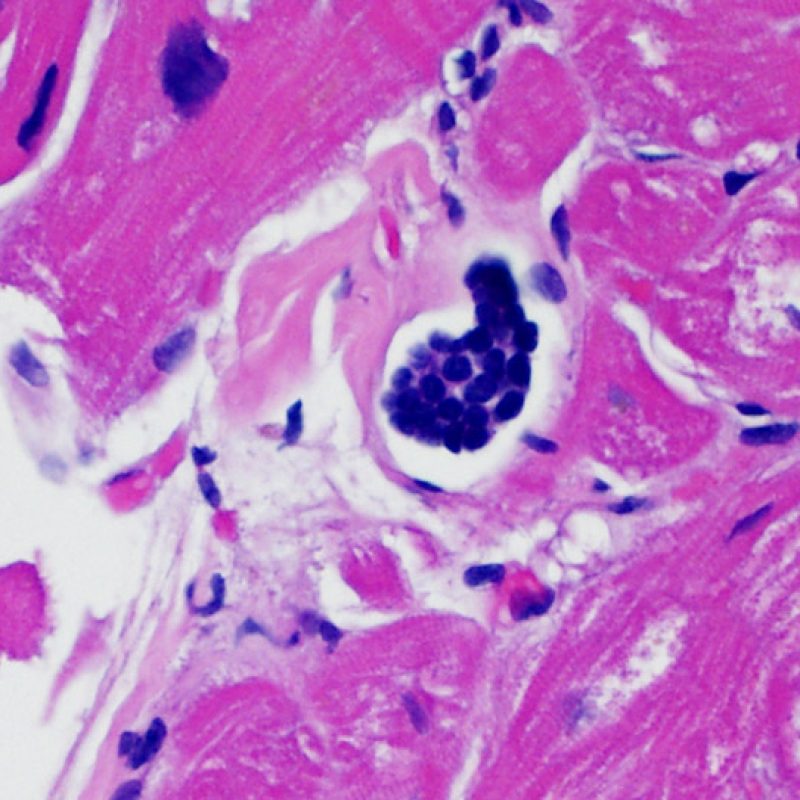
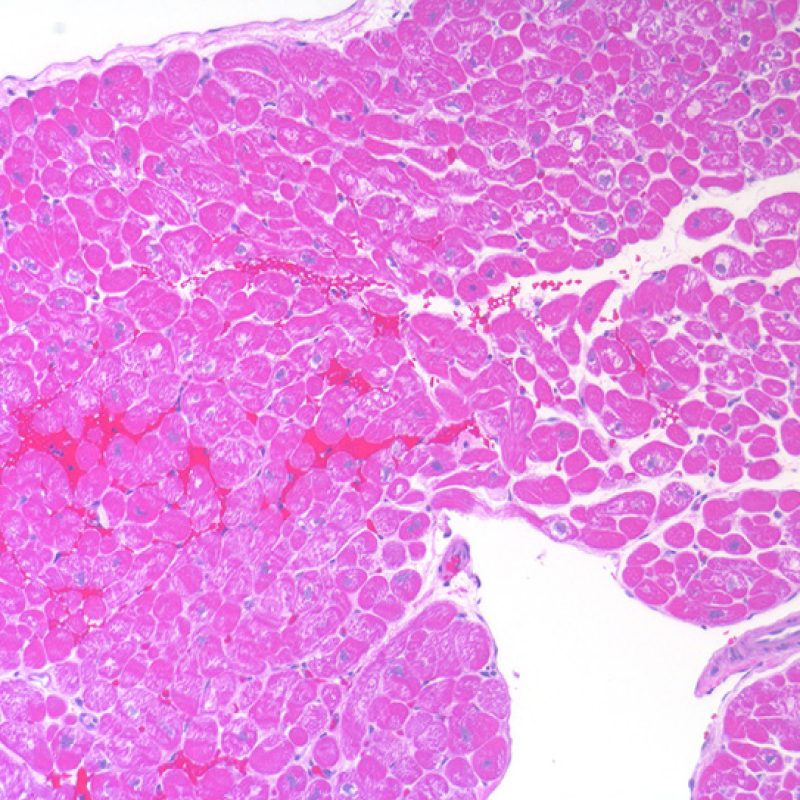
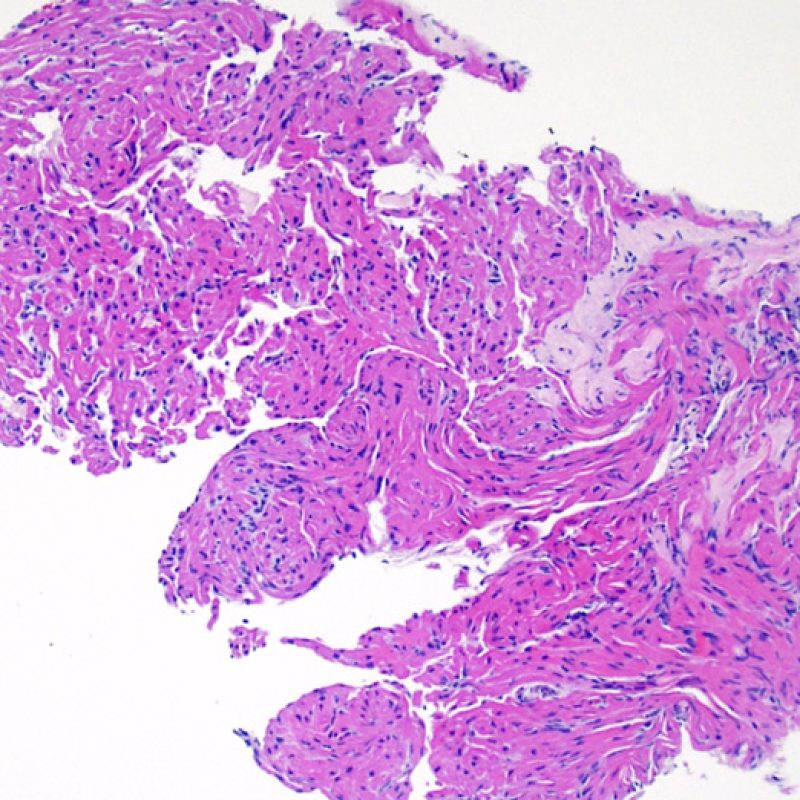
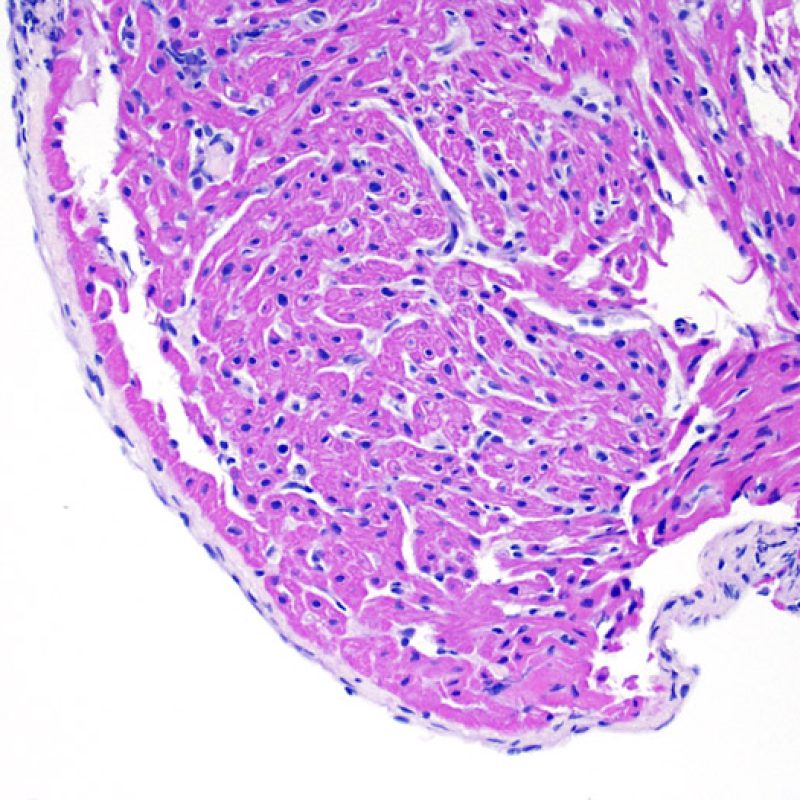
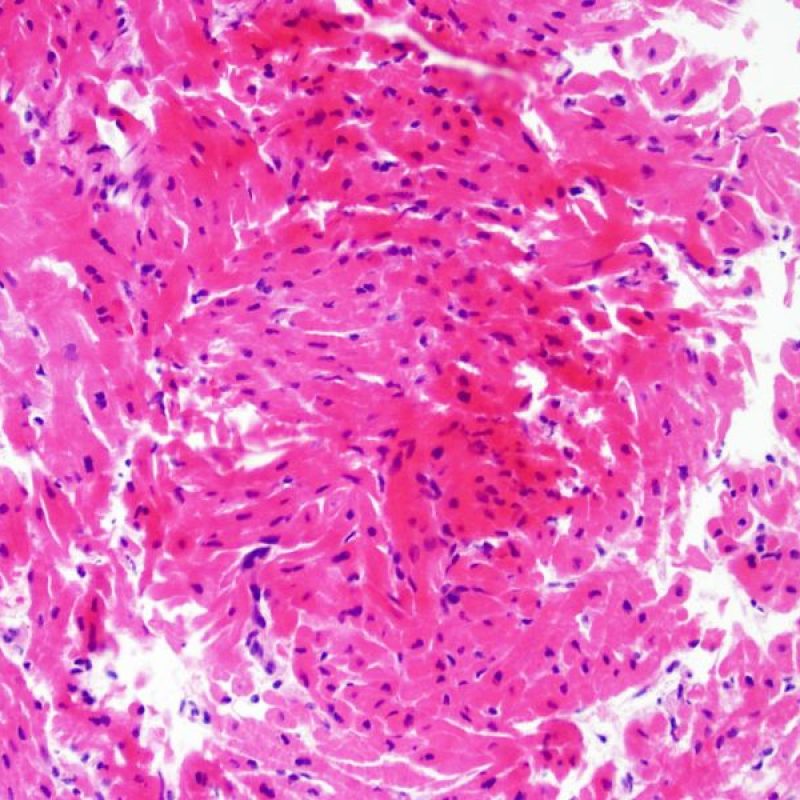
Presentation Generale
Bienvenue dans le tutoriel du site web de la Society for Cardiovascular Pathology (SCVP) et de l’Association for the European Cardiovascular Pathology (AECVP), dédié à l’interprétation des biopsies endomyocardiques du transplant cardiaque en cas de rejet cellulaire. Le but de ce tutoriel est de transmettre aux pathologistes les informations nécessaires et la méthodologie pour évaluer les lésions histopathologiques observées sur ces biopsies.
Ce tutoriel comprend 7 sections illustrant tous les aspects de la biopsie myocardique. Le menu de gauche permet d’accéder directement à la section d’intérêt. Toutes les images peuvent être agrandies en cliquant dessus (cliquer dessus pour les refermer). Un quiz d’auto-évaluation avec des lames virtuelles de cas réels est disponible pour vous permettre de valider vos connaissances sur le rejet cellulaire et sur les autres lésions répertoriées.
Ce tutoriel a été réalisé en deux étapes selon un procédé de création et d’édition de documents. Les membres de ce comité, mentionnés dans l’onglet remerciements sont responsables du contenu. Un tutoriel sur le rejet humoral (RH) est en cours de préparation et devrait être disponible prochainement.
La biopsie endomyocardique
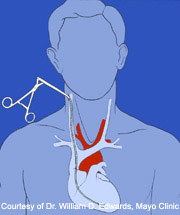
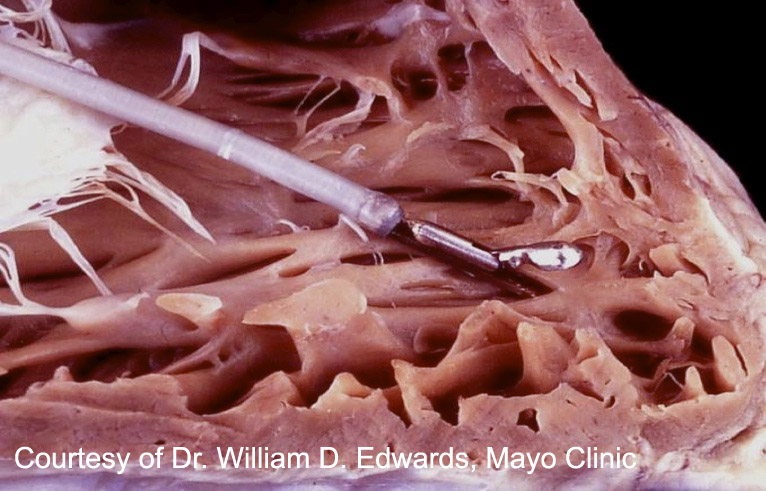
La biopsie endomyocardique (BEM) est une procédure clinique validée permettant d’obtenir du tissu myocardique. Elle est habituellement effectuée sous anesthésie locale en introduisant une pince à biopsie (schéma) par la veine jugulaire interne droite jusqu’au ventricule droit en traversant la valve tricuspide. L’échantillonnage est réalisé le long du septum interventriculaire, généralement sous contrôle fluoroscopique (plus rarement échocardiographique).
L’indication la plus fréquente et validée de la BEM est la surveillance du greffon pour dépister un rejet de greffe de type cellulaire et/ou de type humoral. Ce procédé est actuellement la seule méthode fiable de diagnostic de rejet cardiaque. Les protocoles de surveillance, propres à chaque centre de transplantation, comportent généralement plusieurs biopsies dans les premiers mois de transplantation, puis un nombre qui se réduit au fil des années selon les pratiques des divers centres.

Comment réaliser une biopsie ?
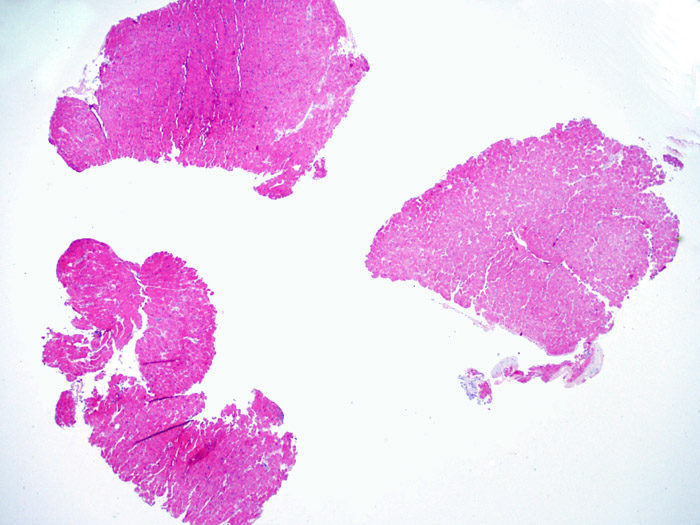
Nombre de prélèvements à effectuer: L’International Society for Heart and Lung Transplantation (ISHLT) recommande un minimum de 3 prélèvements du ventricule droit pour pouvoir évaluer le rejet de façon fiable. Cependant, il a été montré que la réalisation de 5 biopsies en améliorait la sensibilité. Ces prélèvements doivent être recueillis indépendamment ; ils ne doivent pas être recoupés une fois prélevés pour en augmenter le nombre total.
Manipulation du prélèvement: L’équipe de cardiologie doit retirer le tissu myocardique de la pince à biopsie avec une aiguille et le déposer sur une compresse imbibée d’une solution saline isotonique. La biopsie doit être manipulée le moins possible et ne doit pas être touchée avec la pince.
Traitement des prélèvements: Pour évaluer le rejet, le matériel biopsique doit être immédiatement conservé dans du formol tamponné neutre à 10%. Le prélèvement peut être ensuite inclus en paraffine, coupé et coloré (coloration standard H&E) selon les protocoles du laboratoire. Selon les laboratoires, une étude par immunofluorescence peut être une aide au diagnostic de rejet humoral. Dans ce cas, un prélèvement supplémentaire doit être congelé pour réaliser cette technique.
Réalisation des lames: La plupart des laboratoires réalisent 3 ou 4 lames avec au moins trois coupes de 3 à 5 µm par lame, colorées par le H&E. Certains laboratoires mettent 8 coupes par lame. Indépendamment du nombre de lames utilisées, un point important est d’examiner au moins 10 sections pour pouvoir évaluer correctement le rejet.
Etudes ancillaires: Pour aider au diagnostic de rejet humoral, des techniques complémentaires par immunofluorescence ou par immunohistochimie peuvent être utilisées pour mettre en évidence un dépôt de C4d. D’autres marqueurs comme le CD68 (marqueur histiocytaire) ou le C3d peuvent être également utilisés en routine par certains centres. Le rejet humoral sera largement traité dans un autre tutoriel.
Critères d'interprétabilité
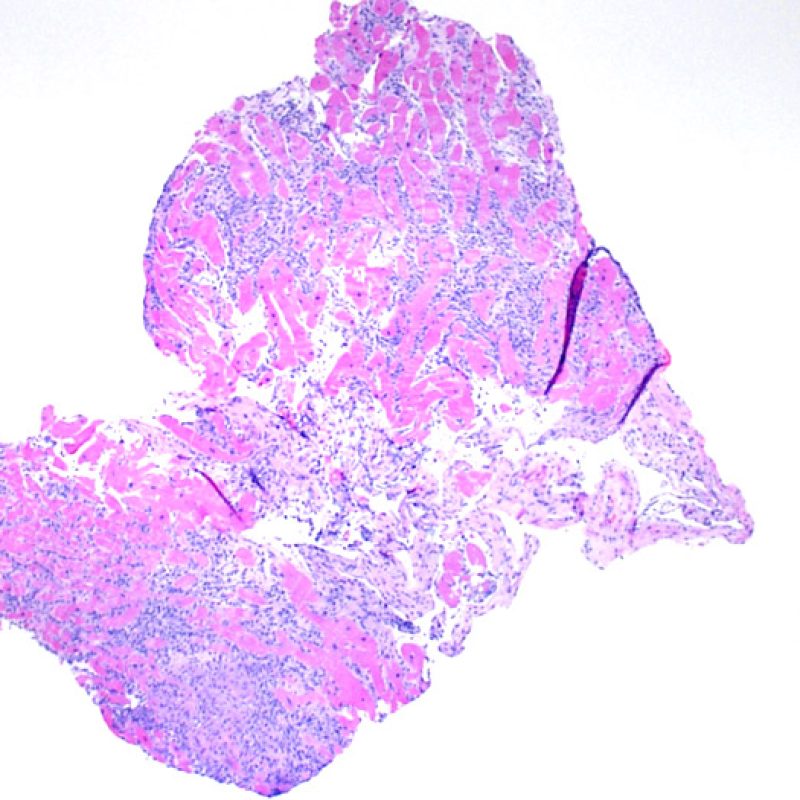
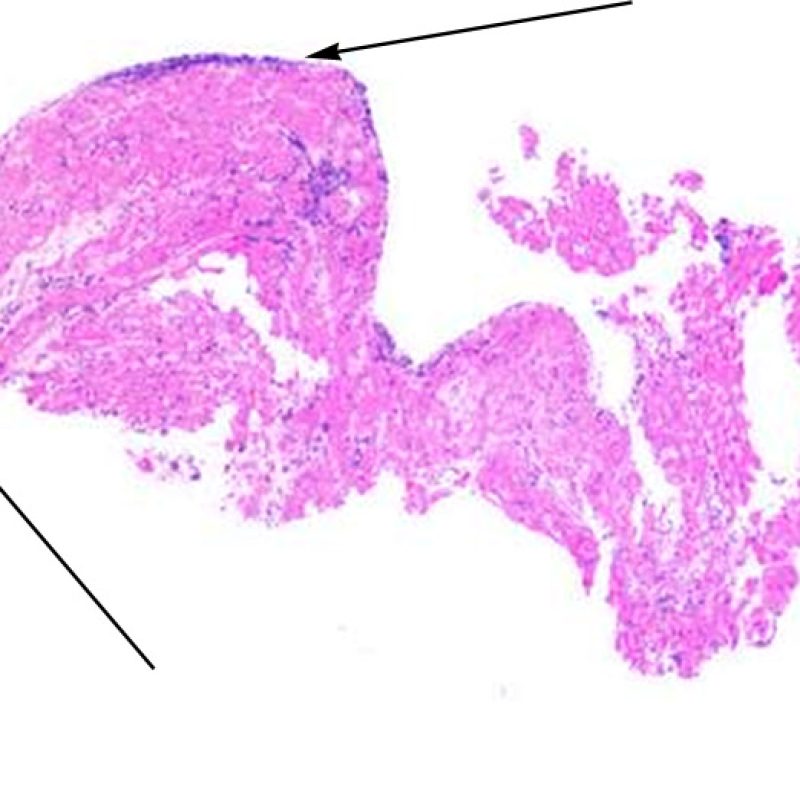
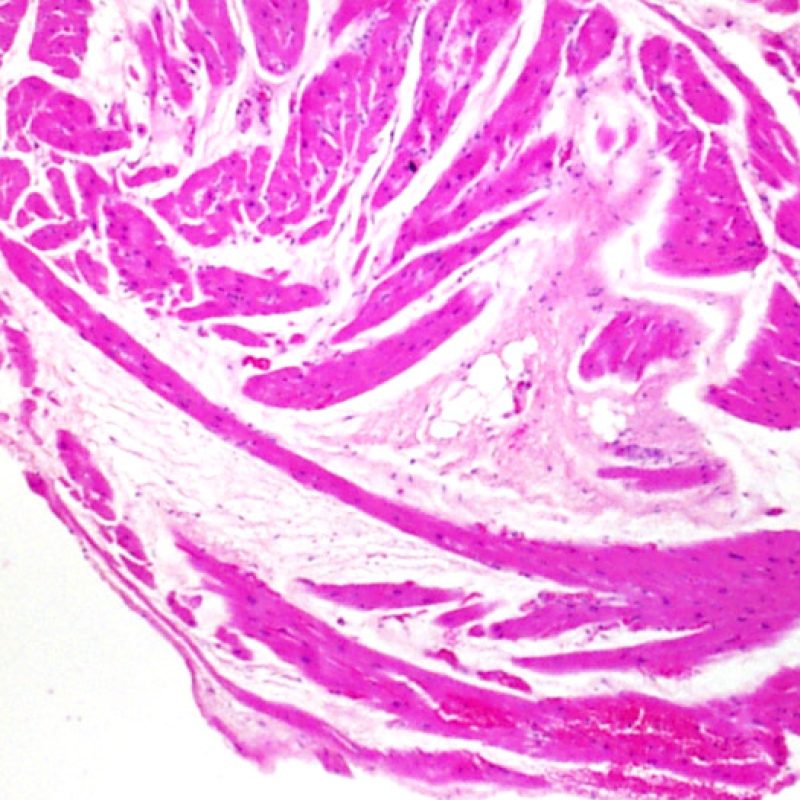
Un prélèvement est jugé interprétable s’il comprend au moins 3 biopsies et que chaque biopsie soit constituée par au moins 50% de myocarde. Si le matériel semble insuffisant, il convient de s’assurer que le bloc ait été correctement entamé. Les patients transplantés ont souvent des biopsies itératives. Pour des raisons mécaniques, la pince à biopsie a tendance à prélever la même région du ventricule. Il faut également savoir qu’il n’est pas rare d’observer des zones fibreuses, infiltrées de graisse et/ou un tissu de granulation ou cicatriciel, secondaire à une biopsie antérieure. Les cardiologues entrainés se familiarisent avec la couleur et la texture des biopsies et peuvent différencier le myocarde d’un thrombus ou d’une cicatrice.
Que faire d’une biopsie inadéquate ?
- Evaluer le rejet (rejet cellulaire ou humoral) et le mentionner indépendamment de la taille du prélèvement.
- Si le prélèvement ne remplit pas les critères d’interprétabilité et ne montre pas de signe de rejet, un commentaire doit mentionner la non-représentativité du prélèvement et la possibilité de faux négatif.

Transmission des résultats
Afin de transmettre les informations utiles au clinicien (souvent le cardiologue), le compte-rendu anatomo-pathologique doit être concis et standardisé. En complément du diagnostic de rejet, le compte-rendu complet peut mentionner le nombre de prélèvements examinés (ainsi que le nombre avec un rejet), la présence de lésions de Quilty, de signes d’infection ou d’ischémie.
Un modèle de compte-rendu anatomopathologique est disponible ici.

Critères de gradation
Ce chapitre du tutoriel définit les critères de gradation révisés de l’International Society for Heart and Lung Transplantation (ISHLT).
Présentation générale
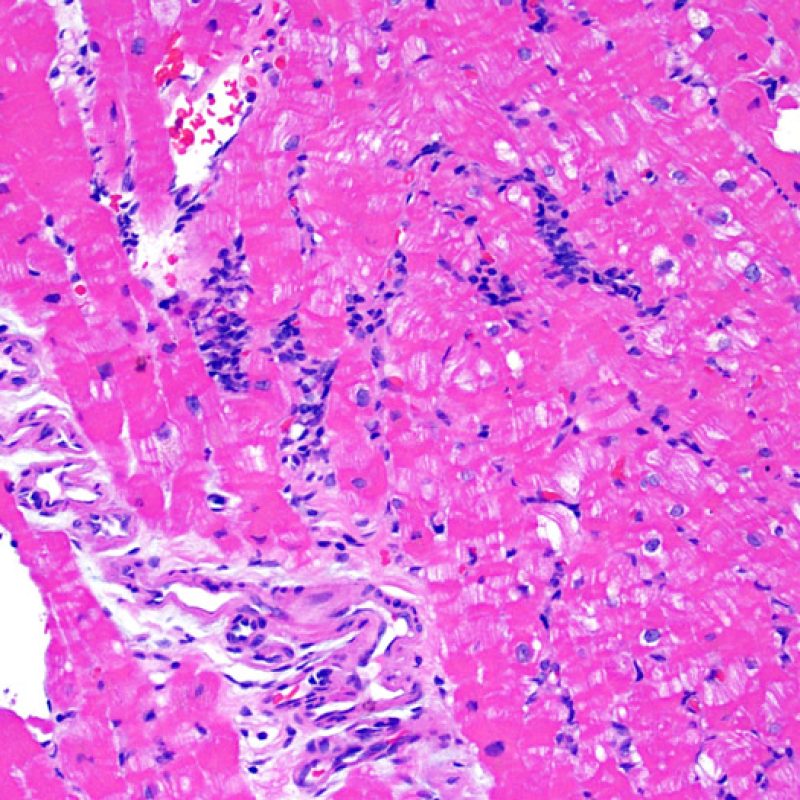
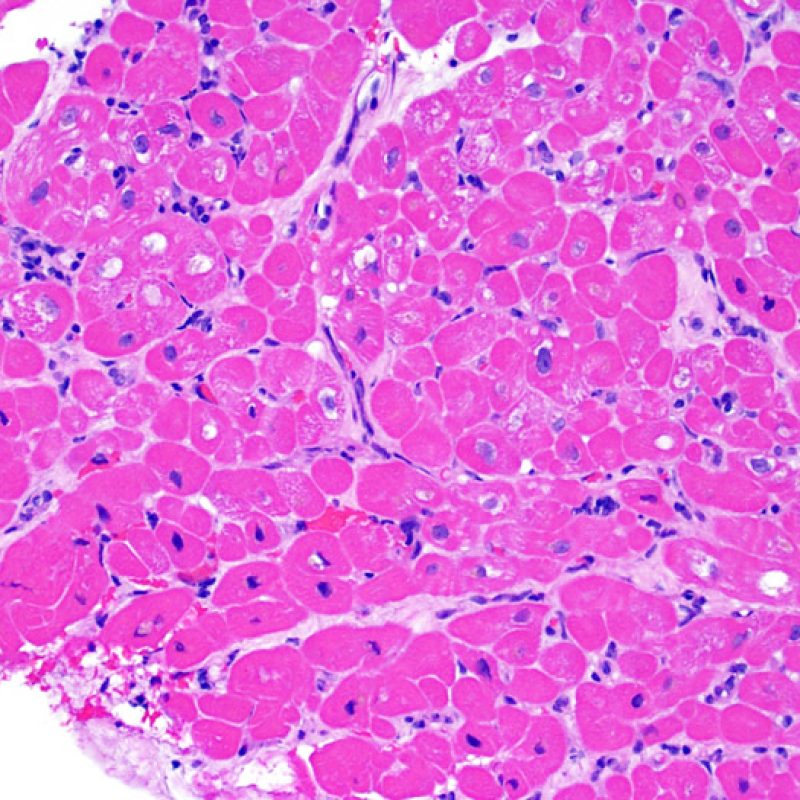
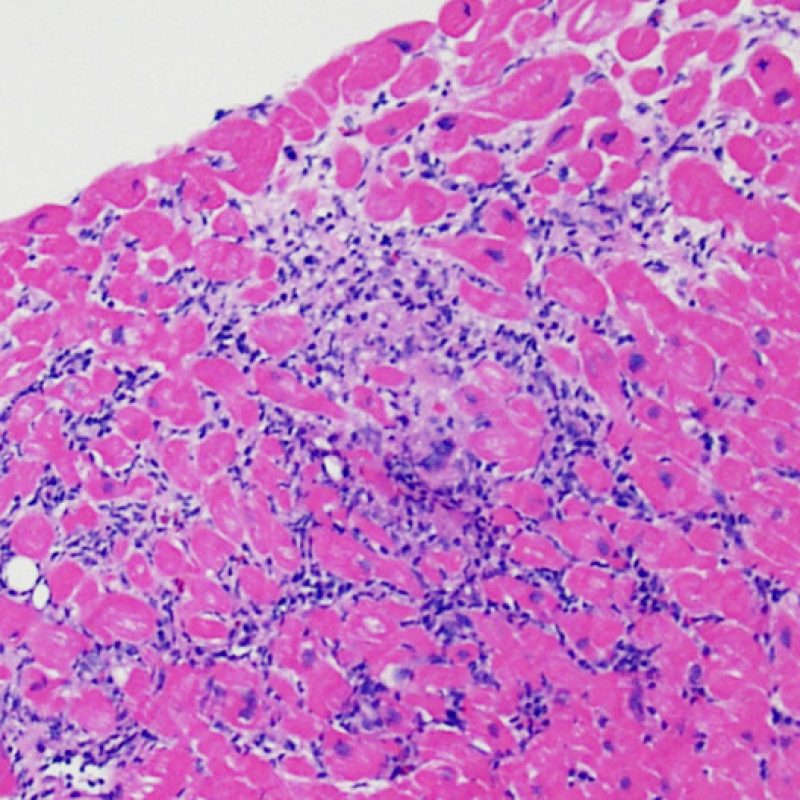
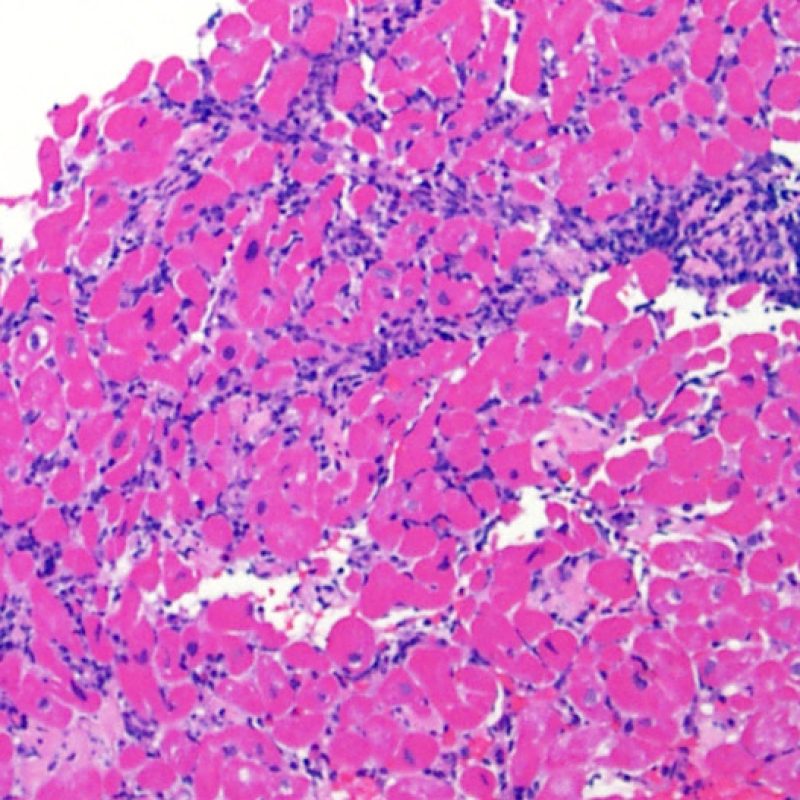
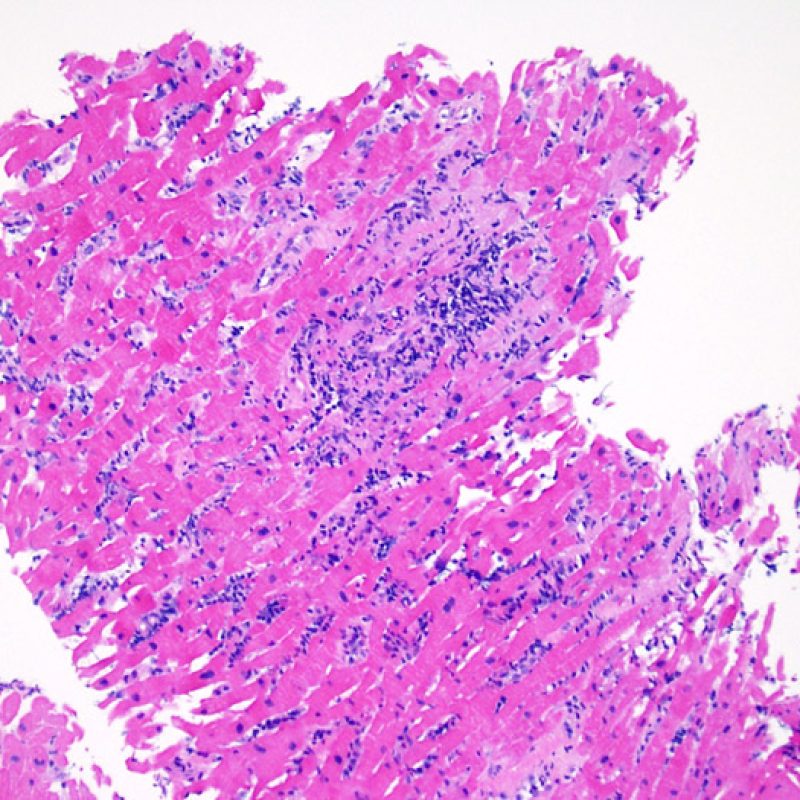
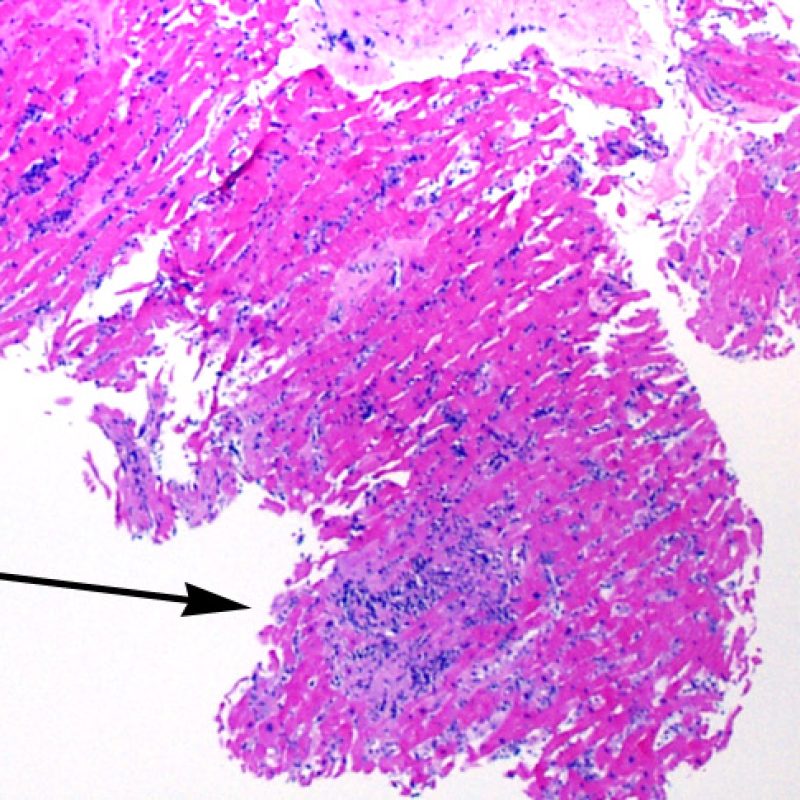
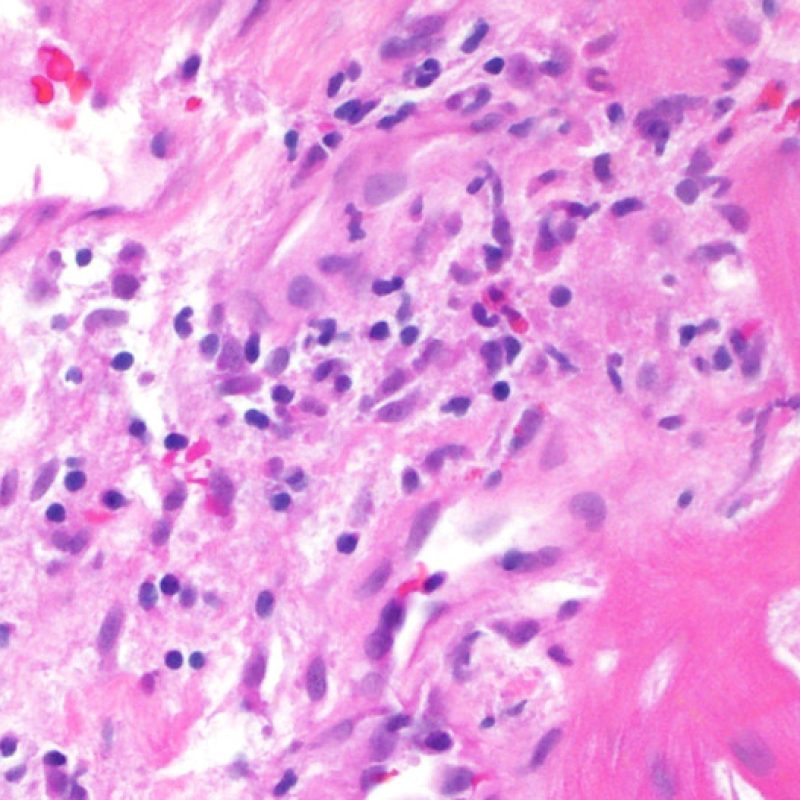
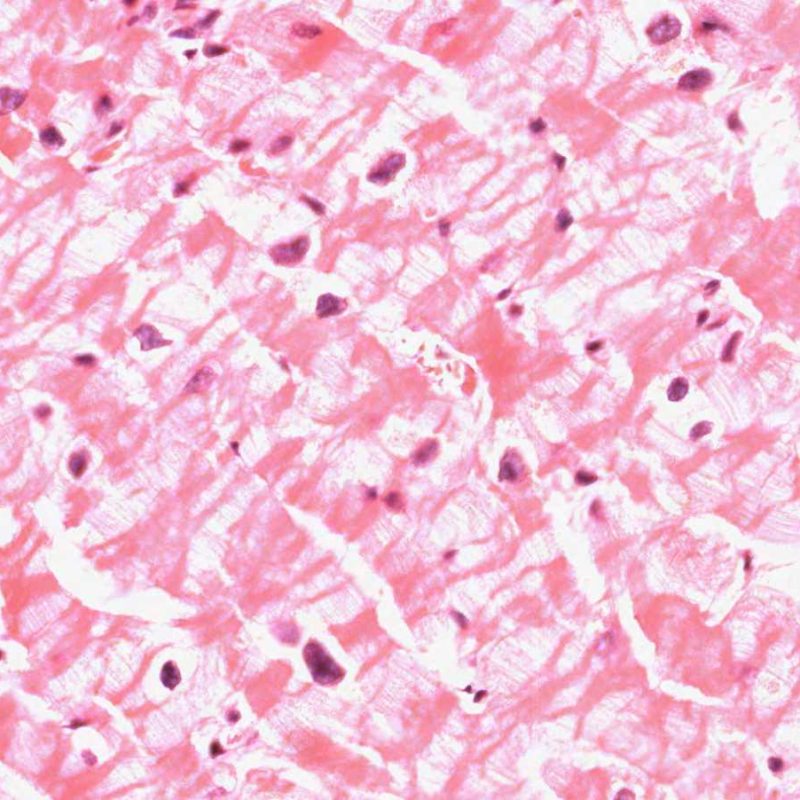
En 1990, l’ISHLT a développé une méthode de gradation pour définir le rejet aigu cellulaire sur des biopsies endomyocardiques. Ces critères de gradation ont été modifiés en 2004 et sont parfois appelés ISHLT-2004. Ces nouveaux critères distinguent 4 niveaux de gradation du rejet (0R, 1R, 2R et 3R). La lettre « R » signifie « Révisé» pour ne pas confondre ces critères avec ceux de l’ISHLT-1990 (0, 1A, 1B, 2, 3A, 3B et 4). Dans la plupart des centres, le grade 0R ou le grade 1R n’entraine pas de modification du traitement ; seuls les grades 2R ou 3R impliquent une augmentation du traitement immunosuppresseur. C’est pourquoi il est très important pour un anatomopathologiste de bien faire la distinction entre des lésions de bas grade (0R et 1R) et celles de haut grade (2R et 3R).

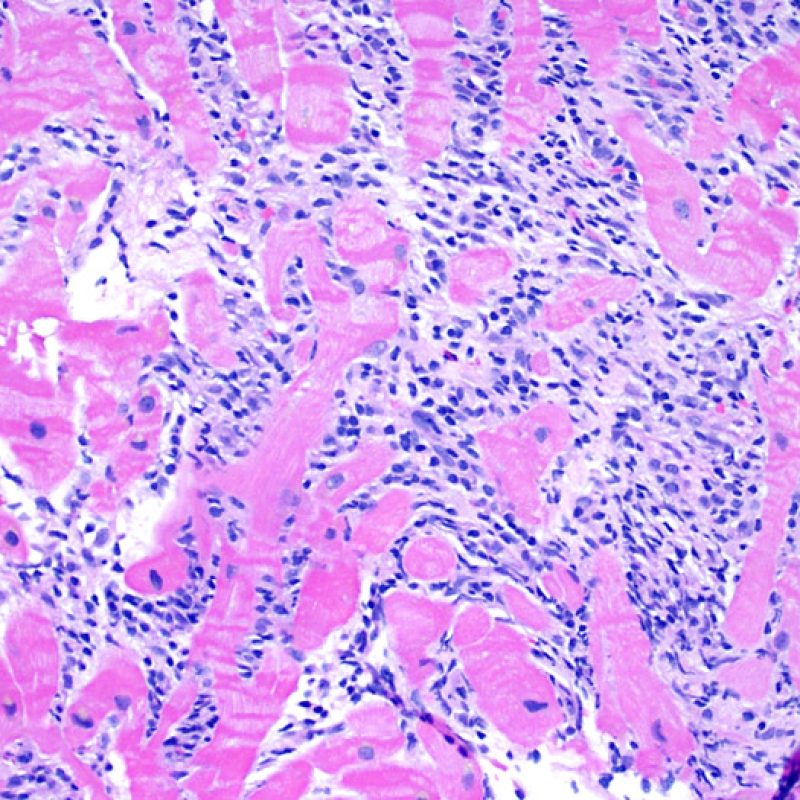
Les deux éléments clés du rejet aigu cellulaire sont la présence de lymphocytes et de lésions myocytaires. Des lésions artéfactuelles ou des lésions en rapport avec d’autres pathologies peuvent parfois mimer des lésions de rejet. Il est important de remarquer qu’une bonne interprétation du rejet dans une biopsie endomyocardique repose essentiellement sur l’évaluation de deux caractéristiques : l’infiltrat et la lésion myocytaire.
Absence de rejet (0R)
L’absence de tout infiltrat lymphocytaire est synonyme de « pas d’argument pour un rejet cellulaire » grade 0R. Ceci correspond la plupart du temps à une biopsie intéressant un myocarde sous-endocardique sans particularité. Il peut exister parallèlement des lésions autres comme un effet Quilty ou à des modifications du site biopsique, sur l’une de ces biopsies : celles -ci peuvent être mentionnées séparément et ne doivent pas majorer le grade de rejet.
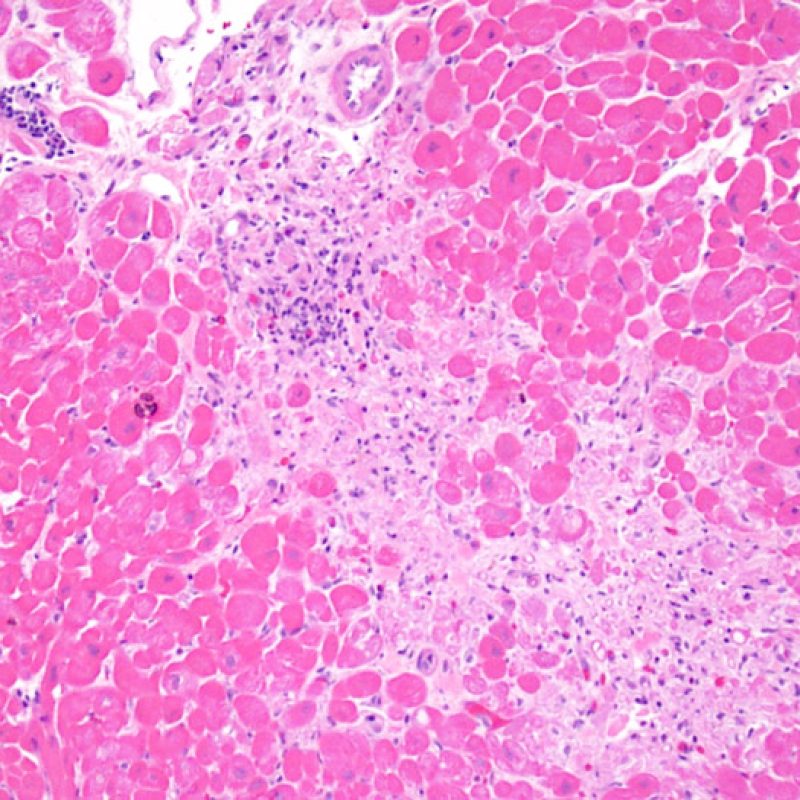
Rejet léger (1R)
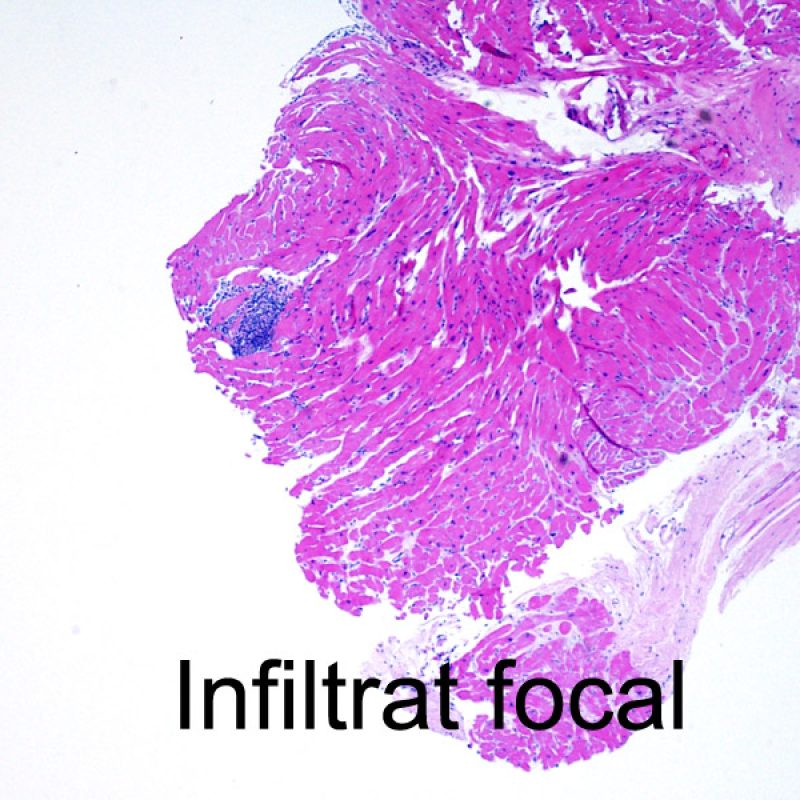
Le rejet léger (1R) est défini par un infiltrat interstitiel et/ou périvasculaire avec au maximum un foyer unique de lésion myocytaire. Comme cette définition ne précise ni le nombre ni la topographie des lymphocytes, cette catégorie pourra inclure des biopsies d’aspect très divers. En effet, l’infiltrat peut se restreindre à quelques lymphocytes périvasculaires mais peut correspondre à un infiltrat lymphocytaire extensif. L’étendue de l’infiltrat peut être semblable à l’étendue de l’infiltrat d’une lésion 2R à condition que cet infiltrat n’ait pas occasionné plus d’un foyer de lésion myocytaire. En général, les polynucléaires éosinophiles ou neutrophiles sont absents des biopsies de grade 1R. Les biopsies avec un seul foyer de lésion myocytaire sont d’interprétation particulièrement difficile et posent les problèmes suivants : 1) n’a-t-on pas trouvé qu’un seul foyer de lésion myocytaire du fait d’une biopsie tout juste interprétable? 2) cette lésion myocytaire s’intègre-t-elle dans un effet Quilty? Il est souvent utile de discuter avec le clinicien quand une biopsie qui répond aux critères du grade 1R est particulièrement cellulaire ou ne présente qu’un seul foyer de lésion myocytaire.
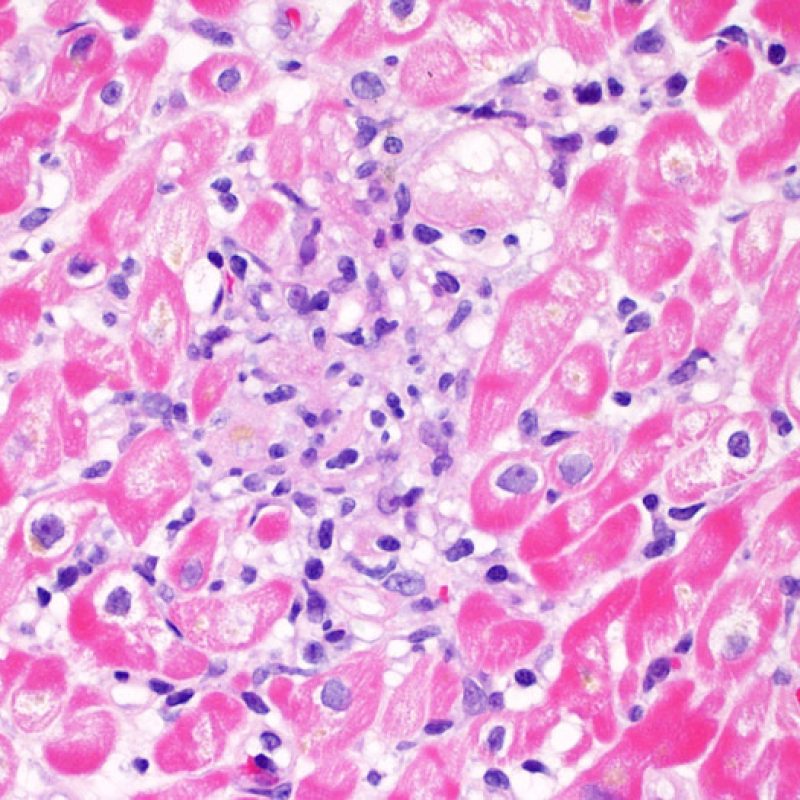
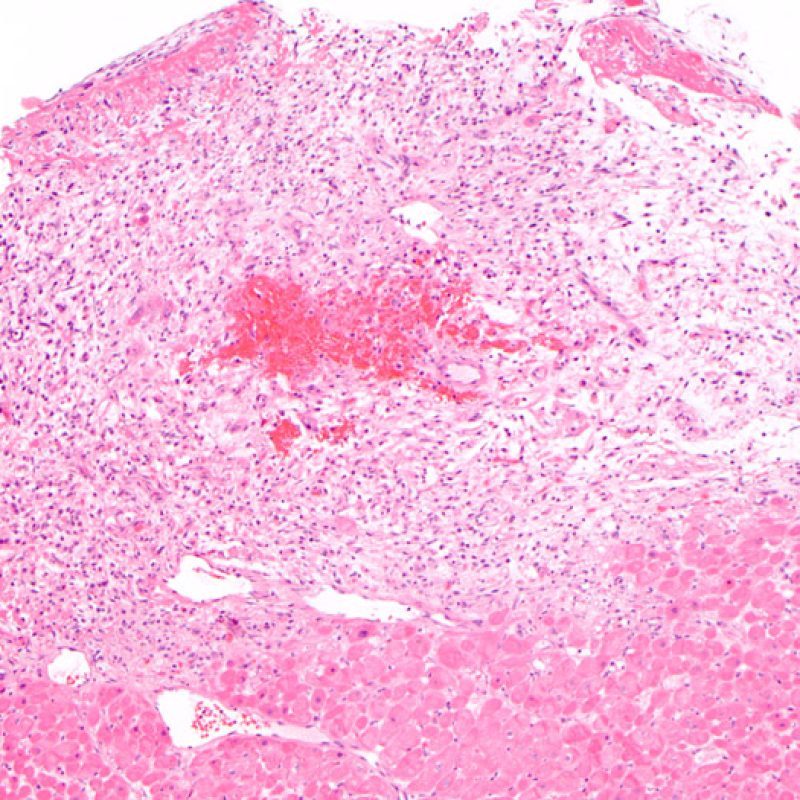
Rejet modéré (2R)
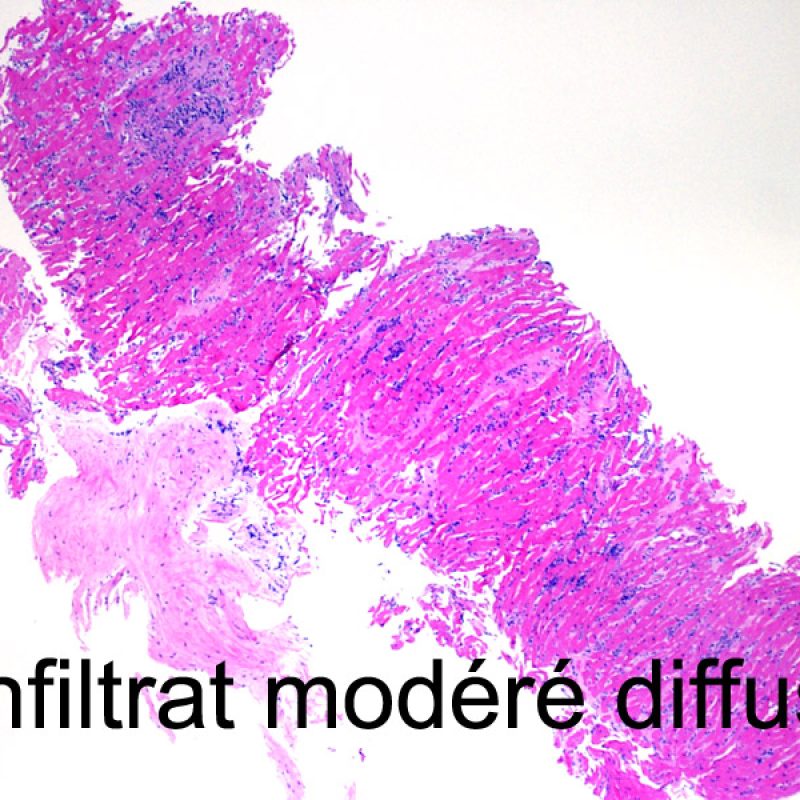
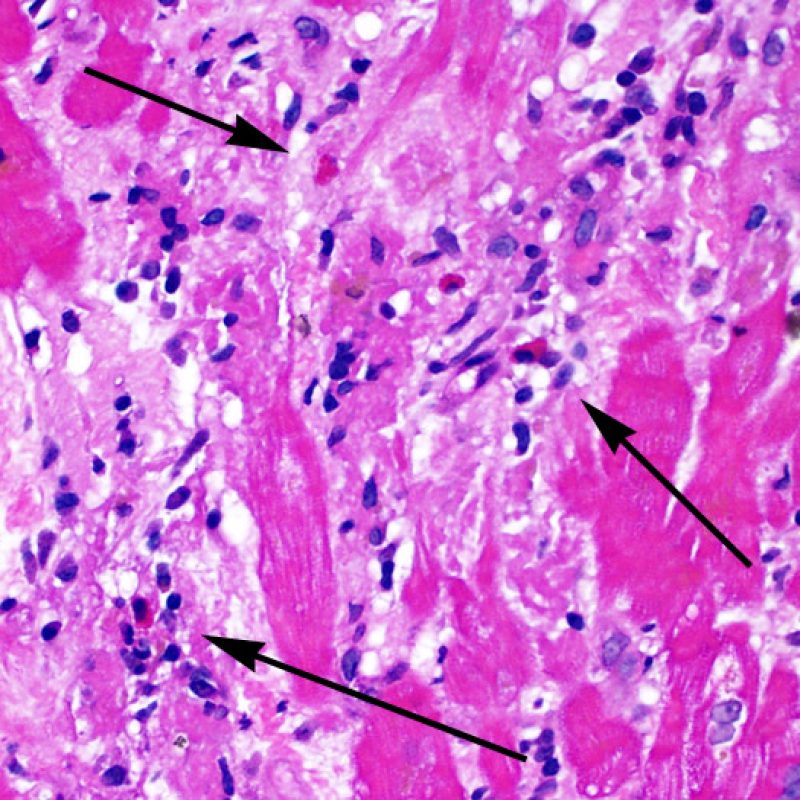
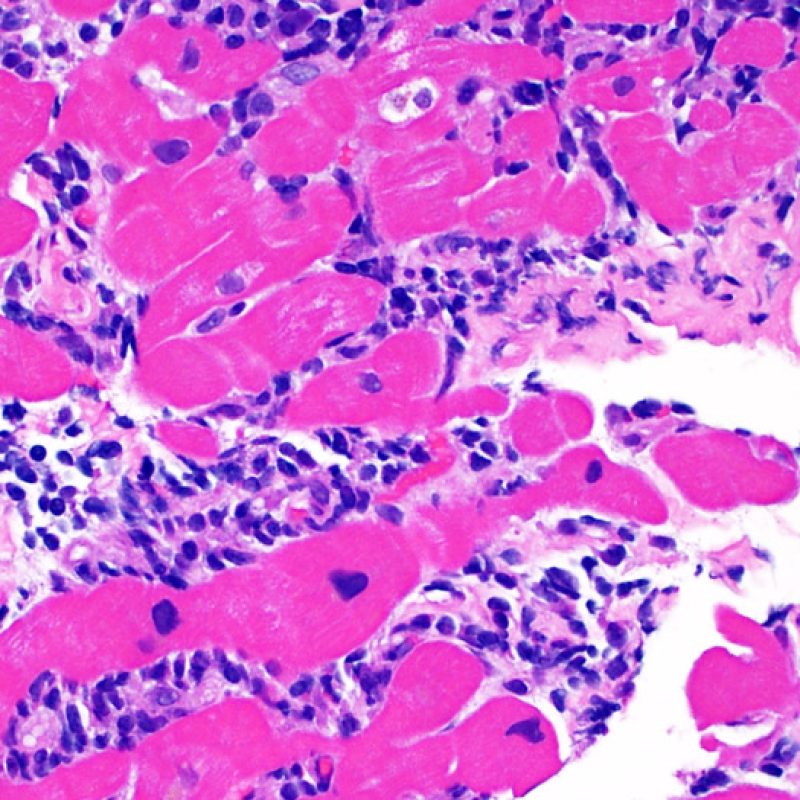
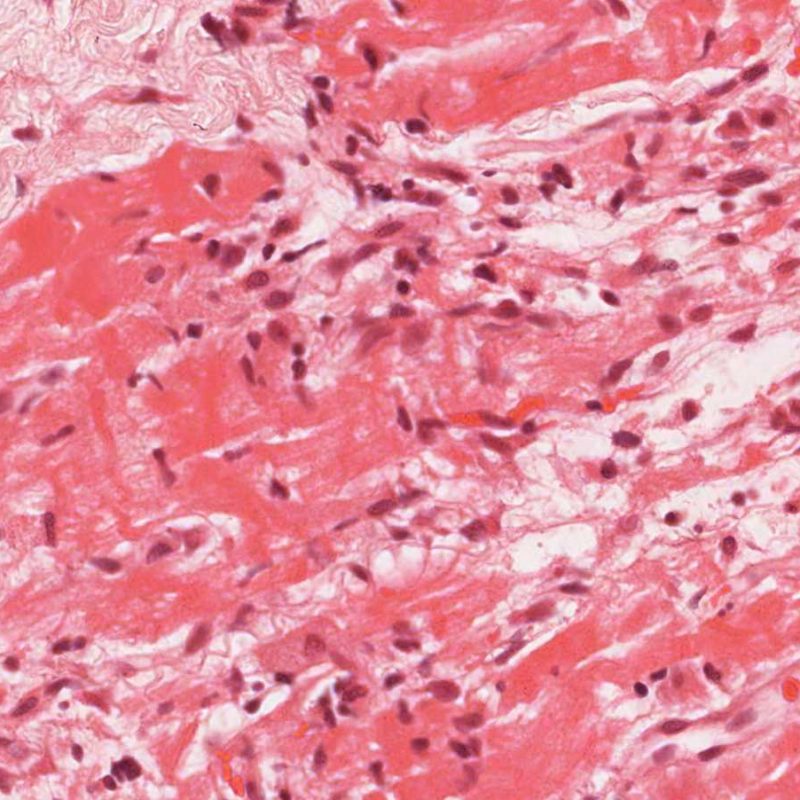
Le rejet modéré (2R) est défini par au moins deux foyers d’infiltrat associés à des lésions myocytaires. Ces foyers peuvent s’observer sur la même biopsie, proches l’un de l’autre ou peuvent se voir sur différents prélèvements, voire à des niveaux différents de coupes. En général, la présence d’au moins deux foyers de lésions myocytaires est associée à un infiltrat cellulaire diffus, d’abondance au moins modérée. En l’absence d’infiltrat diffus, il convient de se demander si les lésions myocytaires ne sont pas surévaluées, en éliminant les lésions confondantes de rejet. Il est important de communiquer au clinicien la présence d’un rejet 2R car sa présence nécessitera un traitement immédiat.
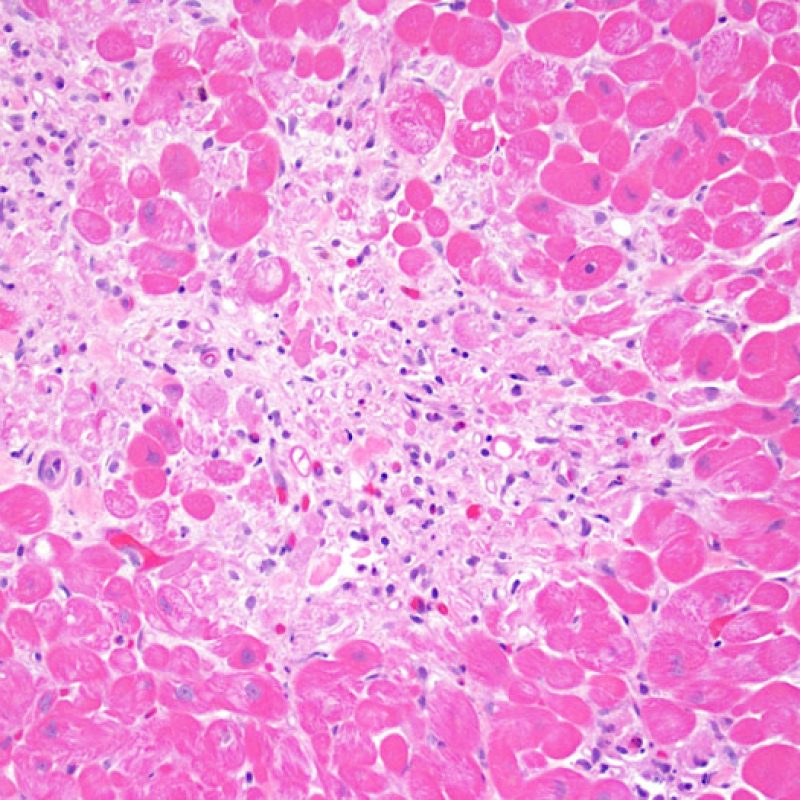
Rejet sévère (3R)
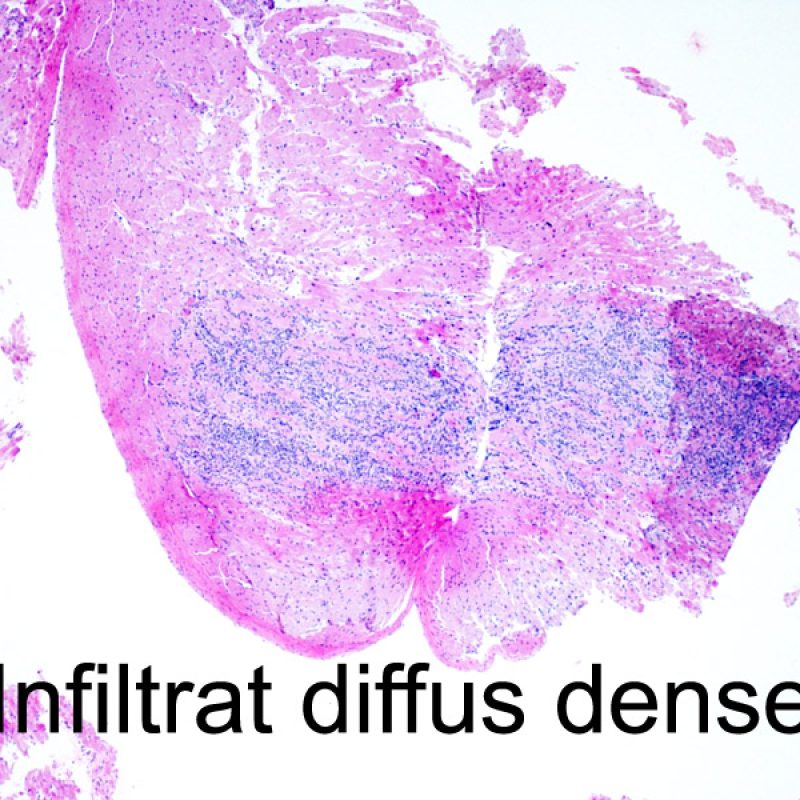
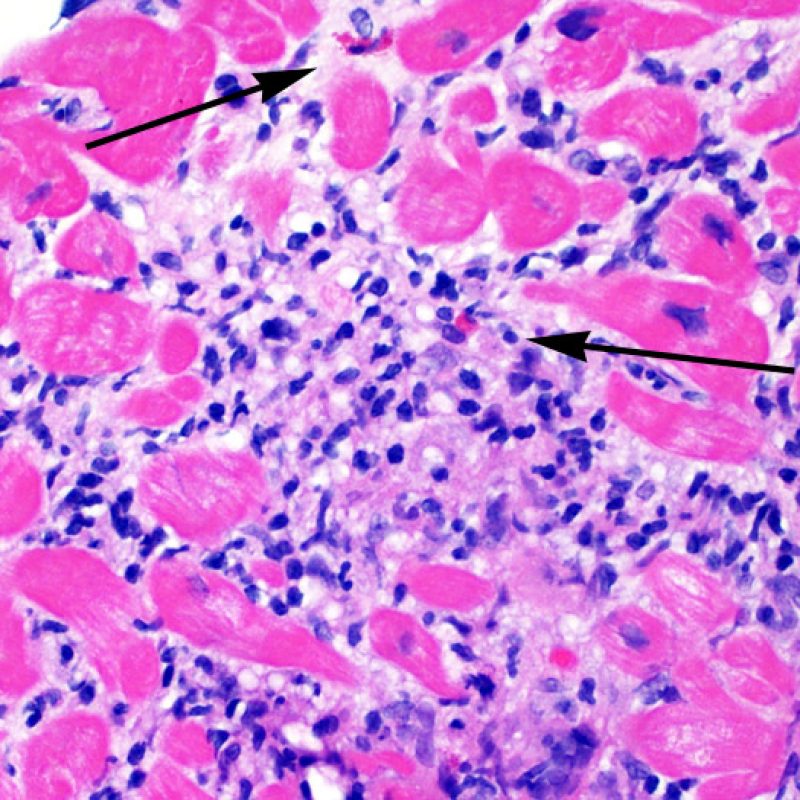
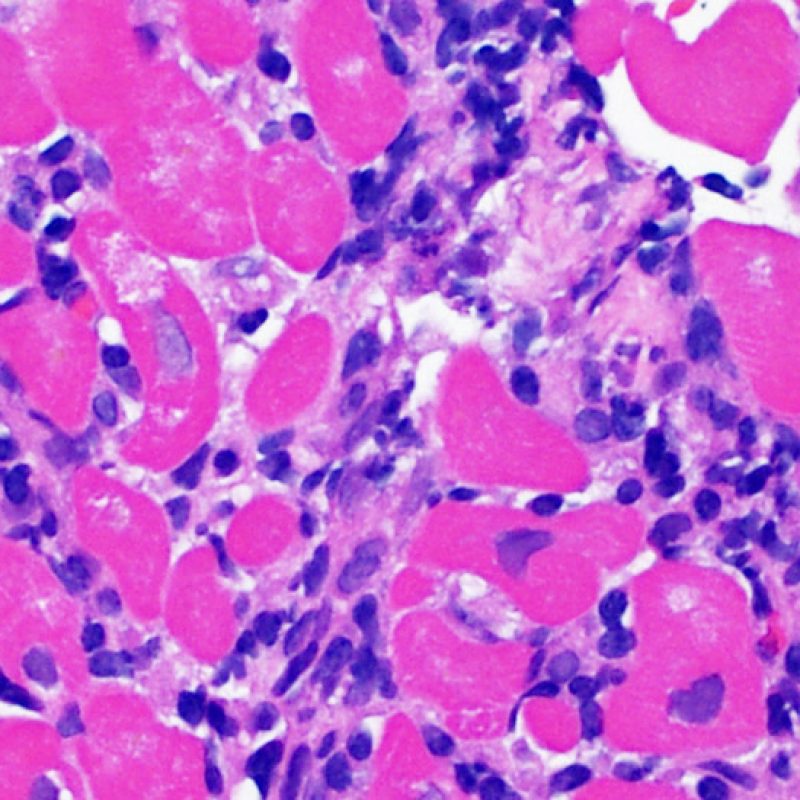
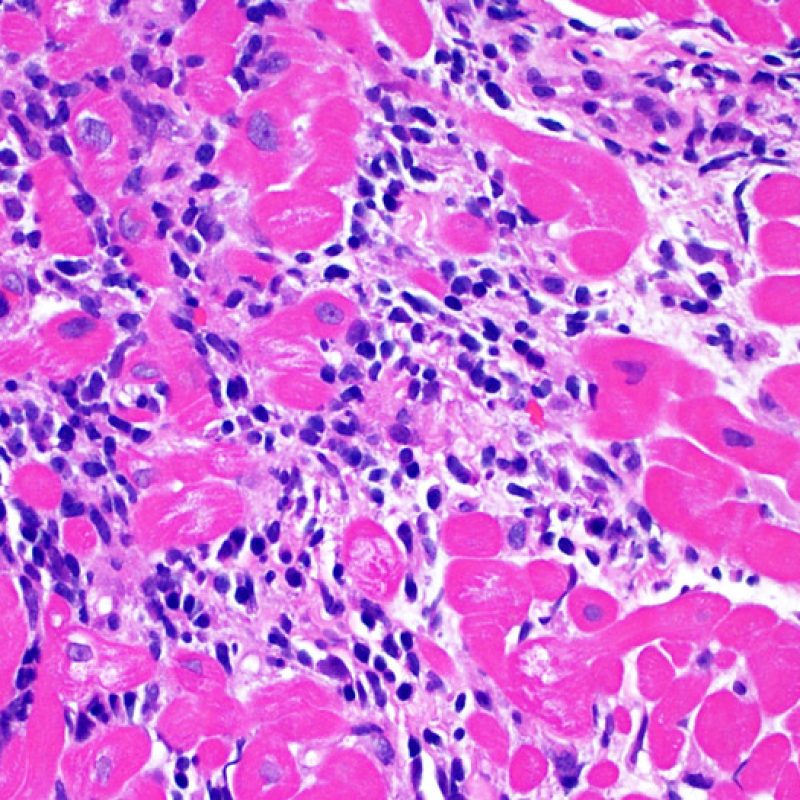
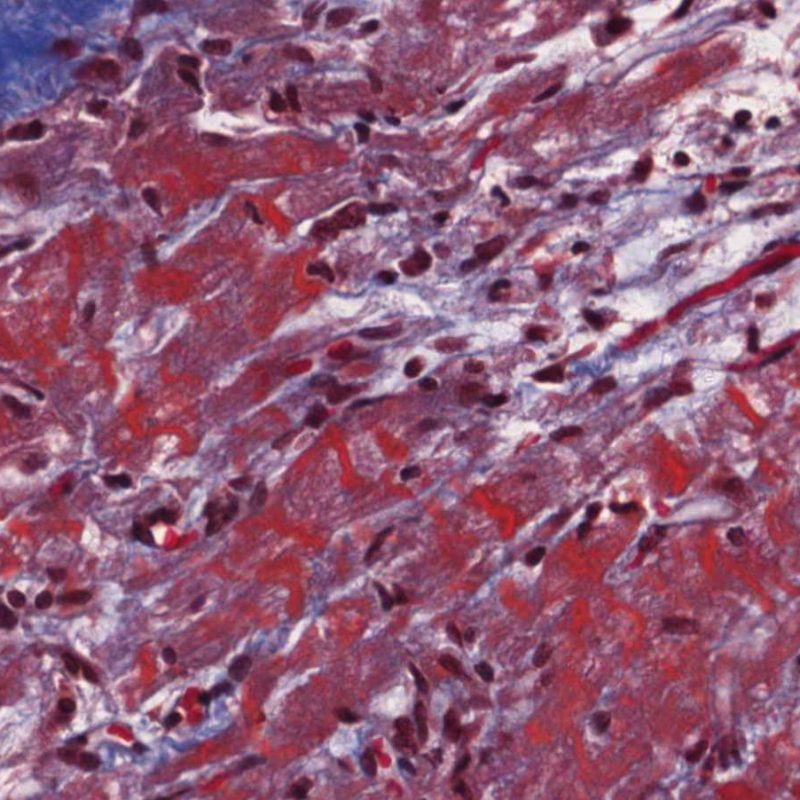
Le rejet sévère (3R) est un processus diffus de lésions myocytaires, sans nette individualisation de foyers lésionnels. Typiquement, on observe de nombreux polynucléaires éosinophiles et quelques polynucléaires neutrophiles. En général, l’infiltrat inflammatoire est très marqué sur toute la biopsie. De l’œdème, des suffusions hémorragiques ou une vascularite peuvent être également observés. Il est rare d’observer un rejet 3R avec les protocoles actuels de traitement sauf en cas d’interruption du traitement immunosuppresseur par le patient. Généralement, les patients présentant un rejet 3R ont une dysfonction myocardique associée. Il est important de communiquer au clinicien la présence d’un rejet 3R car sa présence nécessitera un traitement immédiat.
Rejet humoral
Le rejet dépendant des anticorps ou rejet humoral est différent du rejet cellulaire, sauf dans les formes sévères où les aspects histologiques peuvent se superposer. Les lésions histologiques du rejet humoral, visibles en microscopie optique, se caractérisent par la turgescence des cellules endothéliales, la présence de macrophages au sein des lumières des petits vaisseaux et l’œdème interstitiel. L’immunomarquage du C4d, produit de clivage du complément est généralement utilisé pour confirmer le rejet humoral. Un second tutoriel spécifiquement dédié au rejet humoral sera bientôt disponible.
Différences entre les classifications du rejet formulées par l'ISHLT de 1990 et de 2004
L’ISHLT a proposé successivement deux classifications différentes comme nous l’avons mentionné précédemment. La classification ISHLT-2004 a été simplifiée par rapport à celle de ISHLT-1990, en supprimant les catégories sans pertinence pronostique (par exemple ISHLT-1990 1A vs 1B et ISHLT-1990 3B vs 4). L’aspect le plus controversé de ce changement a été de regrouper le grade 2 ISHLT-1990 (un seul foyer de lésion myocytaire) dans la catégorie de rejet léger (1R). Certains centres prennent en charge un grade 2 ISHLT-1990 différemment d’un grade 1R ISHLT-2004, en instituant un suivi plus rapproché ou en augmentant le traitement immunosuppresseur. Par conséquent, il peut être important de se mettre d’accord sur la signification d’un seul foyer de lésion myocytaire dans votre centre, afin de savoir si cette information doit être transmise au clinicien lorsqu’elle est présente.
Observation à faible grossissement
Cette section du tutoriel vous guide à travers les observations à faible grossissement (de 2x à 10x) de la cellularité, de l’interstitium, des myocytes et de la vascularisation.
Interprétabilité de la biopsie
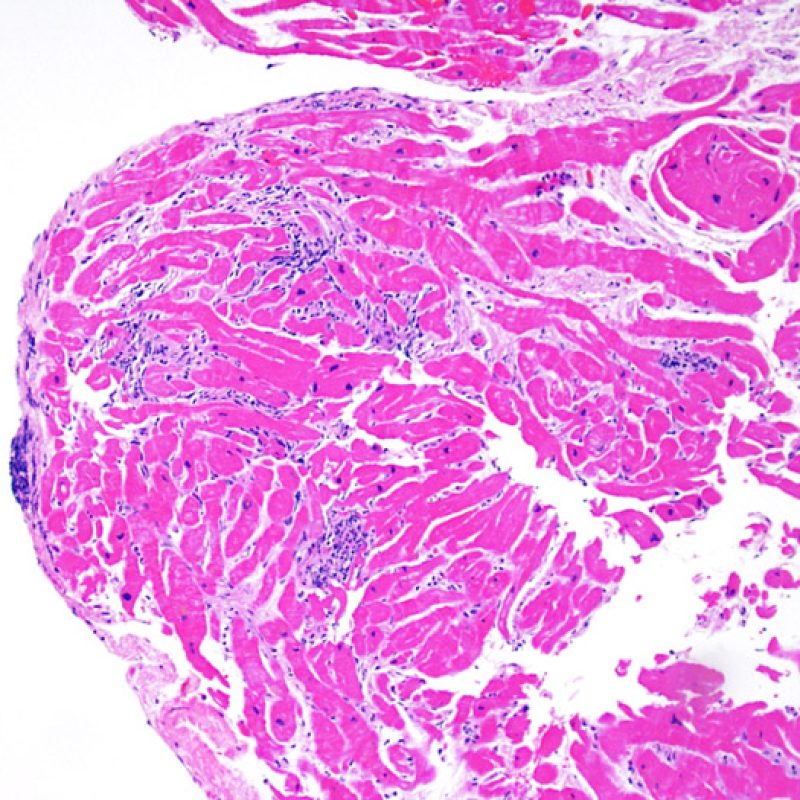
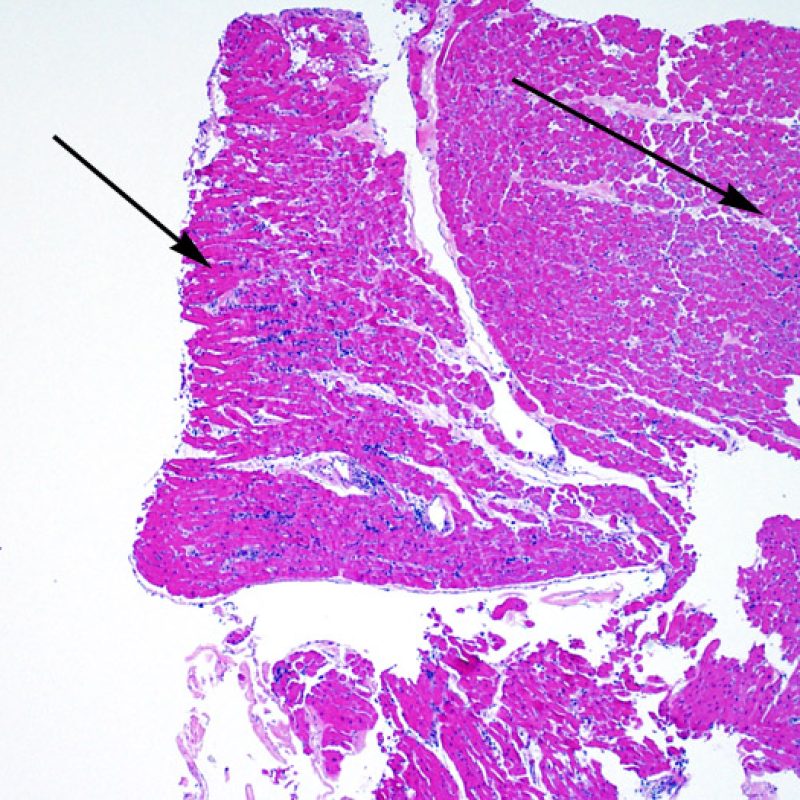
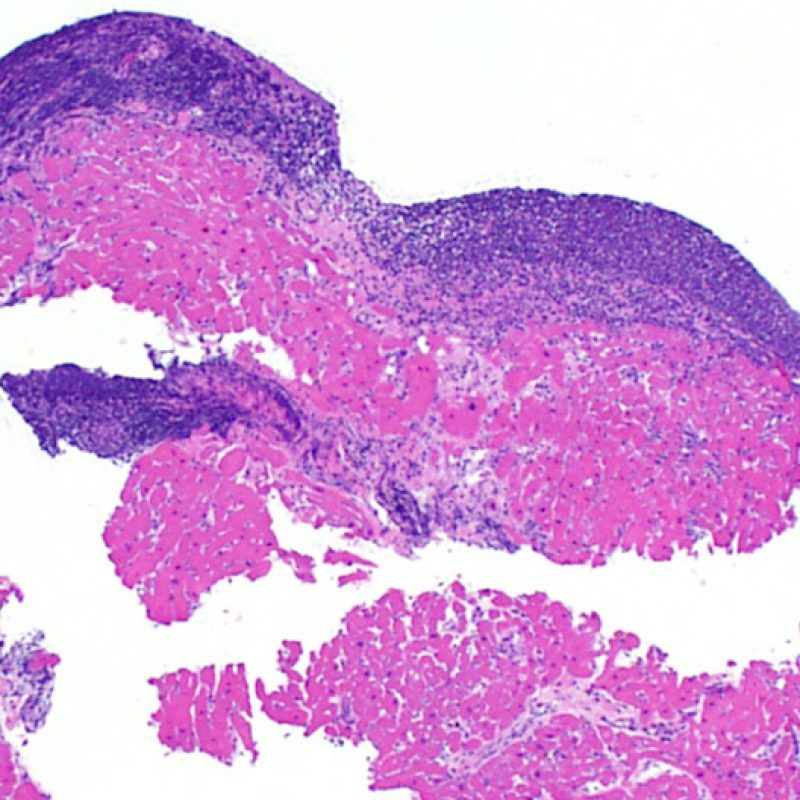
Au faible grossissement, il faut d’abord s’assurer qu’il existe suffisamment de myocarde pour évaluer le rejet cellulaire. Comme de nombreux patients transplantés cardiaques subissent des biopsies multiples et itératives, une partie ou la totalité des prélèvements biopsiques peut intéresser un site biopsique antérieur. On peut alors observer un thrombus organisé, un tissu de granulation, ou des zones de fibrose avec des myocytes absents ou désorganisés. Un prélèvement est jugé interprétable, s’il comprend au moins 3 biopsies et que chaque biopsie soit constituée par au moins 50% de myocarde non modifié par une biopsie antérieure. On doit également signaler la présence de tissu non-myocardique (feuillet valvulaire, cordage, tissu adipeux, etc.).
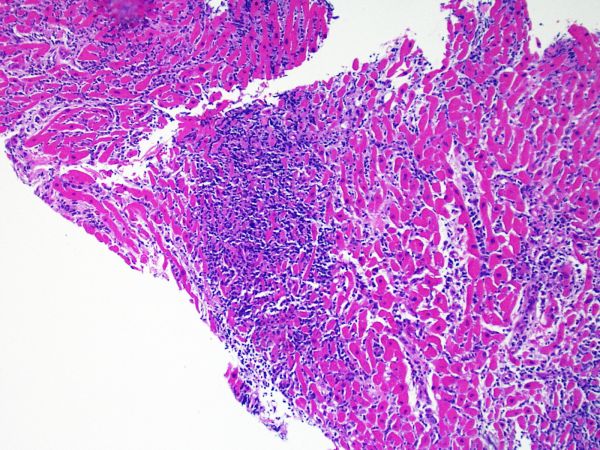
Cellularité globale de la biopsie
Après avoir déterminé l’interprétabilité de la biopsie, les principaux objectifs de l’examen à faible grossissement sont de : 1) noter les cellules dont le nombre est augmenté sur la biopsie ; 2) déterminer la localisation et l’aspect de d’infiltrat cellulaire; 3) avoir une idée globale de l’abondance de l’infiltrat inflammatoire et 4) identifier les zones d’hypercellularité à observer au fort grossissement. Les lésions histologiques de rejet aigu cellulaire n’étant pas homogènes, le survol du prélèvement à faible grossissement permet de sélectionner les zones les plus atteintes. L’examen de celui-ci sur plusieurs niveaux de coupes est indispensable pour un apporter un diagnostic précis.
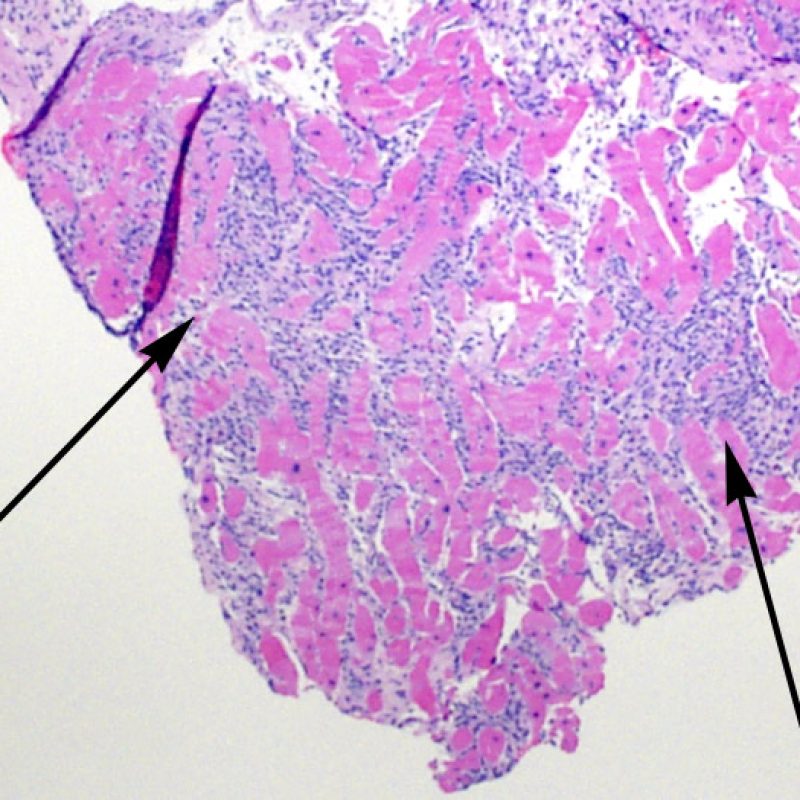
L’augmentation de la cellularité dans la biopsie myocardique est en général facilement identifiable. L’infiltrat cellulaire peut être focal ou diffus. A faible grossissement, il est en général possible de déterminer si l’infiltrat est périvasculaire ou interstitiel entre les myocytes (périmyocytaire) donnant un aspect typique « en grillage ». Cette distinction est parfois subjective comme le sont d’autres caractéristiques morphologiques.
La localisation de l’infiltrat et sa relation avec les myocytes peut orienter vers la pathologie sous-jacente. Les infiltrats lymphocytaires du rejet aigu cellulaire (ACR) sont situés autour des cardiomyocytes (périmyocytaires) ou autour des petites artérioles (périvasculaires). Si l’infiltrat est localisé majoritairement dans l’endocarde ou le tissu fibreux, d’autres étiologies comme une lésion ischémique, un effet Quilty ou un site de prise biopsique antérieure doivent être envisagés. Des infiltrats lymphocytaires peuvent siéger au sein de l’endocarde en surface ou à proximité de la surface, avec une disposition en bande. Ils peuvent être difficiles de les distinguer d’un effet Quilty dans la mesure où ils peuvent se voir en association avec un infiltrat périmyocytaire dans les grades les plus élevés de rejet cellulaire aigu.
De volumineux amas nodulaires de lymphocytes se distribuant le long de l’endocarde sont typiques de l’effet « Quilty ». Pour interpréter correctement les aspects d’effet « Quilty » de localisation myocardique isolée ou associée à une localisation endocardique, l’examen au faible grossissement de ces infiltrats lymphocytaires denses va permettre d’objectiver une zone d’interface assez nette, avec refoulement en périphérie des myocytes adjacents. Tous les infiltrats lymphocytaires périmyocytaires doivent être observés à fort grossissement pour rechercher des lésions myocytaires.
Myocytes
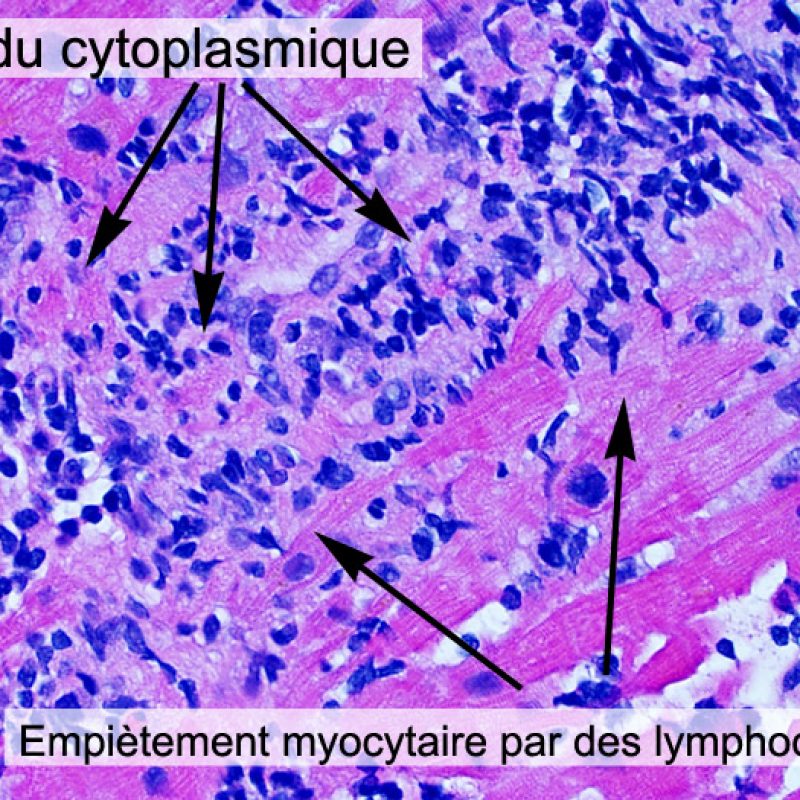
L’identification de «lésions myocytaires» nécessite un examen attentif de la biopsie endomyocardique pour identifier un large spectre de lésions allant de la mort cellulaire à des anomalies dégénératives plus subtiles. La plupart de ces changements doivent être analysés à fort grossissement pour garantir un diagnostic. L’observation fortuite de lésion myocytaire, vue à faible grossissement, comprend l’empiètement des cardiomyocytes par des cellules inflammatoires ou leur net recouvrement. L’infiltration des myocytes par les cellules inflammatoires rend leurs limites irrégulières et entraine une distorsion de l’architecture myocardique normale. En pratique, des cellules inflammatoires proches ou se superposant à des myocytes sont des signes très utiles appelant à un examen plus attentif. Il faut faire attention à ne pas évaluer les relations entre lymphocytes et myocytes dans des zones d’artéfact d’écrasement par le bioptome.
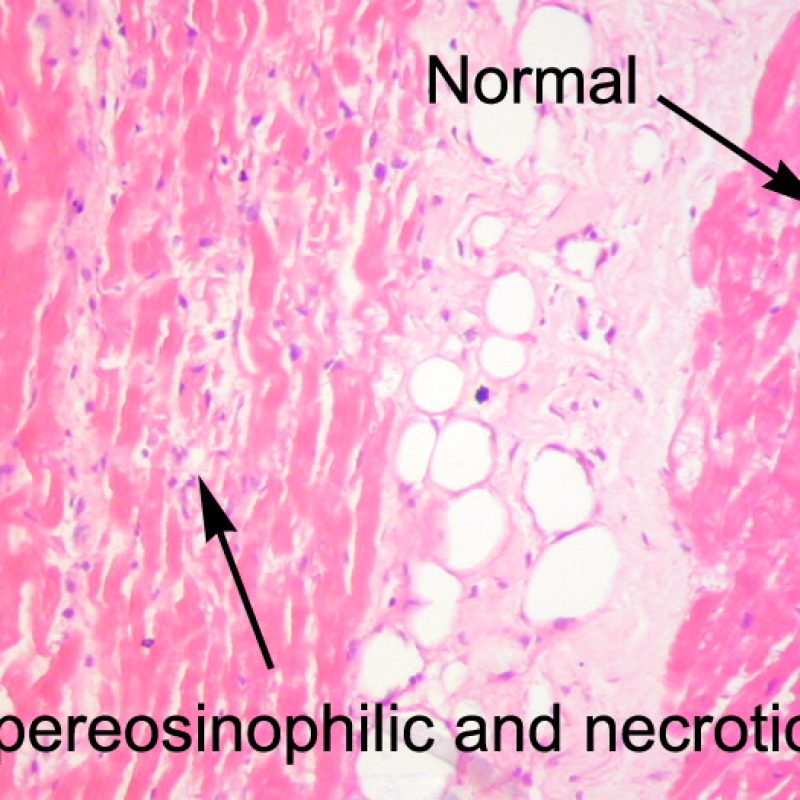
Occasionnellement, des lésions ischémiques (péri-opératoires ou par ischémie tardive dans un contexte de vasculopathie d’allogreffe) sont responsables de foyers de nécrose de coagulation de cardiomyocytes. Les petits foyers seront difficiles à distinguer d’un rejet aigu cellulaire à faible grossissement. Les plus gros foyers seront plus évidents à identifier car présentant de la nécrose de coagulation, ponctuée typiquement de myocytes dépourvus de noyaux et un degré variable de résorption cardiomyocytaire. Quelles que soient leurs tailles, les foyers ischémiques sont souvent accompagnés de macrophages, de lymphocytes et rarement de polynucléaires neutrophiles. Dans certains cas, ces zones peuvent être de forme stellaire et bien démarquées du myocarde adjacent. La coloration au trichrome de Masson peut permettre de mettre en évidence les myocytes nécrotiques en les colorant en violet.
Les myocytes vacuolisés peuvent être le reflet d’une cytolyse myocytaire secondaire à une ischémie chronique. Cependant, des artéfacts de bande de contraction, particulièrement visibles dans les myocytes coupés perpendiculairement, peuvent mimer la cytolyse myocytaire. L’observation à faible grossissement d’un aspect en « damier », alternant des myocytes coupés de façon aléatoire au niveau des bandes de contraction, alternant zones claires d’apparence lytique doit attirer l’attention et suggérer le diagnostic d’ischémie chronique.
Interstitium
En dehors de la majoration de la cellularité interstitielle (voir plus haut), les autres lésions de l’interstitium visibles au faible grossissement sont principalement l’œdème et la fibrose. L’œdème est présent en cas de rejet cellulaire aigu sévère (Grade 3R), d’insuffisance cardiaque et/ou de lésions vasculaires par rejet humoral. L’interstitium a un aspect pâle, basophile, discrètement « bulleux », bien visible au niveau des espaces périvasculaires ou périmyocytaires. Dans ce cas, il est opportun d’évaluer la microvascularisation au fort grossissement pour rechercher des signes de rejet humoral. L’œdème doit être distingué des espaces artéfactuels entre les myocytes, induits par la prise biopsique ou la technique. Ces artéfacts, de taille variable, sont vides, dépourvus de matrice extra-cellulaire (présente dans l’œdème).
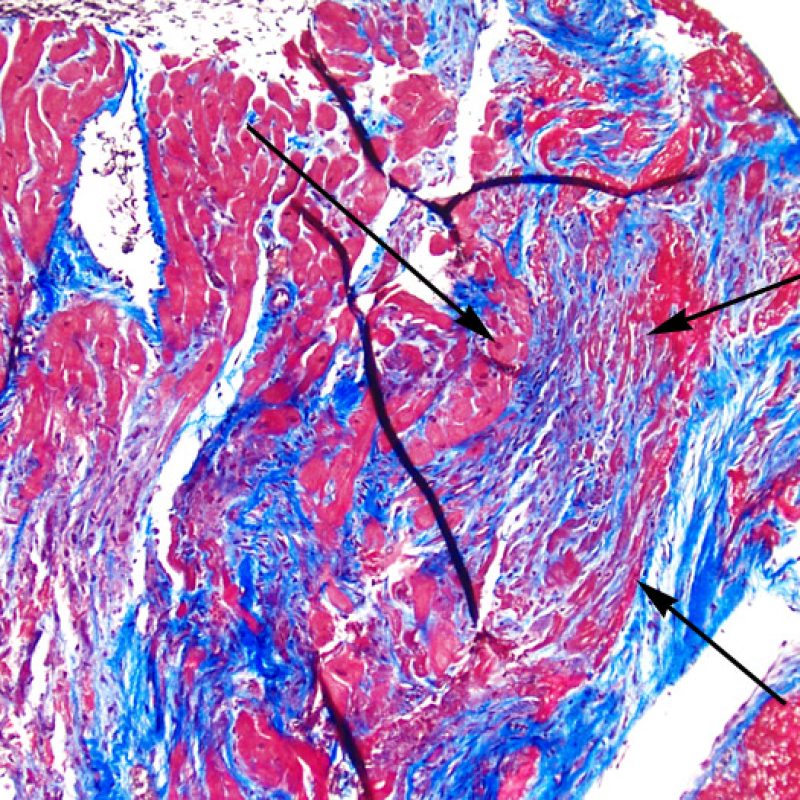
L’augmentation du tissu fibreux interstitiel se voit le plus souvent sous la forme de larges zones de fibrose de remplacement dans les zones de disparition de myocytes. Ces lésions sont souvent liées à la localisation de la biopsie au sein ou à proximité d’une zone de prise biopsique antérieure. Les aspects spécifiques de lésions du site de prise biopsique sont discutés plus loin. Une cicatrice secondaire à une ischémie myocardique chronique et/ou traitée peut être difficile à distinguer d’une cicatrice de prise biopsique antérieure. L’observation à faible grossissement d’une cicatrice de forme stellaire doit inciter à rechercher au fort grossissement d’autres signes d’ischémie chronique. Quoi qu’il en soit, la fibrose interstitielle n’est pas un signe de rejet aigu cellulaire.
Présence de vaisseaux
La preuve d’une vasculopathie d’allogreffe cardiaque peut rarement être établie sur une biopsie endomyocardique et peut être facilement confondue avec un téléscopage artéfactuel des vaisseaux sanguins. La présence de vaisseaux de gros calibre, notamment s’ils sont associés à du tissu adipeux ou nerveux, doit inciter à rechercher une perforationà fort grossissement. Les modifications pathologiques des vaisseaux sont mieux visibles au fort grossissement.
Observation à fort grossissement
Après avoir parcouru la lame à faible grossissement (objectifs 4x à 10x), le pathologiste passe au fort grossissement sur les zones comportant un infiltrat inflammatoire, en utilisant en général l’objectif 20x. A ce grossissement, dans ces zones pathologiques, il faut d’abord rechercher des lésions myocytaires. Il n’est pas nécessaire d’utiliser le fort grossissement pour parcourir les zones qui paraissent normales à faible grossissement. Cette partie du tutoriel est consacrée aux observations faites à fort grossissement. Elle abordera successivement les lésions myocytaires, l’identification des cellules de l’infiltrat et les lésions interstitielles.
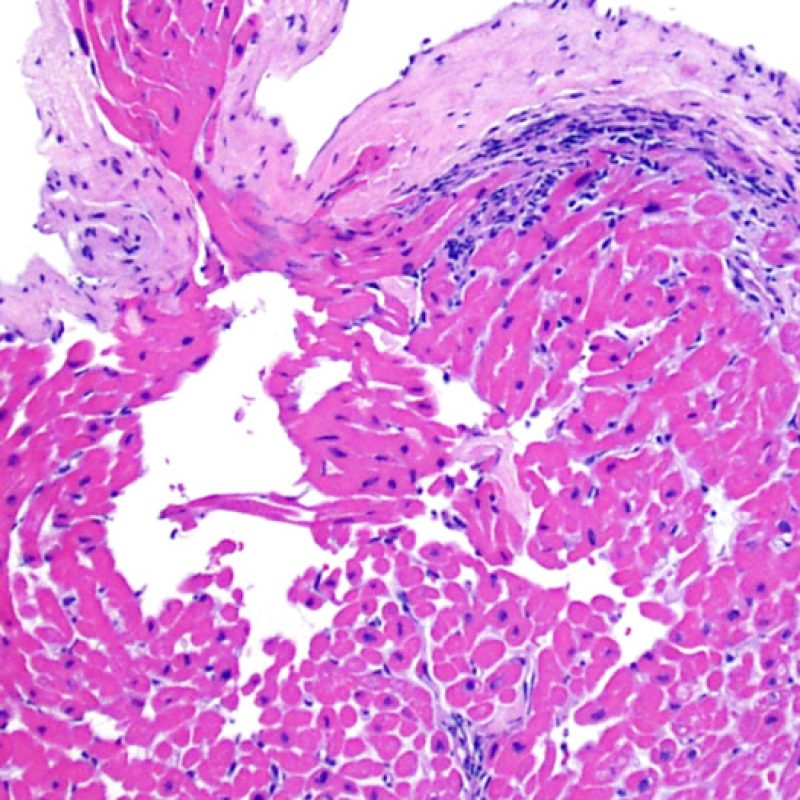
Confirmation de la lésion myocytaire
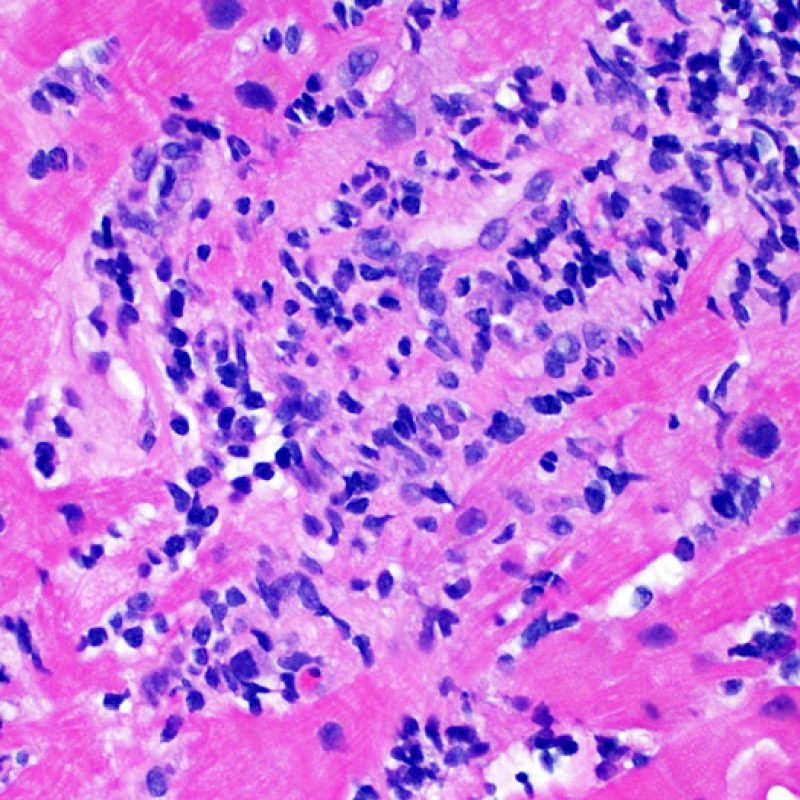
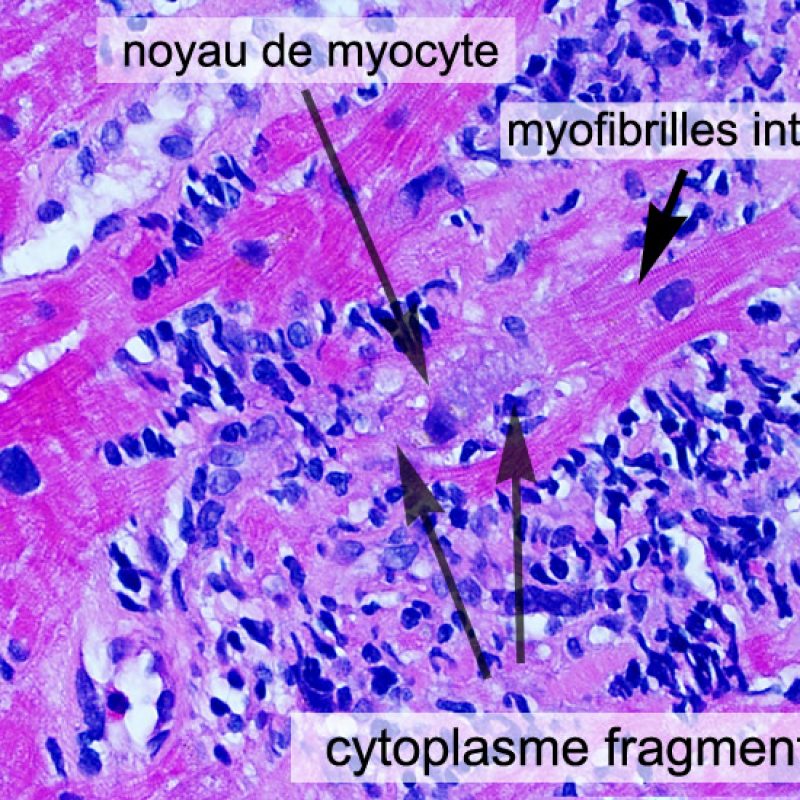
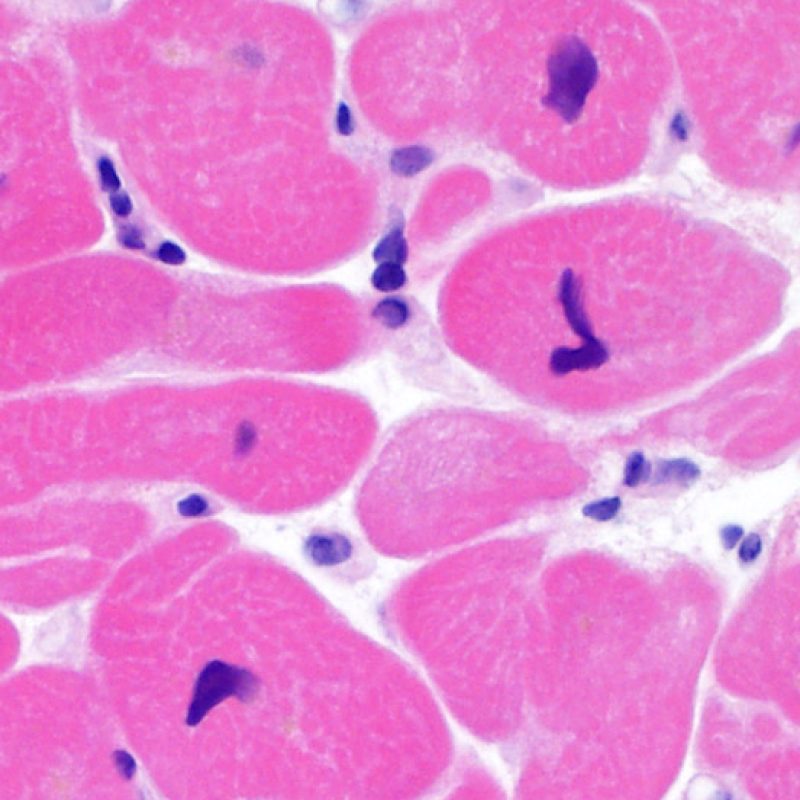
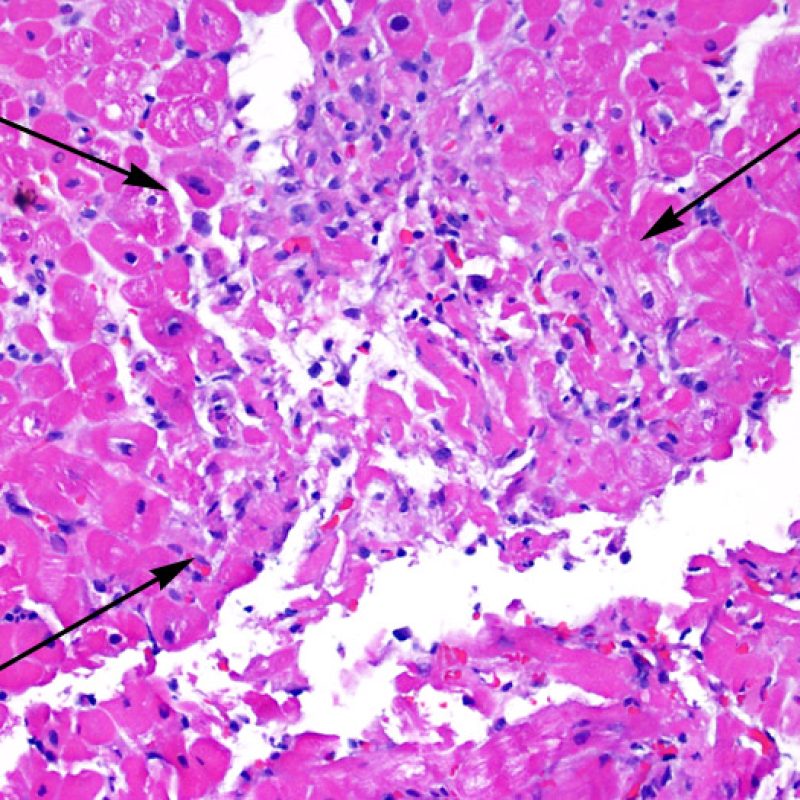
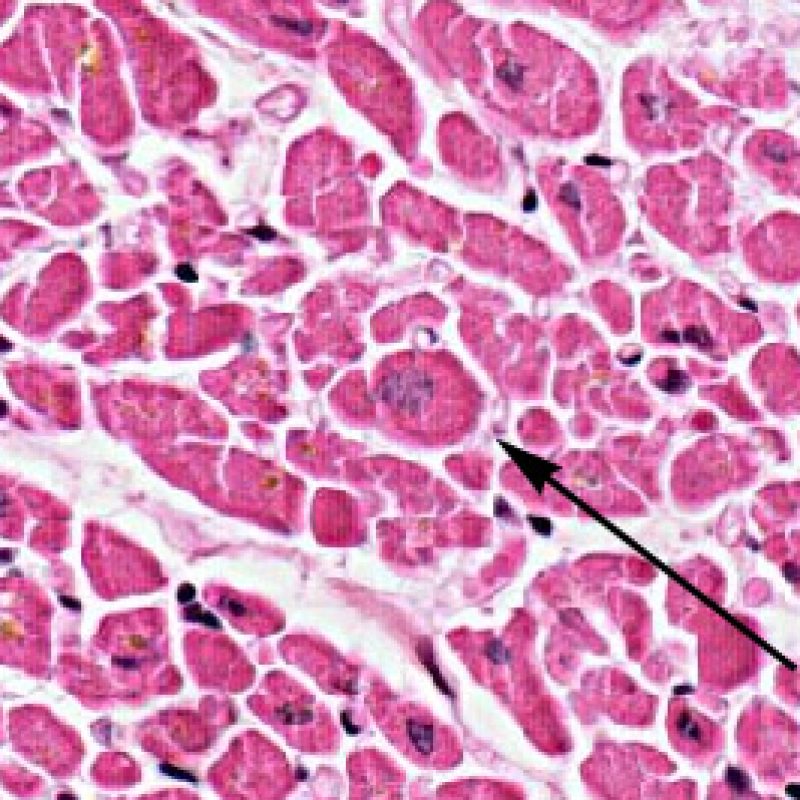
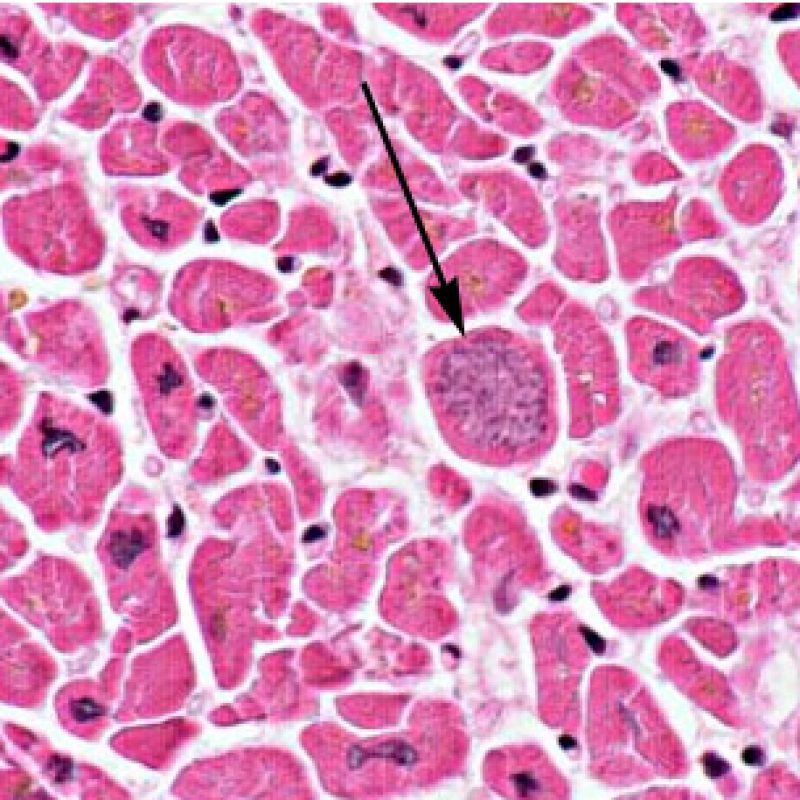
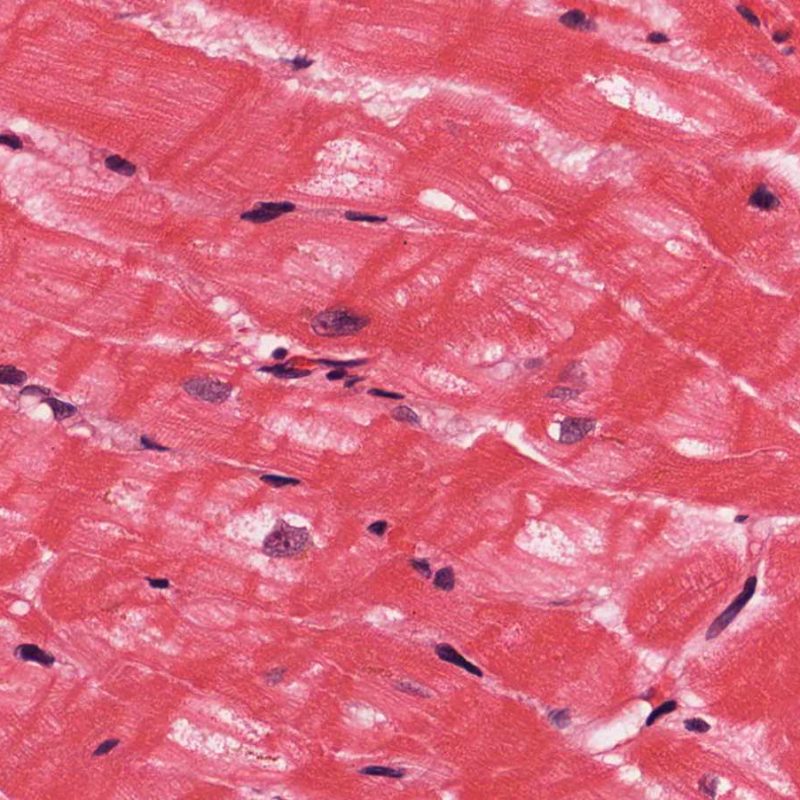
Dès qu’un infiltrat lymphocytaire est identifié, l’étape suivante consiste à rechercher une lésion myocytaire. La lésion myocytaire (c’est à dire dommage/nécrose) qui est associée au rejet aigu cellulaire peut être difficile à identifier, et peut être confondue avec d’autres lésions (mauvaise fixation). La lésion myocytaire est souvent subtile et mieux évaluée en observant la même région sur plusieurs niveaux de coupes. La lésion myocytaire peut inclure : la vacuolisation, le halo péri-nucléaire, le noyau nu, l’empiètement du myocyte par le lymphocyte (conduisant à la perte de la régularité des contours du myocyte) et la substitution du myocyte par de la matrice extra-cellulaire avec un infiltrat inflammatoire dense. L’hyperéosinophilie et la pycnose nucléaire sont aussi de bons témoins d’une lésion myocytaire. Dans la classification révisée, la myocytolyse et la nécrose de coagulation sont retenues comme des critères mineurs reconnus d’atteinte myocytaire.
Un autre signe d’une lésion myocytaire peut être un changement dans la structure du sarcomère. Si les myofibrilles du myocyte sont normalement visibles, le myocyte n’est pas atteint. Si celles-ci ont disparu et que le cytoplasme est hyperéosinophile et dense, le myocyte est sûrement lésé. La coloration au trichrome de Masson peut souligner les lésions myocytaires précoces ; dans ce cas, les myocytes lésés sont rétractés, de couleur plutôt bleu-grisâtre par perte de la couleur éosinophile normale.
Tous ces changements doivent être observés à proximité de lymphocytes. En l’absence de lymphocytes, la lésion myocytaire n’est pas due au rejet cellulaire, mais à d’autres processus comme des lésions ischémiques qui peuvent être observées dans les premières semaines après la transplantation.
Pour confirmer la présence d’une atteinte myocytaire et ne pas interpréter à tort une lésion myocytaire isolée et présente sur seule section histologique, il est toujours utile d’observer les zones potentiellement lésées sur plusieurs niveaux de coupe.
Identification des cellules interstitielles
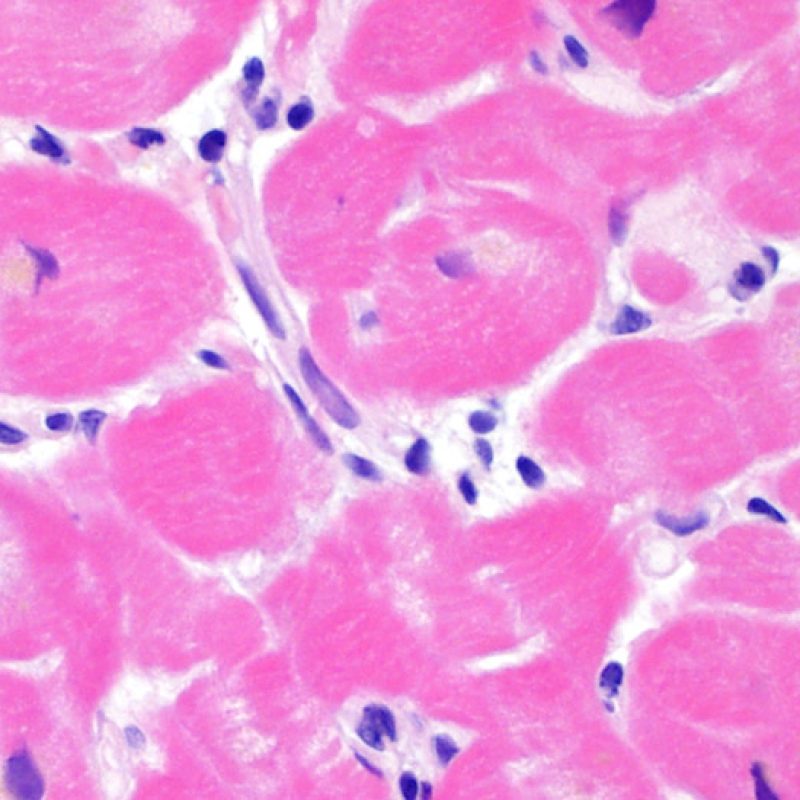
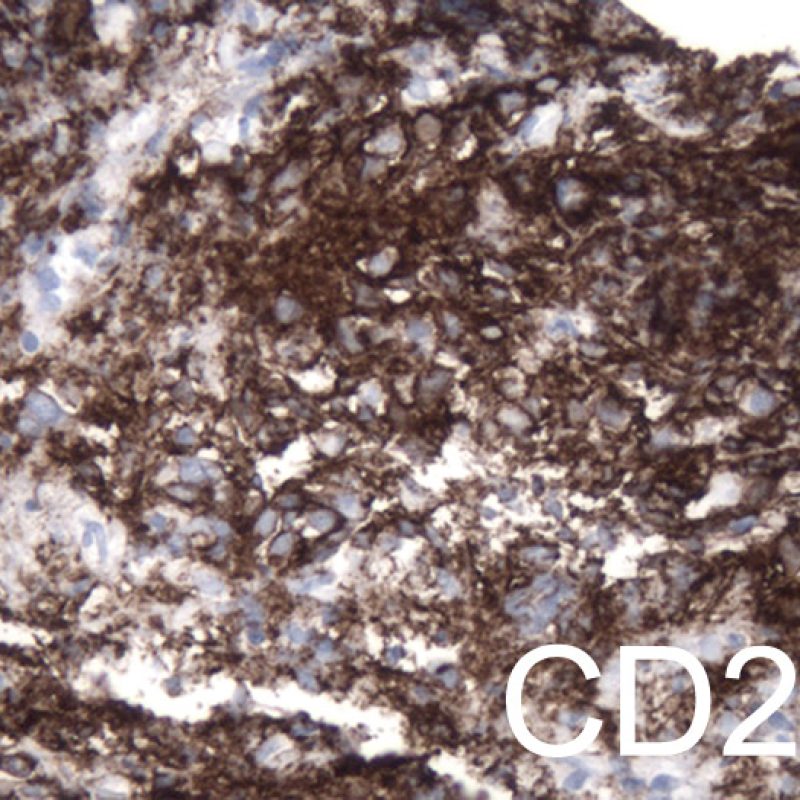
Un grand nombre de cellules peuvent être présentes sur une biopsie, en dehors des myocytes. Les plus importantes sont celles de l’infiltrat du rejet aigu cellulaire, qui sont principalement des lymphocytes T (CD4+ et CD8+), avec quelques macrophages et de rares éosinophiles. Une augmentation substantielle des lymphocytes B activés et des cellules Natural Killer peut se voir dans les rejets modérés à sévères.
Les noyaux observés dans l’interstitium ne correspondent pas tous à des lymphocytes. Le fort grossissement peut être utile pour identifier la nature exacte de l’ « infiltrat » et exclure un rejet cellulaire. Les autres composants cellulaires de l’interstitium comprennent les fibroblastes, les myofibroblastes, les cellules mésenchymateuses primitives, les cellules dendritiques, les mastocytes, les cellules endothéliales et les péricytes. Des lymphocytes dispersés et de rares macrophages peuvent également être présents dans le myocarde normal. En général, seuls les lymphocytes se regroupent en amas dans le myocarde.
Composition de l'infiltrat inflammatoire
L’analyse du type de cellules inflammatoires présentes dans les biopsies myocardiques de transplantés cardiaques est importante pour identifier un rejet, le grader ou pour diagnostiquer une autre pathologie. Le rejet aigu cellulaire est toujours caractérisé par la présence de lymphocytes (lymphocytes T). Les lymphocytes activés avec un cytoplasme plus abondant sont plus fréquents dans les rejets de haut grade.
Dans un contexte approprié, un infiltrat inflammatoire polymorphe comportant des polynucléaires neutrophiles et éosinophiles peut être un signe de rejet cellulaire de plus haut grade (3R). Les polynucléaires neutrophiles peuvent aussi se voir en cas de nécrose ischémique, qui peut s’observer pendant plusieurs semaines après la transplantation.
Des polynucléaires éosinophiles peuvent être présents dans les rejets de grade modéré (2R) ou sévère (3R) pour lesquels on retrouve également une nécrose myocytaire. En général ils sont rares et dispersés. On n’observe presque jamais d’éosinophiles dans le rejet léger (1R) et leur présence doit attirer l’attention sur le fait qu’il puisse s’agir plutôt d’un rejet modéré ou sévère (2R & 3R).
Les éosinophiles peuvent aussi se voir dans l’hypersensibilité myocardique liée le plus souvent à des agents pharmacologiques. Dans ce cas, les éosinophiles sont prédominants au sein de l’infiltrat et sont souvent groupés en amas. Il existe également des lymphocytes, des plasmocytes et des macrophages. La nécrose myocytaire n’est pas un signe caractéristique de cette pathologie, cependant, il est possible de rencontrer une myocytolyse focale. Les polynucléaires éosinophiles peuvent être un des signes d’infections parasitaires dans le myocarde.
Analyse de l'interstitium
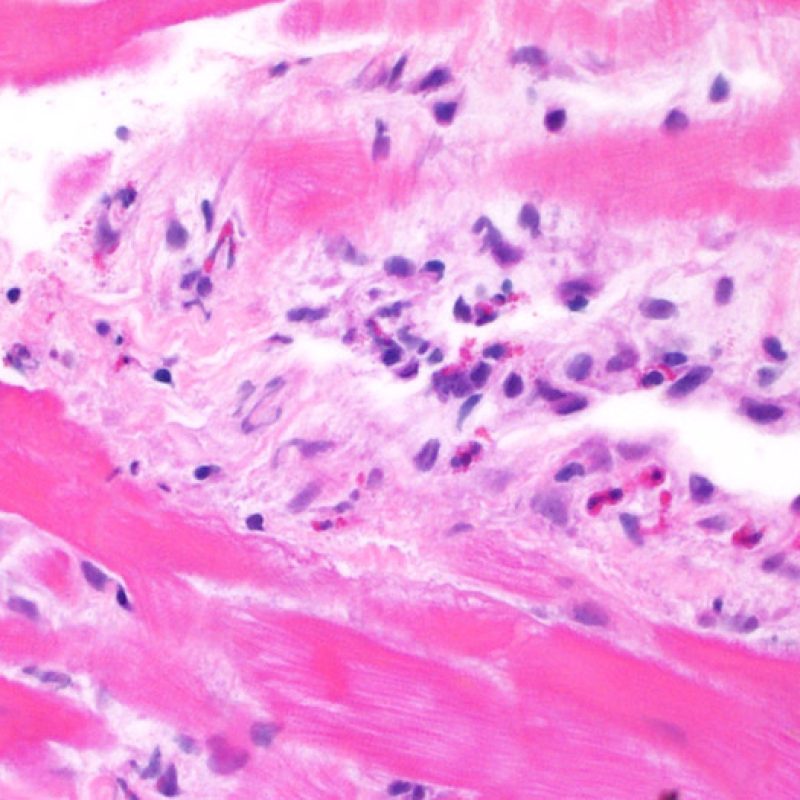
L’interstitium doit être observé à fort grossissement pour analyser les cellules et l’œdème. La présence de débris nucléaires ou de matériel amorphe basophile ou éosinophile, dans des zones d’infiltrat dense, est évocateur d’atteinte myocytaire et d’apoptose cellulaire. Peu de temps après la transplantation, ces lésions sont souvent liées à de l’ischémie péri-opératoire. Cependant, pour les transplants anciens, ces aspects histologiques sont utiles pour mieux évaluer le rejet.
L’ œdème interstitiel peut être un signe de rejet humoral. Cependant, il convient d’éliminer des artéfacts de manipulation ou de technique de la biopsie. Dans un vrai œdème, les myocytes sont séparés par une matrice éosinophile « vaporeuse ». De plus, en cas de rejet humoral, d’autres signes doivent être présents, comme des cellules endothéliales turgescentes, des macrophages interstitiels et/ou des suffusions hémorragiques.
Myocytolyse ( au cours de la coronaropathie du greffon)
Une vacuolisation myocytaire ou une myocytolyse, focale ou diffuse, de topographie sous-endocardique peut être un marqueur de lésion ischémique réversible. La myocytolyse se caractérise par une clarification du sarcoplasme et du noyau, avec un élargissement du noyau et un nucléole proéminent. Si cet aspect est observé dans les biopsies endomyocardiques de patients transplantés depuis plus d’un an, il peut être le signe d’une coronaropathie accélérée sténosante du greffon.
Modifications des cellules endothéliales (dans le rejet humoral)
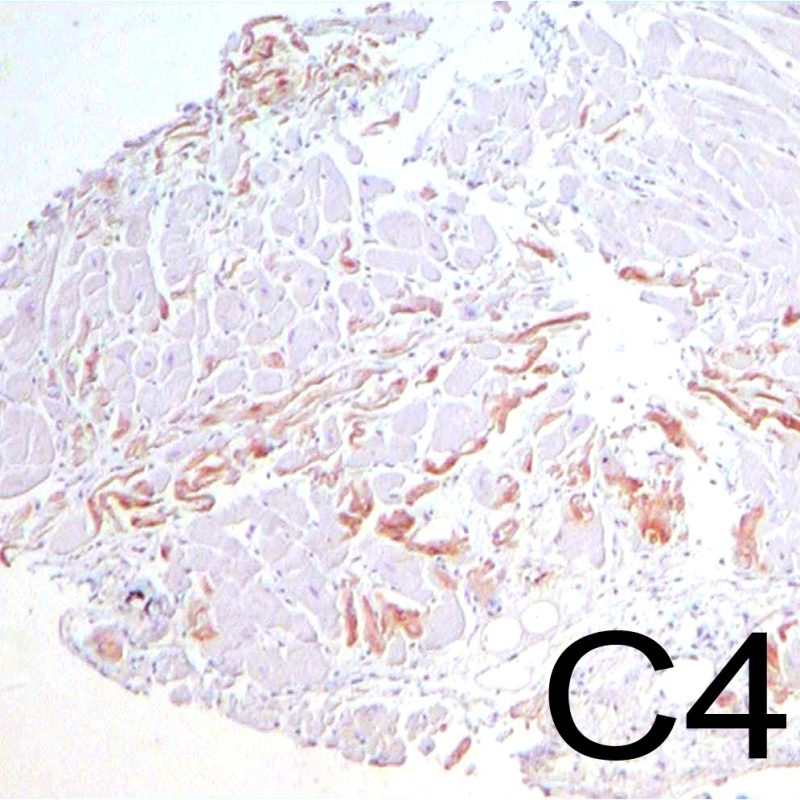
Les critères de diagnostic du rejet humoral sont expliqués dans une autre section du tutoriel. Au faible grossissement, sur des lames colorées à l’ hématoxyline-éosine, la proéminence des capillaires et des veinules, aide au diagnostic de rejet humoral. Le fort grossissement permet d’examiner les cellules endothéliales qui dans le rejet humoral sont plus volumineuses et turgescentes (« gonflées »), avec un noyau plus gros et hyperchromatique. Ces signes sont en faveur d’un rejet humoral et justifient des investigations plus poussées pour détecter la présence d’immunoglobulines et de complément.
Rejet
Ce chapitre du tutoriel traite des principaux critères histologiques retenus pour établir le diagnostic de rejet aigu cellulaire en faisant la synthèse des concepts clés abordés dans les chapitres « observation au faible grossissement » et « observation au fort grossissement ». Il aborde aussi brièvement le rejet humoral, qui sera traité plus en détail dans un prochain tutoriel.
Infiltrat lymphocytaire
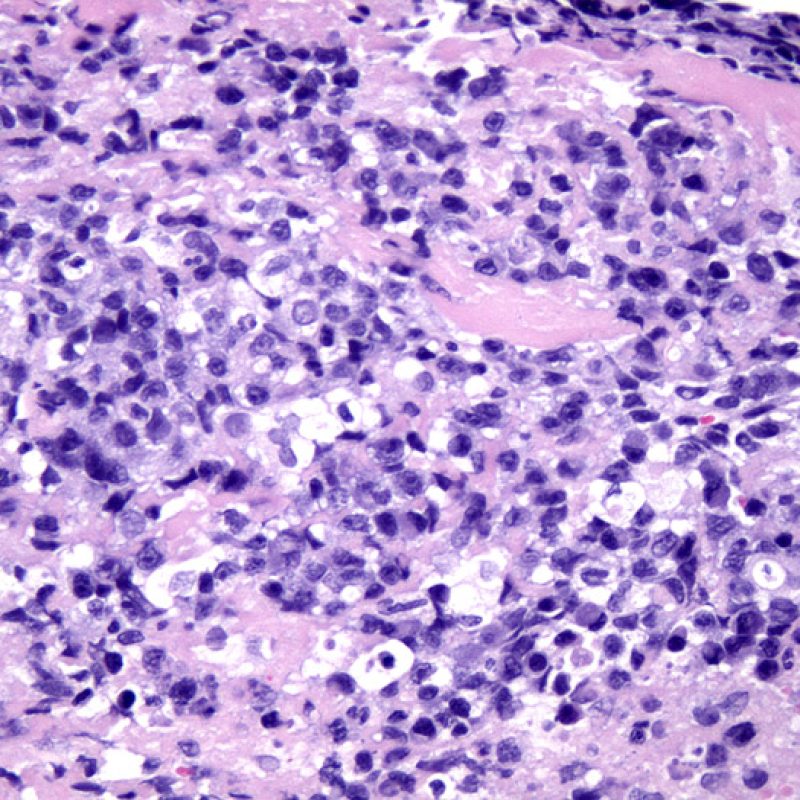
La lésion histologique clé d’un rejet aigu cellulaire est la présence d’un infiltrat lymphocytaire. A faible grossissement, elle se caractérise par une zone avec une cellularité augmentée. A fort grossissement, il faut évaluer les lésions myocytaires au contact des lymphocytes. Les lymphocytes activés, présents dans les rejets, peuvent avoir un noyau et un cytoplasme plus volumineux par rapport à ceux des lymphocytes quiescents.
Atteinte myocytaire
L’atteinte myocytaire est l’élément clé permettant de distinguer le rejet de bas grade du rejet de haut grade (2R et 3R, grades avec atteinte myocytaire). L’atteinte myocytaire est mieux évaluée à fort grossissement, ce qui permet d’observer un nombre varié de caractéristiques lésionnelles comme l’hyperéosinophilie, la pycnose nucléaire, la myocytolyse, la nécrose de coagulation, la vacuolisation, le halo périnucléaire et l’empiètement du myocyte par le lymphocyte. Parfois, l’atteinte myocytaire est observée au sein d’un infiltrat lymphocytaire dense sous la forme d’une zone acellulaire (espace vide à la place des myocytes) ou de « morceaux » de myocytes, témoins d’une destruction myocytaire.
Rejet Humoral
Le rejet dépendant des anticorps ou rejet humoral est différent du rejet cellulaire, sauf dans les formes sévères où les aspects histologiques peuvent se superposer. Les lésions histologiques du rejet humoral, visibles en microscopie optique, se caractérisent par la turgescence des cellules endothéliales, la présence de macrophages au sein des lumières des petits vaisseaux et l’œdème interstitiel. L’immunomarquage du C4d, produit de clivage du complément, est généralement utilisé pour confirmer le rejet humoral. Un second tutoriel spécifiquement dédié au rejet humoral sera bientôt disponible.
Répertoire des lésions ne dépendant pas du rejet
Ce chapitre est consacré aux lésions histologiques non liées au rejet que l’on peut rencontrer sur des biopsies endomyocardiques. Certaines sont fréquentes, d’autres beaucoup plus rares. Une grande partie de ces lésions peut facilement être confondue avec des lésions de rejet : il est donc crucial de les identifier pour ne pas surévaluer un rejet.
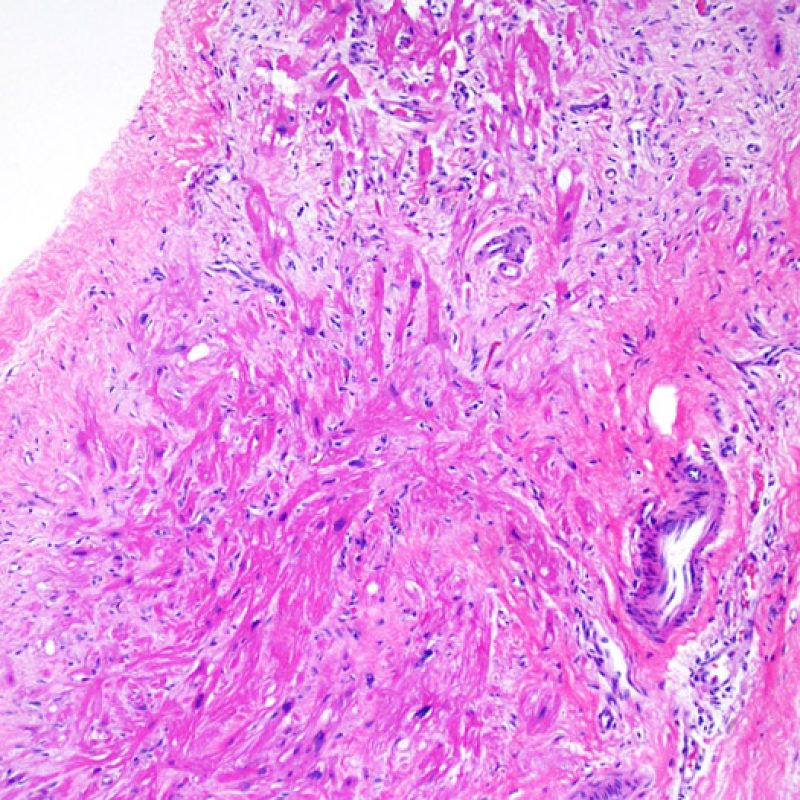
Effet Quilty
Chez environ 50% des patients allogreffés de cour, les biopsies endomyocardiques peuvent comporter focalement un infiltrat lymphocytaire endocardique dense qui peut s’étendre au myocarde adjacent réalisant un effet Quilty (anciennement dénommé lésion de Quilty, nom du premier patient pour lequel cette lésion fut décrite). Ces lésions sont constituées d’un mélange de lymphocytes B et T et parfois de cellules dendritiques. Des capillaires peuvent parfois être observés au sein de l’infiltrat inflammatoire.
La pathogénie de l’effet Quilty n’est pas connue, mais des hypothèses ont mis en cause des protocoles d’immunosuppression à base de cyclosporine, des réponses idiosyncrasiques à la cyclosporine A et une infection concomitante par le virus d’Epstein Barr. D’autre part, l’effet Quilty n’est pas retrouvé dans les cours de patients traités par la cyclosporine A en cas de transplantation d’un autre organe solide (par exemple rein, foie). Beaucoup d’équipes ont recherché une relation entre l’effet Quilty et le grade de rejet cellulaire, une infection virale, le rejet humoral et/ ou le développement d’une vasculopathie d’allogreffe. Des études contradictoires sont parues sur cette problématique qui reste un terrain d’investigation. De manière générale, il n’y a pas de consensus sur son association avec des données clés histopathologiques ou prédictives de l’évolution du greffon.
L’effet Quilty peut rester confiné à l’endocarde ou il peut s’étendre au myocarde adjacent. Certains effets Quilty importants dissocient les myocytes sous-jacents, induisant des lésions myocytaires péri-Quilty. Cet aspect, qui peut mimer un rejet, est probablement souvent interprété à tort comme une lésion de grade 2 de la classification de l’ISHLT-1990. Pour le distinguer d’un rejet aigu, il peut être nécessaire de faire de multiples niveaux sur le bloc pour mettre en évidence l’atteinte endocardique (bien que le rejet aigu cellulaire puisse également avoir une distribution endocardique). La présence de petits vaisseaux ou capillaires au sein de l’infiltrat inflammatoire peut être une aide pour reconnaître l’effet Quilty. De plus, dans l’effet Quilty, le stroma entre les myocytes peut apparaître plus fibreux.
Dans certains cas, le typage des lymphocytes par des techniques d’immunopéroxidase peut être nécessaire. Dans l’effet Quilty, on observe un mélange de lymphocytes B, de lymphocytes T et de macrophages, contrairement au rejet aigu cellulaire qui comporte une prédominance de lymphocytes T. On peut également utiliser le CD21 qui est un marqueur fiable d’effet Quilty, mais qui n’a de valeur que positif.
Si un effet Quilty est observé sur plusieurs fragments de la biopsie, il se peut qu’un foyer d’inflammation au sein du myocarde corresponde également à un effet Quilty, bien qu’un rejet cellulaire ne puisse être totalement exclu. Quand un effet Quilty régresse, de petites cicatrices mimant une prise biopsique antérieure peuvent être observées. Les cicatrices de Quilty tendent à avoir des limites plus régulières et linéaires contrairement aux anciennes biopsies qui ont une interface plus irrégulière.
Lésions ischémiques (péri-opératoires)
Les lésions ischémiques (péri-opératoires) sont observées en général sur les biopsies effectuées dans les 6 premières semaines après la transplantation, mais peuvent être présentes jusqu’à 3 mois. Elles peuvent être difficiles à distinguer du rejet aigu cellulaire. Durant la période d’ischémie, pendant le transfert du donneur vers le receveur, un nombre variable de myocytes va mourir. La mort des myocytes est généralement observée sous forme d’amas (petits ou étendus). Dans la biopsie initiale, la nécrose des myocytes peut être quasi imperceptible, caractérisée seulement par une augmentation de l’éosinophilie cytoplasmique et la perte du noyau. Les myocytes morts sont fortement colorés par la C4d en immunohistochimie ou en immunofluorescence et ne doivent pas être interprétés à tort comme un rejet médié par les anticorps. La nécrose tardive des myocytes peut être observée, mais elle se distingue de celle du rejet aigu cellulaire par l’absence d’infiltrat lymphocytaire. En raison de la forte immunosuppression, l’inflammation peut également manquer à la phase précoce.
En général, 2 à 4 semaines après la transplantation, l’infiltrat inflammatoire est maximal, d’abord sous forme d’une réponse dépendant des macrophages. Cette inflammation peut être extensive et associée à des lésions des myocytes. Le polymorphisme de l’infiltrat l’oppose à celui du rejet aigu cellulaire qui est riche en lymphocytes. L’interstitium peut prendre un aspect grumeleux. Lorsque des lésions ischémiques et de rejet aigu cellulaire surviennent conjointement sur la même biopsie, la distinction de ces lésions peut être difficile à faire. Il est très facile de surestimer le rejet dans cette situation, mais, comme la plupart des patients reviendront faire une biopsie une ou deux semaine plus tard, il convient d’être prudent.
Après le premier mois, la plupart des lésions ischémiques ressemblent à de petits infarctus typiques en voie de résorption avec des macrophages pigmentés, un tissu conjonctif lâche et une disparition locale des myocytes. Le diagnostic différentiel avec un rejet aigu cellulaire est assez aisé contrairement avec celui d’une cicatrice de prise biopsique antérieure.
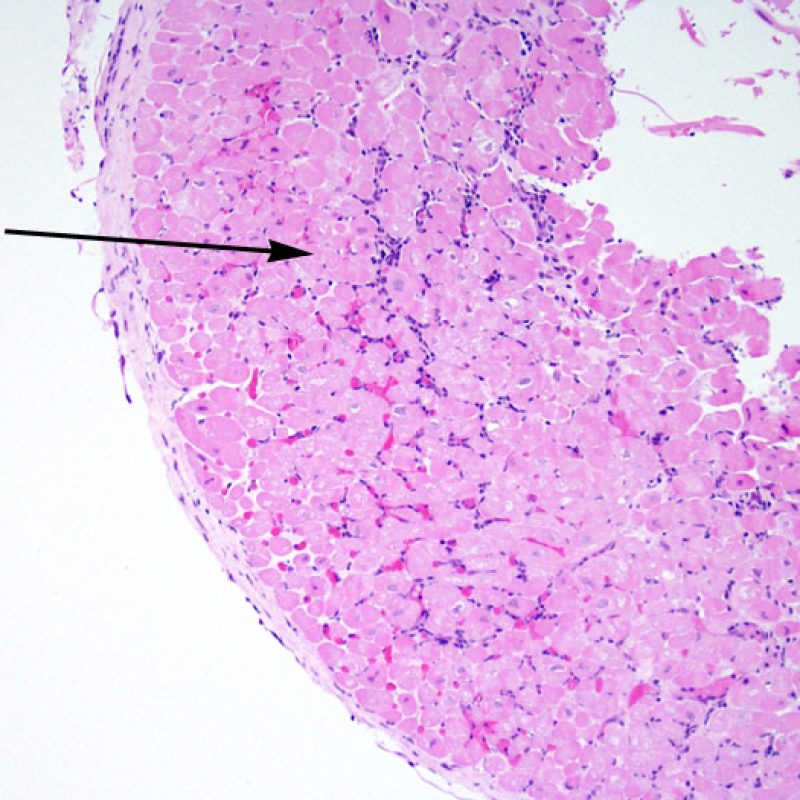
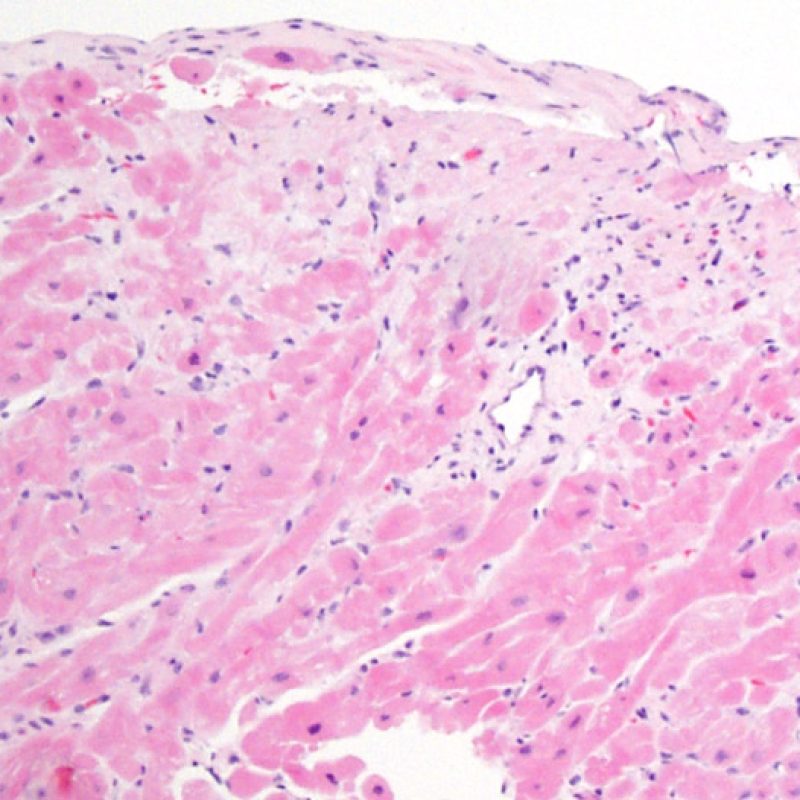
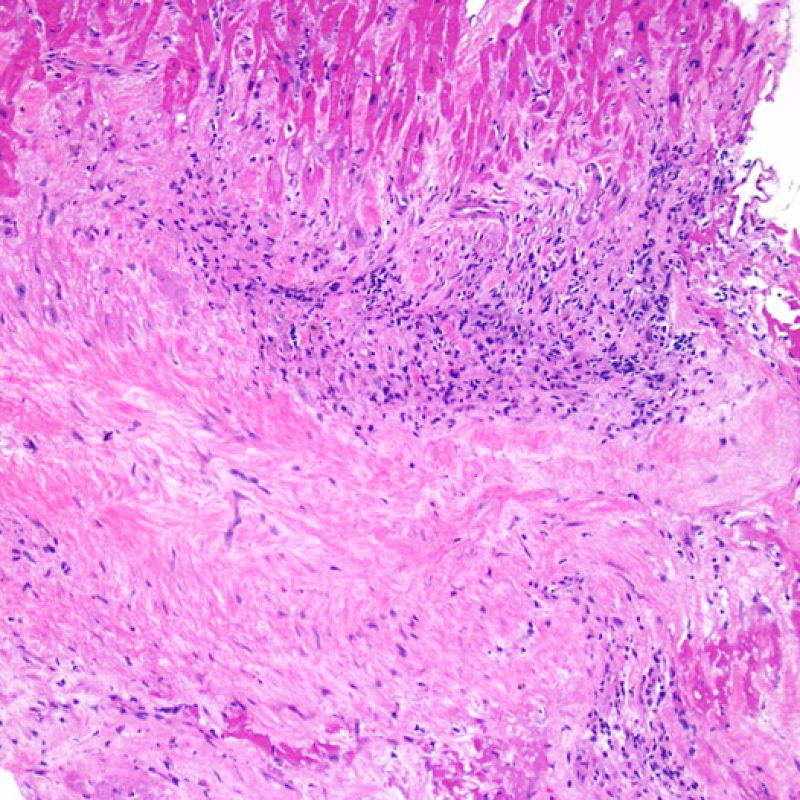
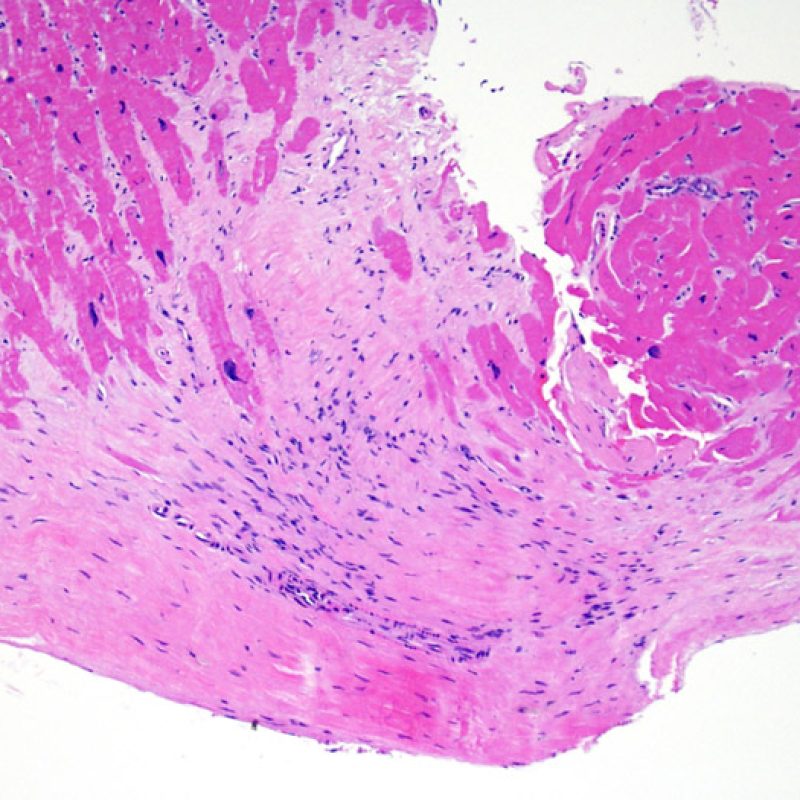
Modifications du site de prise biopsique et thrombus
En raison de la morphologie de ventricule droit, il n’est pas rare que la pince à biopsie soit guidée dans la même localisation ou dans des localisations proches et qu’elle intéresse une cicatrice de prise biopsique antérieure chez un transplant cardiaque. L’aspect de la cicatrice peut varier en fonction de l’intervalle de temps entre la prise biopsique actuelle et la précédente. Une biopsie récente peut entraîner une ulcération focale endomyocardique tapissée en surface d’un amas fibrino-cruorique ou d’un thrombus organisé associé à des cellules inflammatoires (macrophages, lymphocytes T et B). Durant la phase de réparation, il peut s’agir d’un tissu de granulation, et l’on peut parfois observer une cicatrice endocardique focale. Les myocytes adjacents à une cicatrice présentent une désorganisation focale et/ou une hypertrophie irrégulière. Lorsque certains patients, comme les transplantés cardiaques, subissent des biopsies endomyocardiques répétées, la probabilité de rebiopsier au même endroit varierait de 15% jusqu’à près de 70% des biopsies.
L’inflammation observée dans les zones de prise biopsique ne correspond pas à du rejet cellulaire et ne doit pas être gradée en conséquence. Au total, une biopsie peut être dépourvue de signe de rejet (0R) mais peut avoir une zone d’inflammation au niveau du site de prise biopsique.
Lymphocytes intravasculaires
Dans certains cas, on peut observer des amas de lymphocytes comblant un canal lymphatique. L’étiologie de ces aspects est inconnue. Ils ne sont pas associés à un rejet cellulaire et il n’est pas nécessaire de les mentionner.
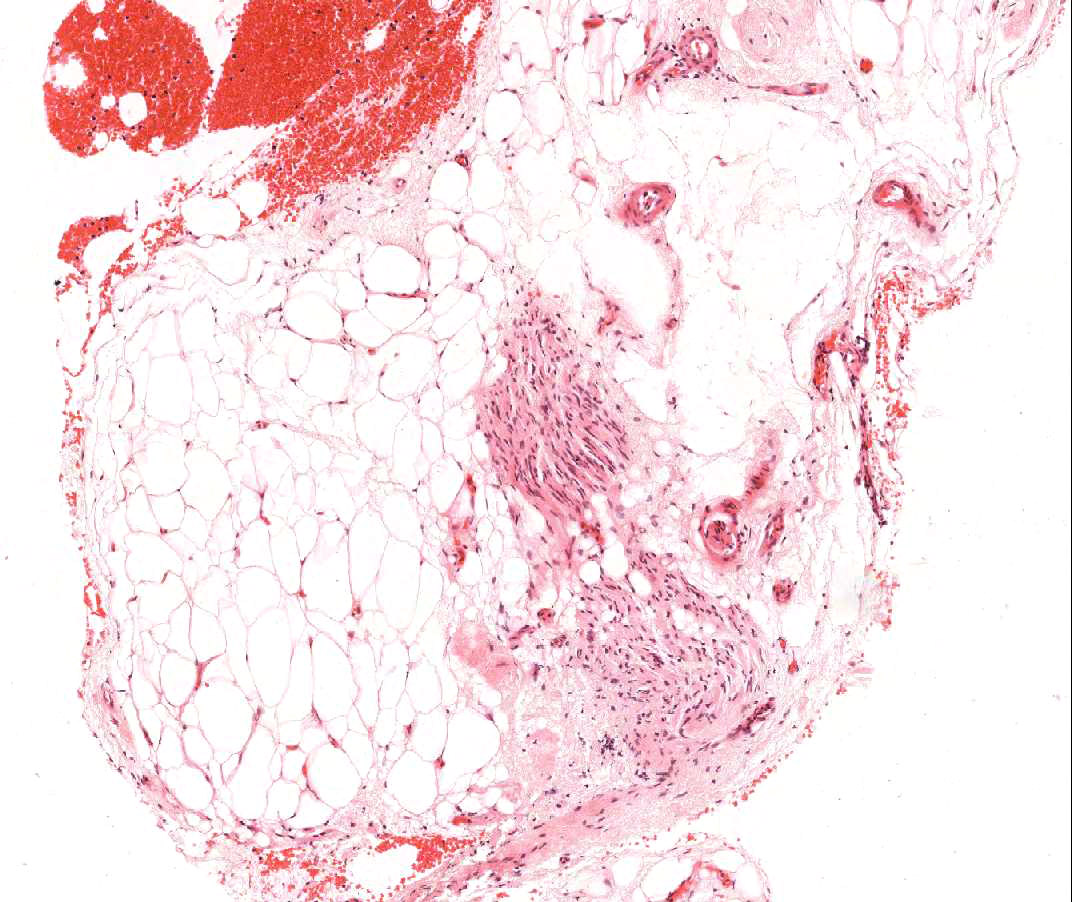
Tissu adipeux et cellules mésothéliales
Le tissu adipeux est un composant normal minoritaire du myocarde, englobant souvent de grosses artérioles. On observe parfois sur des biopsies de larges amas d’adipocytes ou d’authentiques fragments de tissu adipeux. Des fragments de myocarde non-compacté soulignent souvent ces zones adipeuses. Ces fragments viennent de la paroi libre du ventricule droit et, en dehors du fait qu’ils peuvent ne pas être représentatifs pour évaluer le rejet aigu, ont peu de signification. Parfois, la présence de tissu adipeux est plus péjorative. Lorsqu’il y a des bandes de mésothélium attachées à la graisse ou retrouvées à distance dans le bloc, ou lorsque de petits filets nerveux sont notés dans la graisse, le prélèvement a très vraisemblablement intéressé de la graisse épicardique. Ceci indique une perforation du ventricule droit et le clinicien doit en être informé en urgence en raison du risque significatif d’hémopéricarde. En cas de prélèvement d’épicarde, le risque d’hémopéricarde fatal est significativement plus faible chez la plupart des transplantés cardiaques – le péricarde ayant adhéré au cour – par rapport à celui qui existe si une telle biopsie est réalisée sur un cour natif.
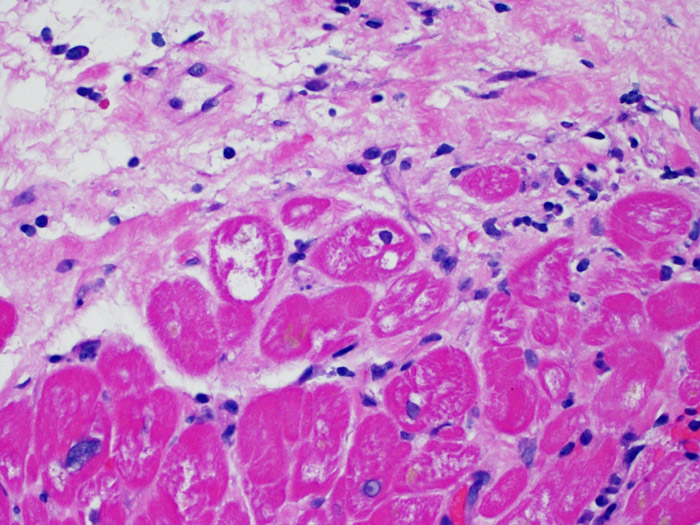
Calcification myocytaire
La calcification des myocytes est une lésion très rarement observée dans le cour transplanté. L’étiologie serait une hypercalcémie transitoire lors de la transplantation entraînant des calcifications métastatiques des myocytes. Ceci peut également être observé au niveau des anciens sites de prise biopsique. Ces calcifications apparaissent plus volontiers dans le cadre d’une insuffisance rénale aiguë ou chronique. Histologiquement, les myocytes sont calcifiés individuellement ou en foyers. Ces lésions peuvent susciter une fibrose, rarement un infiltrat inflammatoire. Bien que des calcifications cardiaques extensives puissent altérer la fonction cardiaque, elles ne sont pas associées au rejet aigu cellulaire.
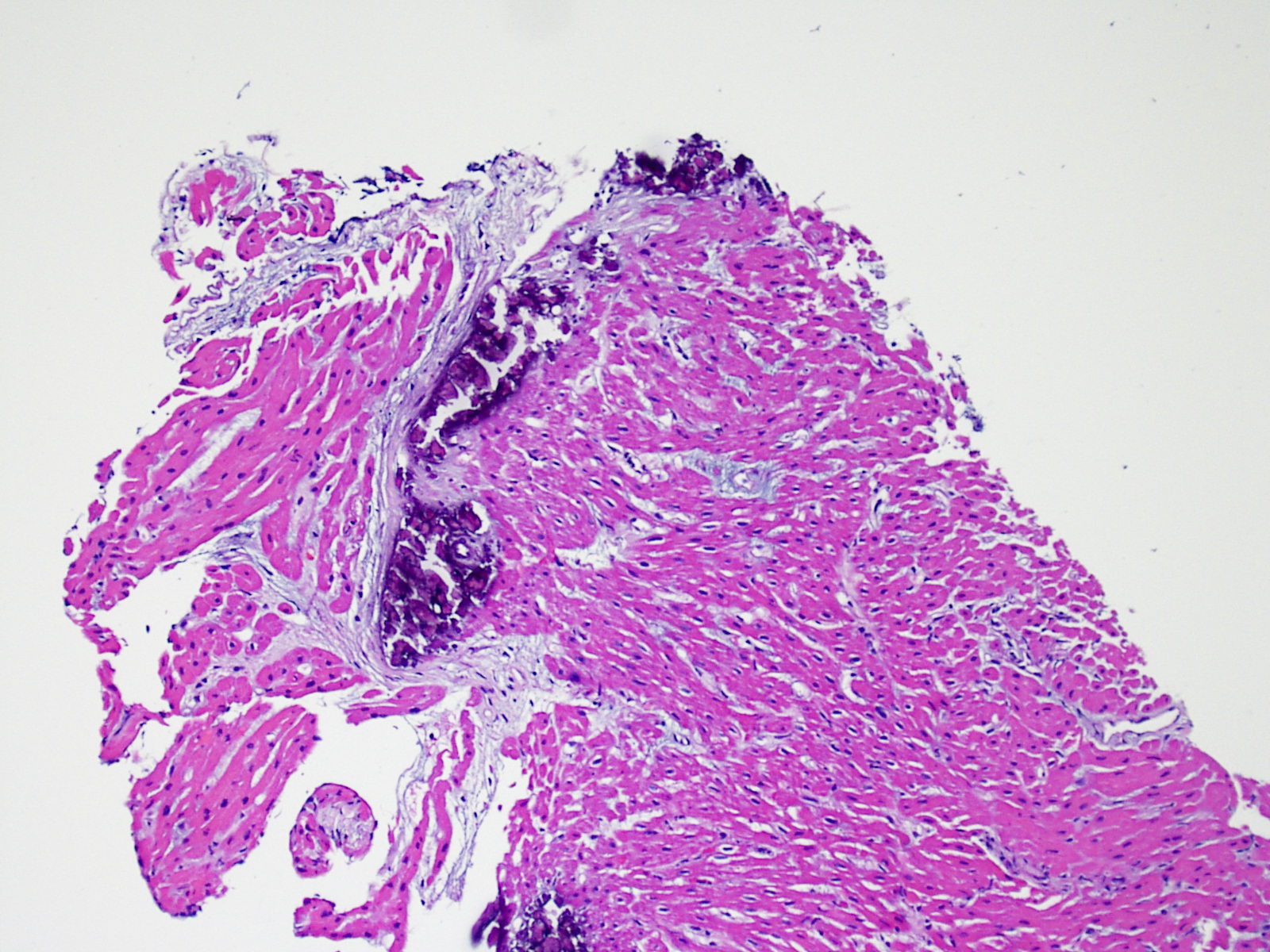
Récidive de la maladie initiale
Certaines maladies responsables d’insuffisance cardiaque peuvent récidiver dans le cour transplanté comme la sarcoïdose, la myocardite à cellules géantes, l’amylose, la maladie de Chagas et la maladie des dépôts de chaînes légères. Le pathologiste doit en être informé et conscient du risque de récidive. En particulier, la sarcoïdose et la myocardite à cellules géantes peuvent simuler un rejet aigu cellulaire.
Infection
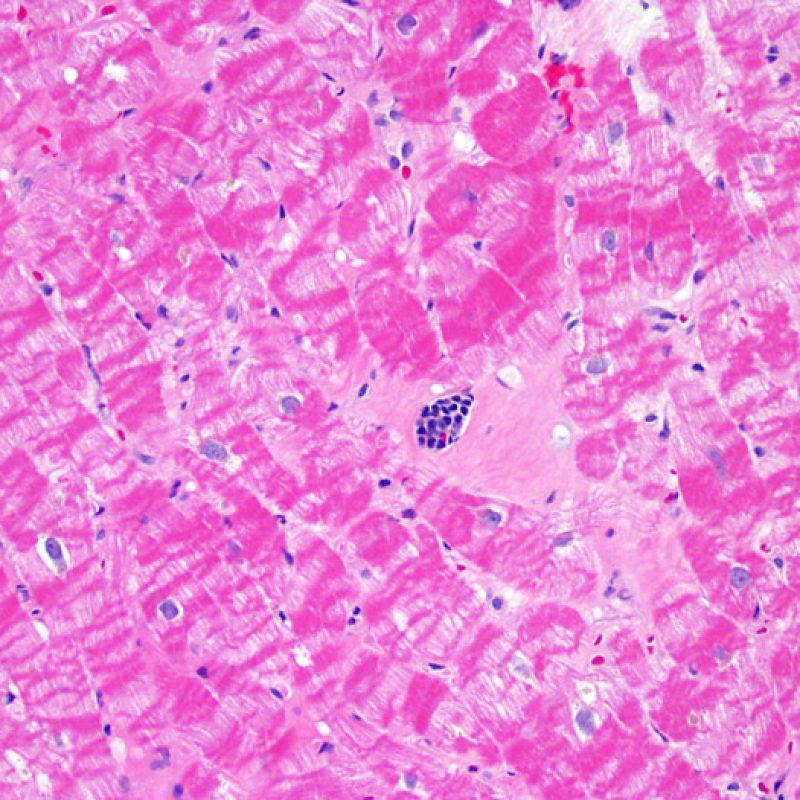
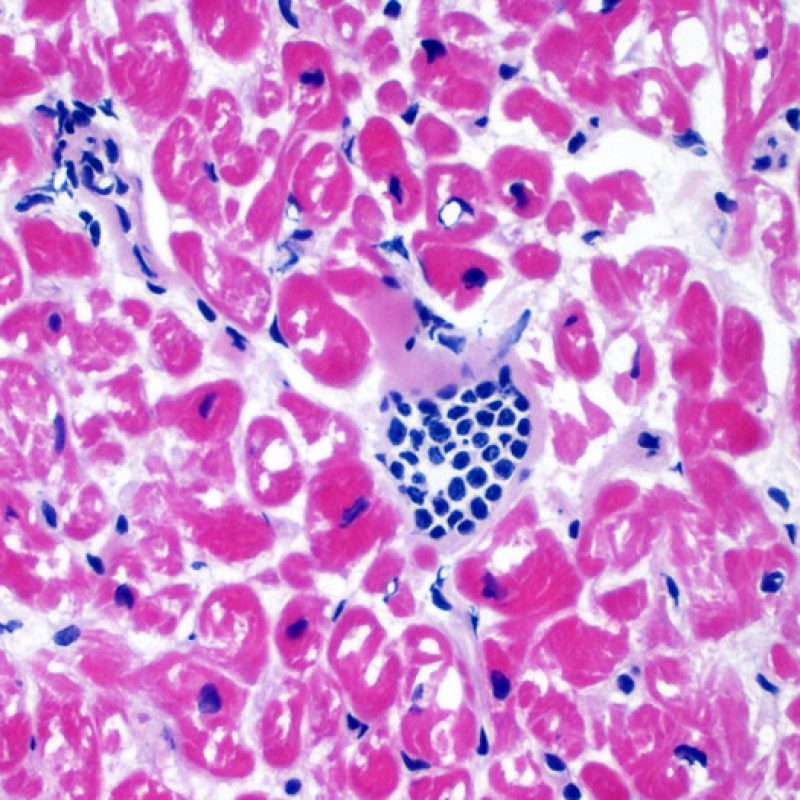
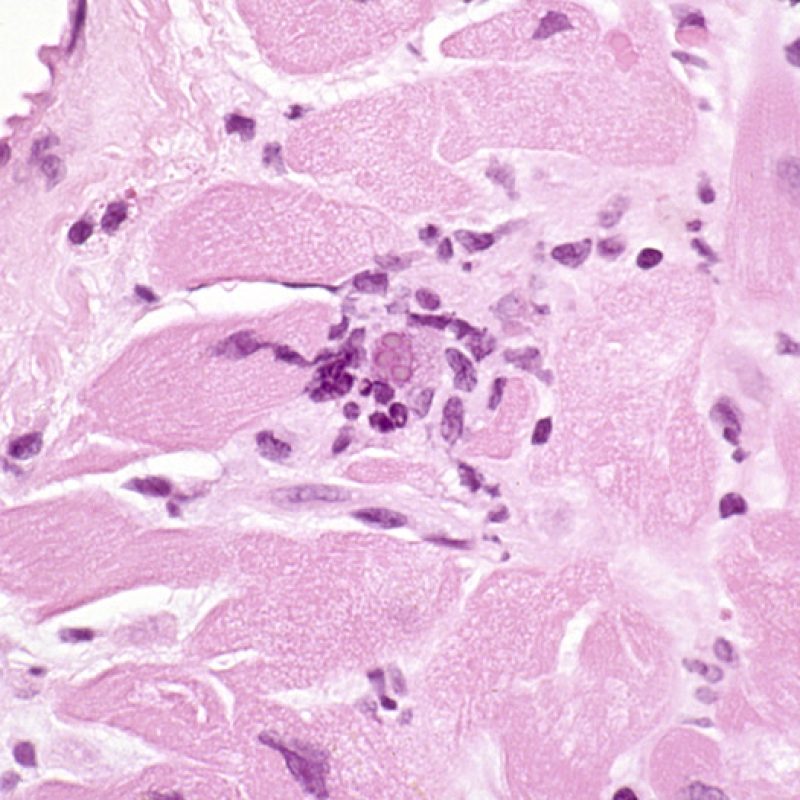
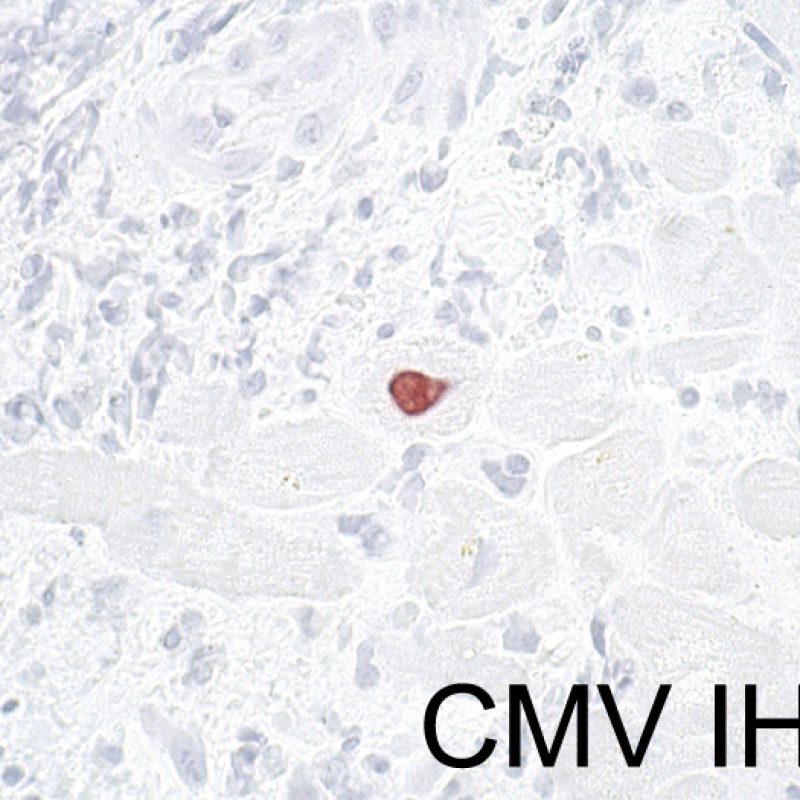
Il est très inhabituel de diagnostiquer une infection sur une biopsie endomyocardique, bien que les patients transplantés soient à haut risque infectieux en raison de leur immunosuppression. Le cytomégalovirus (CMV) a été décrit dans les biopsies cardiaques, mais il est plus facile d’identifier le statut CMV par sérologie (excepté si le receveur était initialement CMV négatif avant transplantation), ou dans d’autres tissus (ex. osophage). Cependant, il est possible de retrouver des inclusions virales sur les biopsies endomyocardiques. On peut alors demander une immunohistochimie pour confirmer l’infection par CMV ou par d’autres virus. Si l’infection est confirmée, cette information doit être signalée au clinicien, mais ne doit pas être confondue avec un rejet aigu cellulaire. La toxoplasmose peut aussi s’observer dans le cour transplanté. Des bradyzoïtes peuvent infecter les myocytes sans entrainer de réaction inflammatoire significative. Il est également possible de confirmer ce diagnostic par une technique d’immunohistochimie.
Syndrome lympho-prolifératif post-transplantation (PTLD)
Bien que le syndrome lympho-prolifératif post-transplantation (PTLD) soit assez fréquent (jusqu’à 6%) chez les patients transplantés, il est très inhabituel d’en faire le diagnostic sur une biopsie endomyocardique. Histologiquement, on observe typiquement des nappes de lymphocytes B mimant un rejet aigu cellulaire. Ces cas étant souvent EBV positifs, il est recommandé de faire une hybridation in situ pour l’EBV couplée à un immunomarquage des lymphocytes B (CD20). Ce diagnostic peut parfois être évoqué devant un patient non répondeur au traitement d’un rejet aigu cellulaire présumé. La présence de nombreux plasmocytes est inhabituelle et doit faire rechercher un PTLD de type plasmocytoïde. Les lymphomes T sont rarement en cause.
Corps étranger
En cas de biopsies itératives, de petits amas de cellules géantes à corps étrangers peuvent être observées dans l’endocarde. Elles peuvent contenir un matériel réfringent, correspondant vraisemblablement à des fragments de fibres de coton provenant de compresses utilisées pour nettoyer la pince à biopsie.
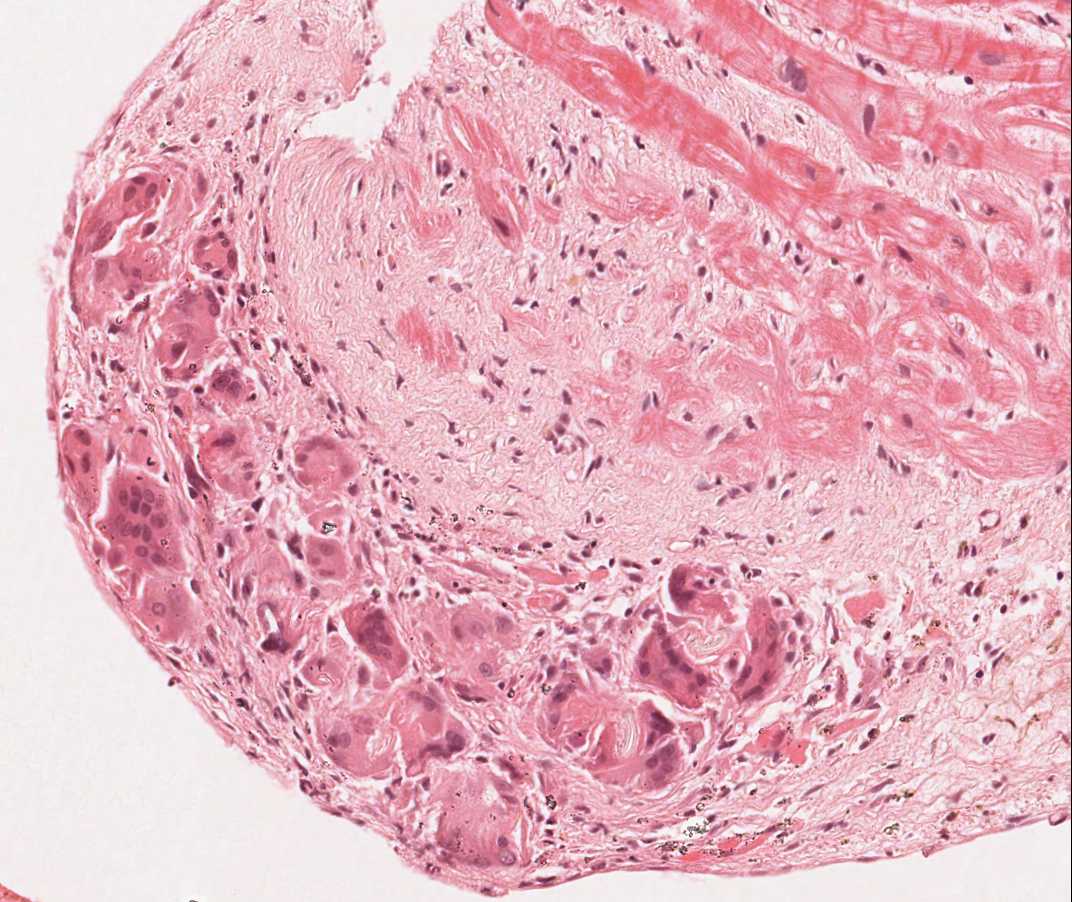
Fragments de valve tricuspide et fragments de foie
Environ 12% des patients transplantés développent un souffle tricuspidien dans les années suivant la transplantation. Les causes les plus fréquentes de régurgitation tricuspidienne post-transplantation sont l’insuffisance cardiaque congestive, la dilatation de l’anneau et l’hypertension artérielle pulmonaire. Une déchirure accidentelle du feuillet de la valve ou un accroc sur un cordage par la pince à biopsie lorsqu’elle traverse la valve tricuspide peuvent être incriminés. Si des fragments de ces structures sont présents sur la biopsie, le clinicien doit en être informé. Bien que les biopsies de fragments de cordage soient en général bien tolérées, une large défection du feuillet valvulaire peut affecter significativement la fonction du greffon. Un fragment de valve ou de cordage apparaîtra essentiellement sous la forme d’une fine bande de tissu fibreux avec des fibres élastiques alignées horizontalement dans le grand axe du matériel. De plus, des cellules endothéliales peuvent être vues sur chacune des faces, contrairement à un fragment d’endocarde épaissi, sans qu’il soit toutefois possible à chaque fois de faire cette distinction.
De façon très exceptionnelle, la pince à biopsie peut passer de façon inopinée de la veine cave supérieure à la veine cave inférieure, et la biopsie peut être effectuée sur le foie. Ainsi un fragment de foie sur une lame de biopsie peut venir soit du patient, soit d’une possible contamination par un autre prélèvement au laboratoire.
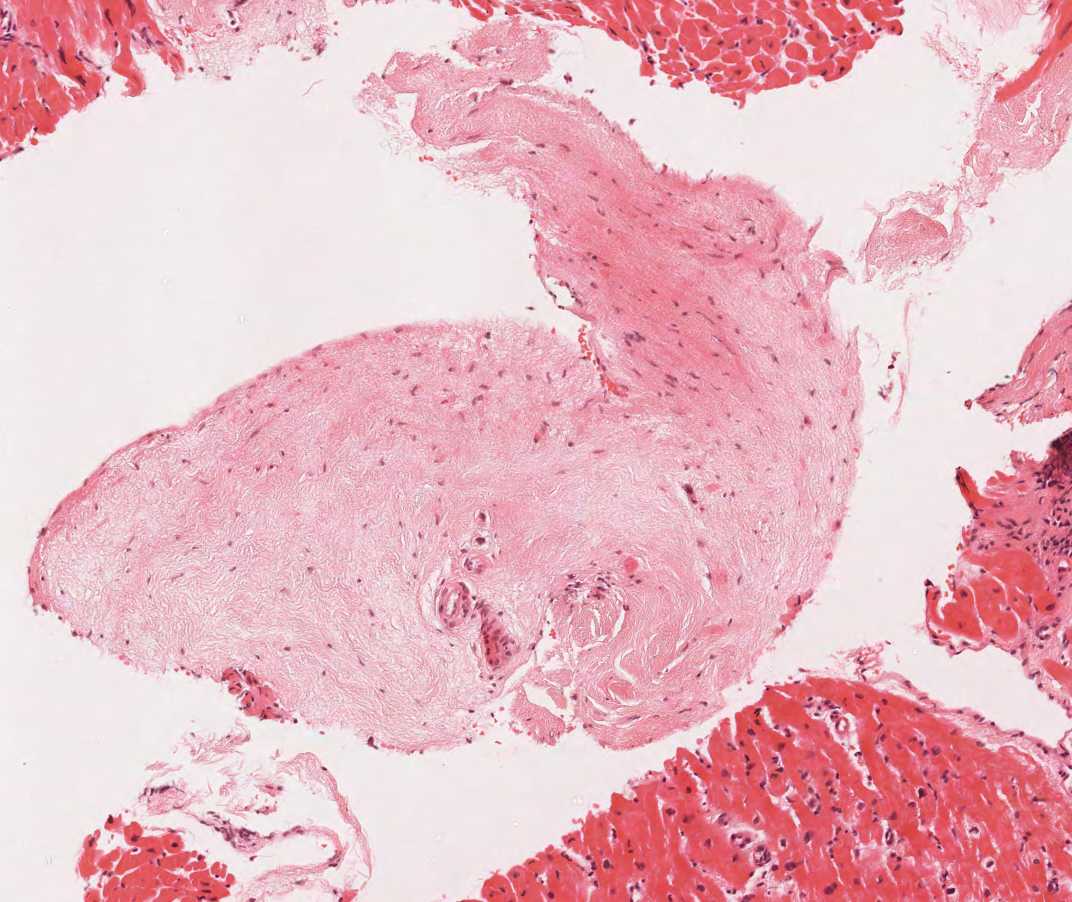
Artéfacts
Un certain nombre d’artéfacts peuvent être observés dans les biopsies endomyocardiques. Les plus importants sont illustrés ci-dessous. Ces artéfacts peuvent être interprétés à tort comme des lésions pathologiques significatives.
Bandes de contraction
Lorsque les biopsies endomyocardiques sont recueillies et mises dans le formol, elles doivent être manipulées délicatement afin d’éviter tout artéfact d’écrasement. Toutefois, même si elles sont manipulées de manière appropriée, la rétraction myocytaire est inévitable, car la biopsie est par définition un”bord de coupe” de myocarde. L’effet de bandes est accentué si le fixateur utilisé est froid et non à température ambiante. Les bandes Z deviennent plus épaisses et les sarcomères deviennent hypercontractés, mais les myofibrilles restent intactes. Il en résulte des bandes de contraction. Ceci est couramment observé, souvent de manière étendue, mais sans signification pathologique.
Ces bandes de contraction doivent être distinguées des bandes de contraction par nécrose / myocytolyse, observées dans les lésions de reperfusion post-opératoires, chez des patients traités par des inotropes dans des circonstances cliniques diverses et dans les cours de donneurs décédés d’hémorragie intra-crânienne. Ces formes de nécrose affectent des cellules isolées ou des petits groupes de cellules entourées de myocarde d’aspect normal. Les bandes Z unissant les myocytes sont cassées. Les myofibrilles des sarcomères se fragmentent et prennent une teinte basophile granuleuse en raison de la minéralisation due aux dépôts de calcium intracellulaire.
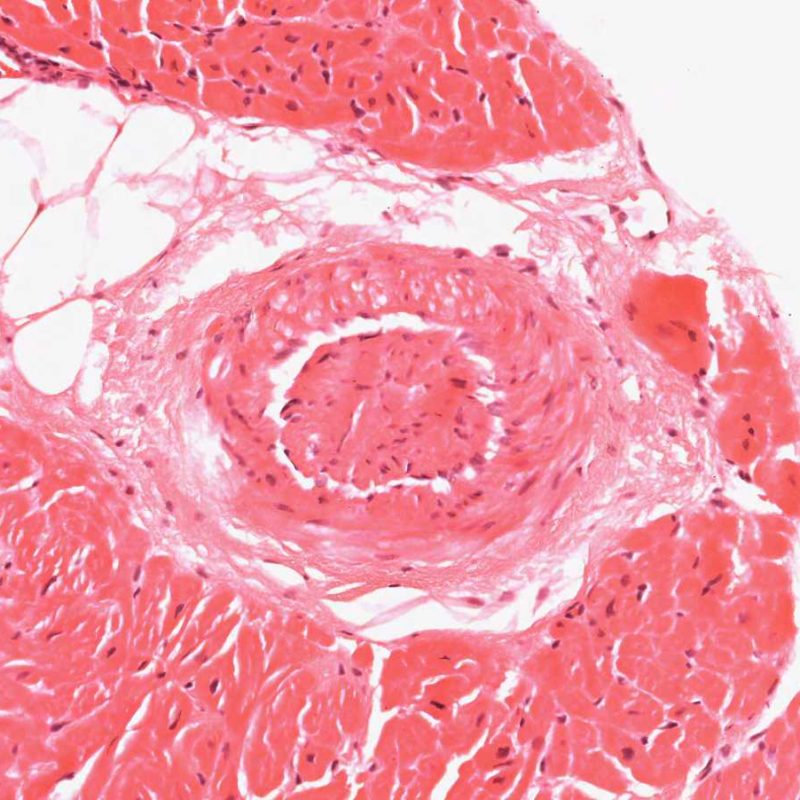
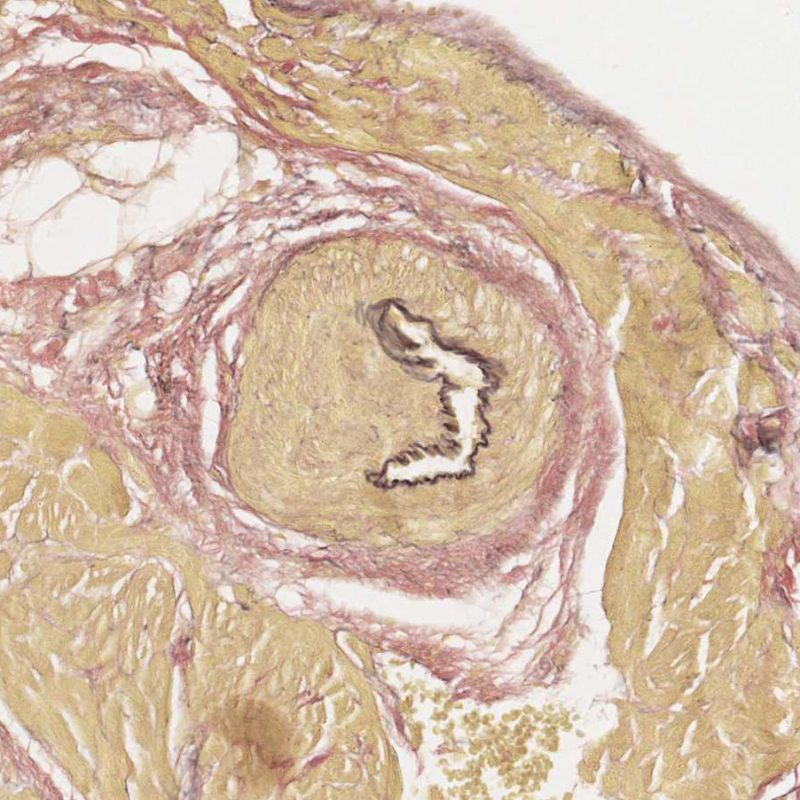
Télescopage de vaisseaux sanguins
Un artéfact fréquent intrinsèque à la biopsie est le « télescopage » de vaisseaux artériolaires par le mouvement de repli élastique de la média qui survient lorsque la pince à biopsie coupe et tire la biopsie du septum. Le vaisseau se replie sur lui-même et l’aspect obtenu peut être interprété à tort comme une vasculopathie d’allogreffe cardiaque (CAV), notamment, au niveau des petits vaisseaux cardiaques qui présentent une occlusion de leur lumière. Cependant, un examen attentif, associée à une coloration du tissu conjonctif, comme la coloration de Masson ou des fibres élastiques, met en évidence une intima normale et fait ressortir clairement les limitantes élastique interne et externe de la paroi du vaisseau.
Le télescopage n’a pas de signification clinique, mais est simplement le reflet du site de prise biopsique – proche du septum interventriculaire – où les petites branches qui y pénètrent à partir de l’artère interventriculaire antérieure, peuvent y être biopsiées par inadvertance. Cependant, la CAV peut être rarement diagnostiquée de cette manière ; il est donc recommandé de bien vérifier l’architecture des vaisseaux.
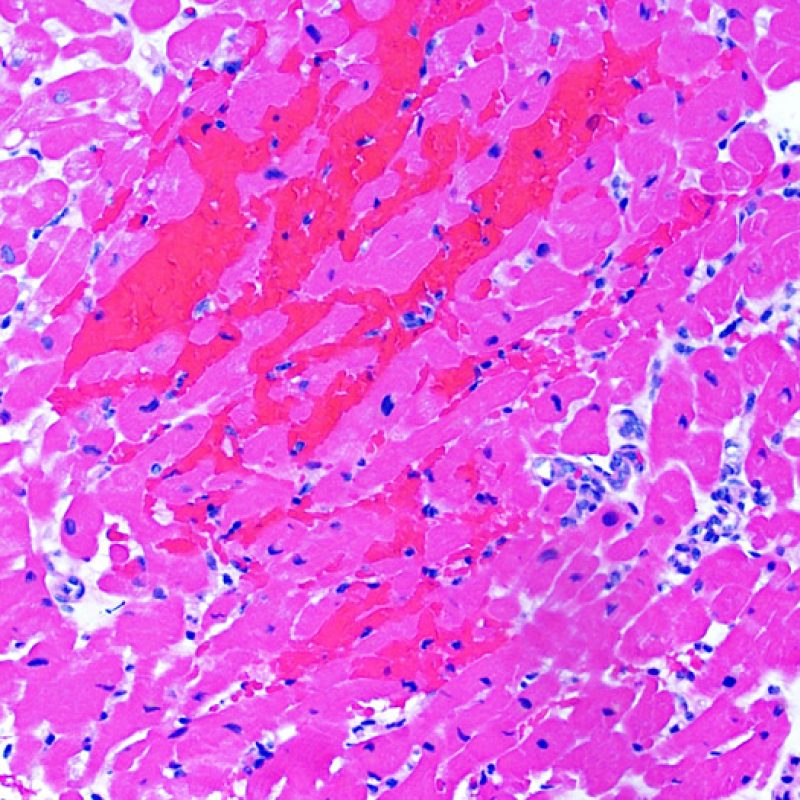
Hémorragie induite par la biopsie
Parfois l’obtention des biopsies peut induire une hémorragie du tissu. Contrairement à l’hémorragie vue dans le rejet sévère (Grade 3R), cette hémorragie n’est typiquement ni associée à une inflammation ni à un oedème.
Considérations sur la biopsie pédiatrique
Les biopsies de transplant cardiaque pédiatrique sont généralement lues dans les hôpitaux pédiatriques ou dans des institutions qui prennent en charge conjointement des adultes et des enfants. Les biopsies endomyocardiques de routine réalisées dans le suivi pédiatique sont moins fréquentes que chez l’adulte. Elles présentent parfois des spécificités qui vont être détaillées.
Taille de la biopsie
La taille des fragments biopsiques peut être significativement plus petite, notamment chez les enfants transplantés. Le calibre plus petit des vaisseaux et la plus petite taille du cour impliquent l’utilisation de pinces à biopsie de plus petite taille. Cependant, un minimum de 3 fragments de tissu doit être prélevé.
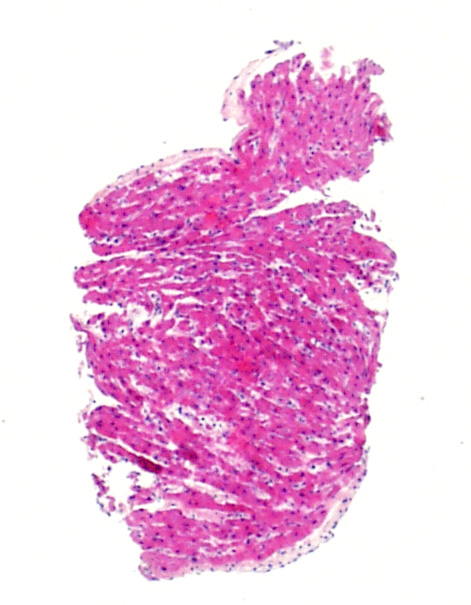
Impression de cellularité augmentée
Les myocytes de cour de nouveau né ou d’enfant sont plus petits que ceux de l’adolescent ou de l’adulte. Par conséquent, le rapport nucléo/cytoplasmique est tel que les biopsies paraissent plus cellulaires. Si vous êtes habitués à évaluer des biopsies d’adulte, il faut garder cette information à l’esprit et rechercher spécifiquement des lymphocytes. De plus, sur ces biopsies, les cellules endothéliales peuvent apparaître plus grosses et mieux ressortir sur la biopsie.
Fréquence du rejet
Dans l’un de nos centres, nous avons observé que le taux de rejet dans la population pédiatrique (1-18 ans) était à peu près le double de celui de la population générale. L’un des plus gros problèmes était l’observance du traitement chez les adolescents transplantés. Une autre cause potentielle est un système immunitaire plus performant chez les enfants que chez les personnes plus âgées. On peut raisonnablement avoir l’impression de voir plus souvent des rejets chez les patients pédiatriques que chez les adultes.