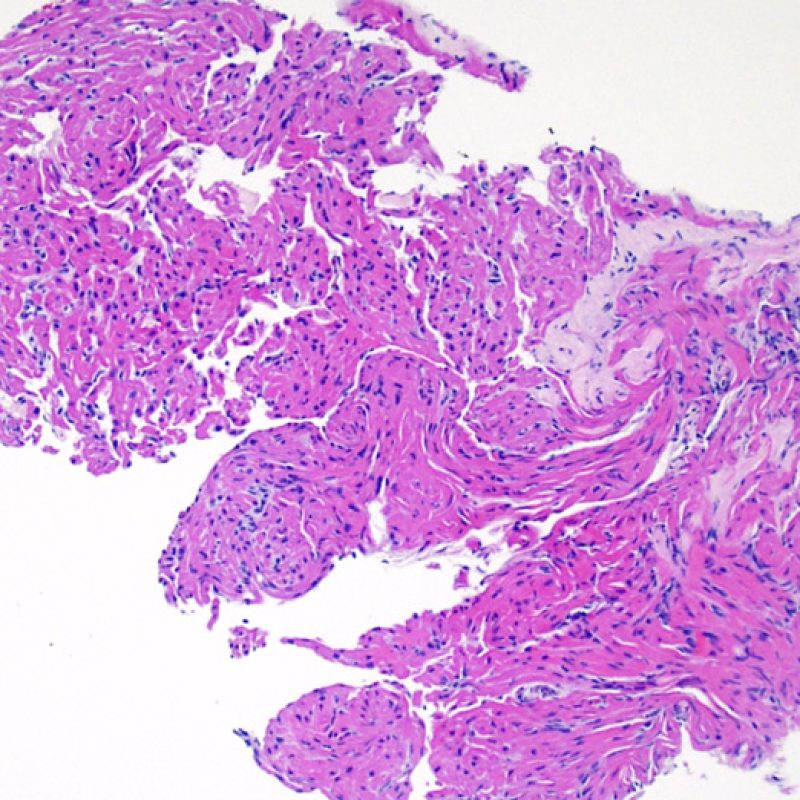
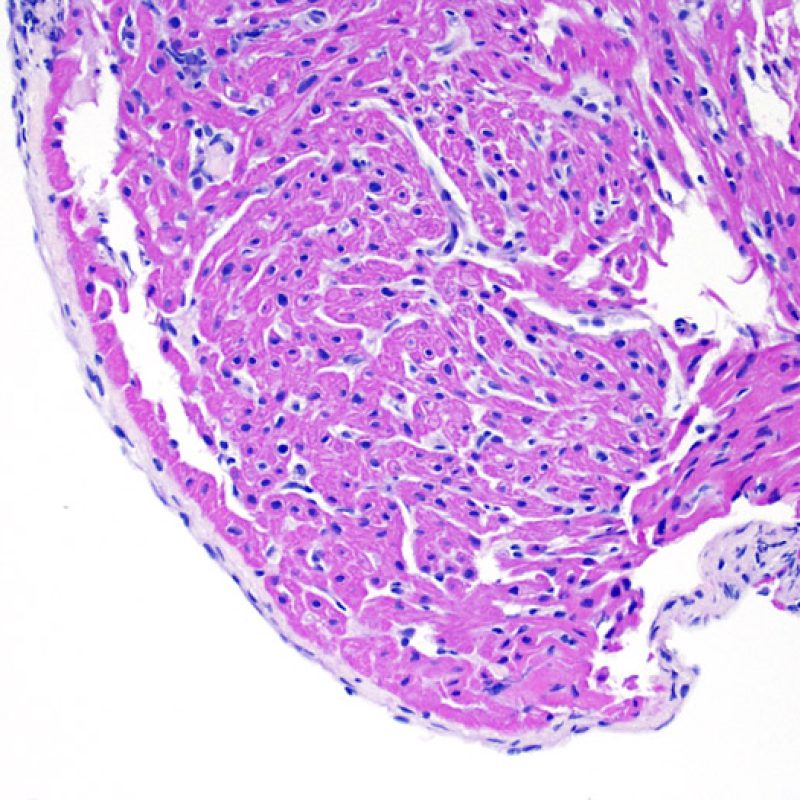
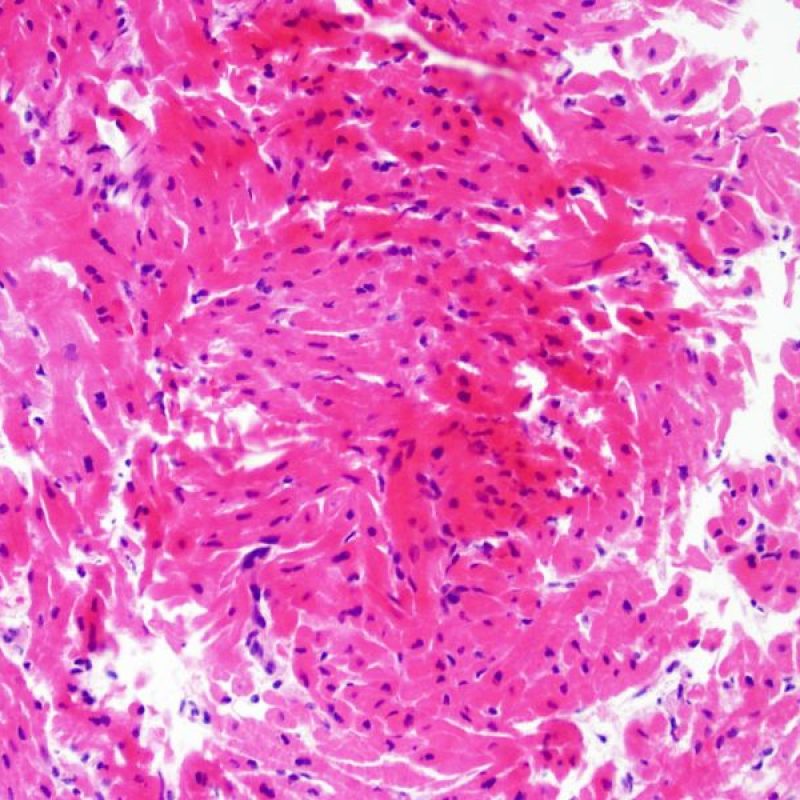
Presentazione
Benvenuti nel tutorial-web della Società per la Patologia Cardiovascolare (SCVP) e dell’Associazione per la Patologia Cardiovascolare Europea (AECVP) dedicato all’interpretazione dei reperti bioptici inerenti il rigetto cellulare acuto nel trapianto cardiaco. Il tutorial ha lo scopo di trasmettere ai patologi le informazioni necessarie e la metodologia per valutare i reperti istopatologici bioptici.
Il menu a tendina sulla sinistra comprende 7 paragrafi e vi consentirà di approfondire tutti gli aspetti utili all’interpretazione della biopsia endomiocardica; potrete anche selezionare, cliccando con il mouse, le parti che maggiormente vi interessano. Tutte le immagini possono essere ingrandite cliccando su ciascuna di esse (un singolo click sarà sufficiente per rimpicciolirle nuovamente). I quiz di auto-apprendimento vi consentiranno di verificare, su preparati istologici virtuali di casi routinari, il grado di apprendimento raggiunto nella diagnosi del rigetto cellulare e nella sua differenziazione da altri reperti istologici.
I membri della Commissione che hanno curato la progettazione e compilazione del tutorial sono elencati nella pagina dei ringraziamenti e sono i soli responsabili del materiale qui presentato. Il tutorial non affronta la tematica del rigetto anticorpo-mediato, al quale sarà dedicato uno spazio apposito.
La biopsia endomiocardica
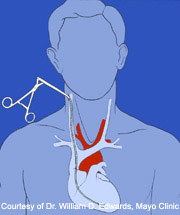
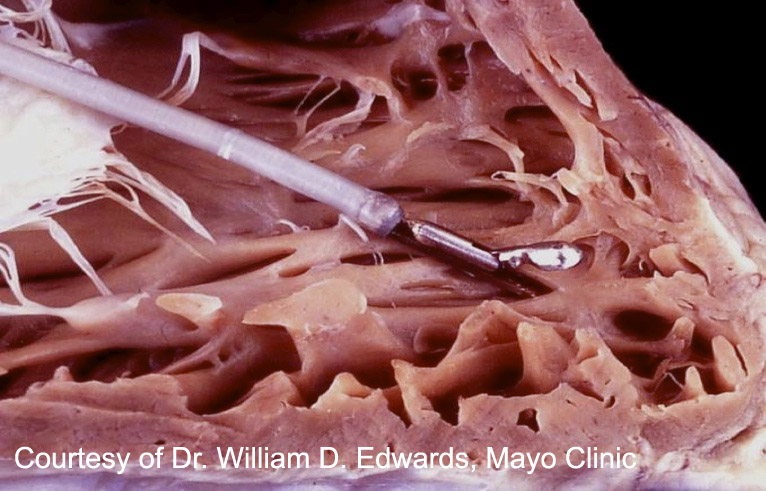
La tecnica più utilizzata per eseguire la biopsia endomiocardica (BEM) si avvale di un biotomo che, dopo essere stato introdotto nella vena giugulare interna (vedi schema), oltrepassa la valvola tricuspide e giunge nel ventricolo destro. I prelievi vengono effettuati dal setto interventricolare, in genere sotto guida fluoroscopica (meno frequentemente ecocardiografica). La procedura viene realizzata in anestesia locale.
L’indicazione più frequente alla BEM è rappresentata sicuramente dal monitoraggio del rigetto nel trapianto cardiaco, sia cellulo-mediato che anticorpo-mediato, nel quale rimane ancora oggi l’indagine più attendibile. La sorveglianza prevede l’esecuzione di numerose biopsie, soprattutto nei primi mesi dopo il trapianto, secondo i protocolli seguiti nei singoli centri; il numero delle BEM va successivamente decrescendo, sempre in base alle prassi seguite nelle differenti istituzioni.

Come trattare i prelievi bioptici
Prelievi da effettuare: Per poter valutare appropriatamente il rigetto, la Società Internazionale per il Trapianto di Cuore e Polmone (ISHLT) raccomanda il prelievo di almeno 3 campioni di miocardio ventricolare destro; tuttavia, la sensibilità diagnostica aumenta se si dispone di 5 frammenti bioptici. Bisogna sottolineare che i campioni vanno raccolti singolarmente e non tagliati dopo il prelievo per aumentarne il numero.
Manipolazione del tessuto: Il cardiologo dovrebbe rimuovere il campione dal catetere con un ago e posizionarlo su una garza imbevuta con soluzione salina isotonica. Il frammento bioptico va manipolato il meno possibile dopo il prelievo e, in ogni caso, non deve essere rimosso con le pinze.
Processazione dei campioni tissutali: Per la valutazione del rigetto, i campioni vanno immediatamente posti, e poi conservati, in formalina neutra tamponata al 10%. Vengono quindi inclusi in paraffina e tagliati e colorati secondo i protocolli in uso nel laboratorio. Se sono previste indagini in immunofluorescenza (ad esempio per il monitoraggio del rigetto anticorpo-mediato), è necessario prelevare un frammento supplementare e congelarlo istantaneamente.
Allestimento dei preparati istologici: Nella maggior parte dei Centri, si allestiscono 3 o 4 vetrini, in ciascuno dei quali vengono raccolte almeno 3 sezioni dello spessore di 3-5 μm. Alcuni centri raccolgono, invece, fino a 8 sezioni per singolo vetrino. Indipendentemente dal numero dei vetrini allestiti, è comunque importante esaminare almeno 10 sezioni.
Studi ancillari: Per valutare il rigetto anticorpo-mediato (AMR), vengono spesso già richieste, contemporaneamente alle sezioni colorate con Ematossilina-Eosina, le immunocolorazioni per il C4d (sia con tecniche di immunoperossidasi che di immunofluorescenza). In alcuni Centri, i protocolli per la diagnosi dell’AMR prevedono l’uso routinario del CD68 (un marker istiocitario) e del C3d.
Criteri di campionamento
Un campionamento adeguato dovrebbe prevedere almeno 3 frammenti bioptici, ciascuno dei quali costituito da miocardio per lo meno nel 50% della superficie. Se il materiale è insufficiente, bisogna verificare innanzitutto che tutti i frammenti presenti nell’inclusione siano stati adeguatamente scoperti. I pazienti trapiantati di cuore sono sottoposti a numerose biopsie di monitoraggio e poiché il biotomo tende spesso, per ragioni meccaniche, a direzionarsi nella stessa regione del ventricolo, è molto probabile trovare nei frammenti delle aree di fibrosi e di infiltrazione adiposa o tessuto di granulazione/cicatriziale formatosi nella sede di un precedente sito bioptico. Un cardiologo esperto nell’eseguire le BEM è comunque in grado di riconoscere, in base al colore e all’aspetto del frammento bioptico, se il prelievo è costituito da miocardio, da trombo o da tessuto fibroso.
Cosa fare se la biopsia è inadeguata:
- Se il rigetto (sia cellulo-mediato che anticorpo-mediato) è presente, va comunque riportato nel referto indipendentemente dall’adeguatezza dei campioni;
- se il rigetto è assente e il campionamento non soddisfa i criteri per l’adeguatezza, è opportuno segnalare con un commento la non idoneità della BEM e la possibilità che il risultato costituisca un falso-negativo.

Refertazione
Al fine di trasmettere in modo utile le informazioni salienti al cardiologo che ha in cura il paziente, il referto patologico dovrebbe essere conciso e standardizzato. Oltre alla valutazione del rigetto, andrebbero segnalati anche il numero dei campioni esaminati, quelli interessati dal rigetto, la presenza di lesioni Quilty, eventuali aspetti riferibili ad infezioni o la presenza di lesioni ischemiche.
Riportiamo qui accanto un modello di refertazione patologica.

Classificazione e gradazione del rigetto
Questa parte del tutorial illustra la revisione dei sistema di gradazione del rigetto cellulare effettuata nel 2004 dalla Società Internazionale per il Trapianto di Cuore e Polmone (ISHLT).
Panoramica
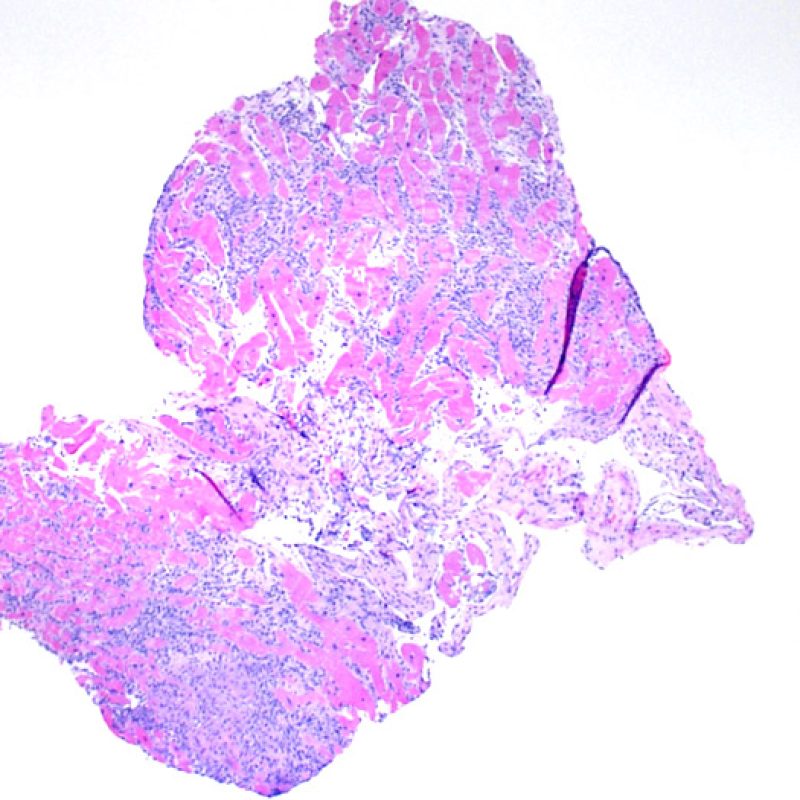
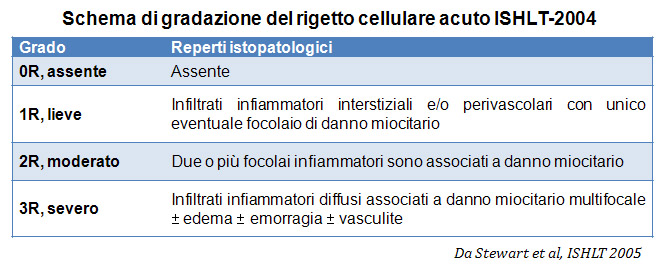
Nel 1990 la Società Internazionale per il Trapianto di Cuore e Polmone (ISHLT) ha formulato un sistema standardizzato di gradazione per la valutazione del rigetto cellulare acuto su biopsia endomiocardica. Poichè nel 2004 i criteri di questo sistema sono stati rivisti ed aggiornati, oggi sono talvolta denominati ISHLT-2004. La nuova classificazione prevede 4 gradi di rigetto: 0R, 1R, 2R e 3R. La lettera R (“modificato”) è stata apposta per non creare confusione con la precedente gradazione ISHLT del 1990 (0, 1A, 1B, 2, 3A, 3B, 4). Nella maggior parte dei Centri, i gradi 0R ed 1R non implicano un’ulteriore terapia immunosoppressiva, mentre i gradi 2R e 3R vengono trattati con un incremento dell’immunosoppressione. Di conseguenza, è fondamentale che il patologo sappia distinguere i quadri di rigetto a basso grado (0R e 1R) da quelli ad alto grado (2R e 3R).
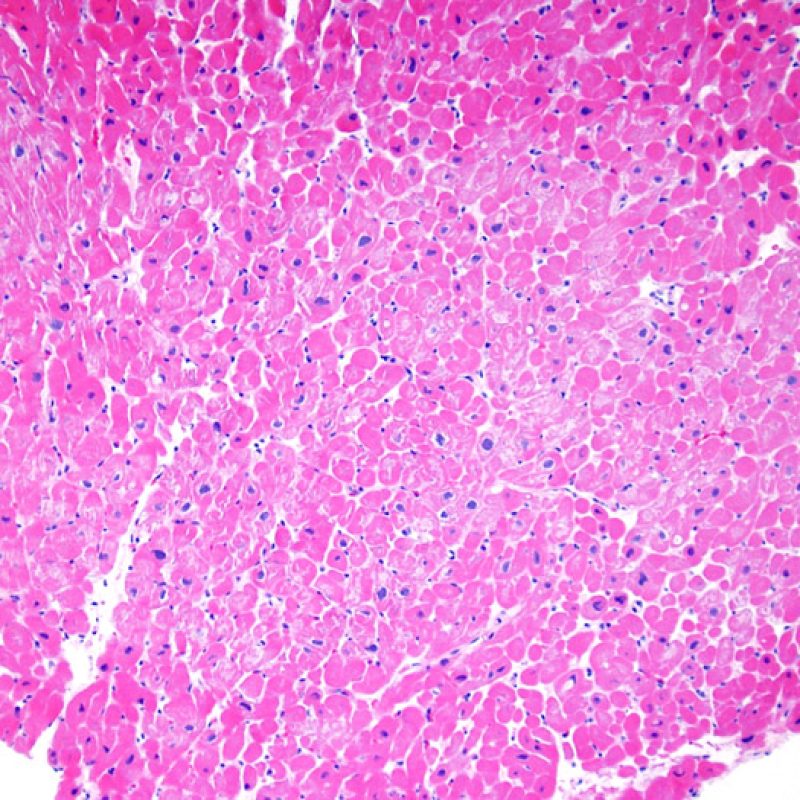
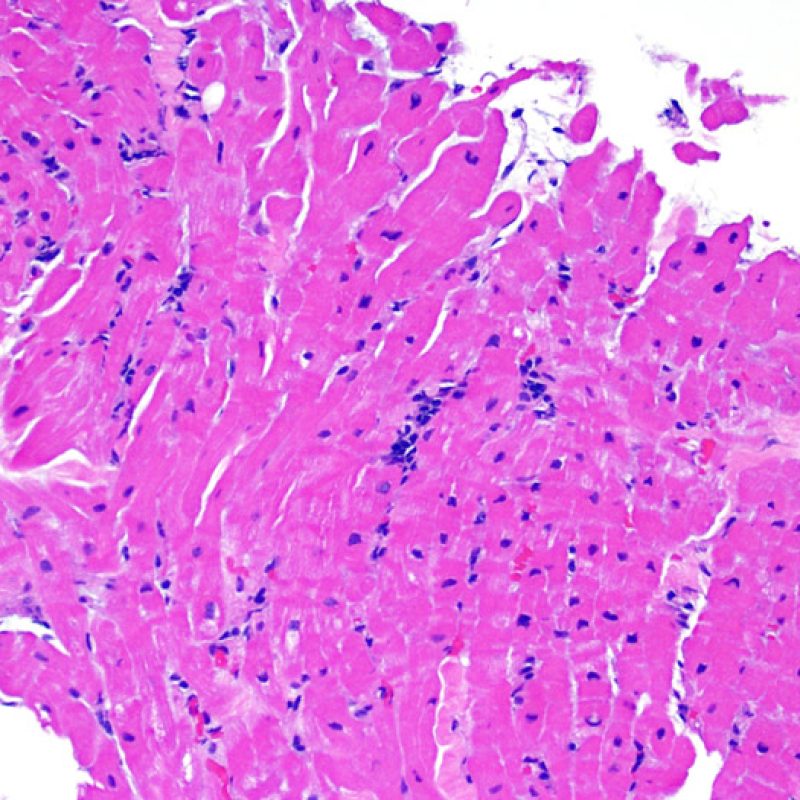
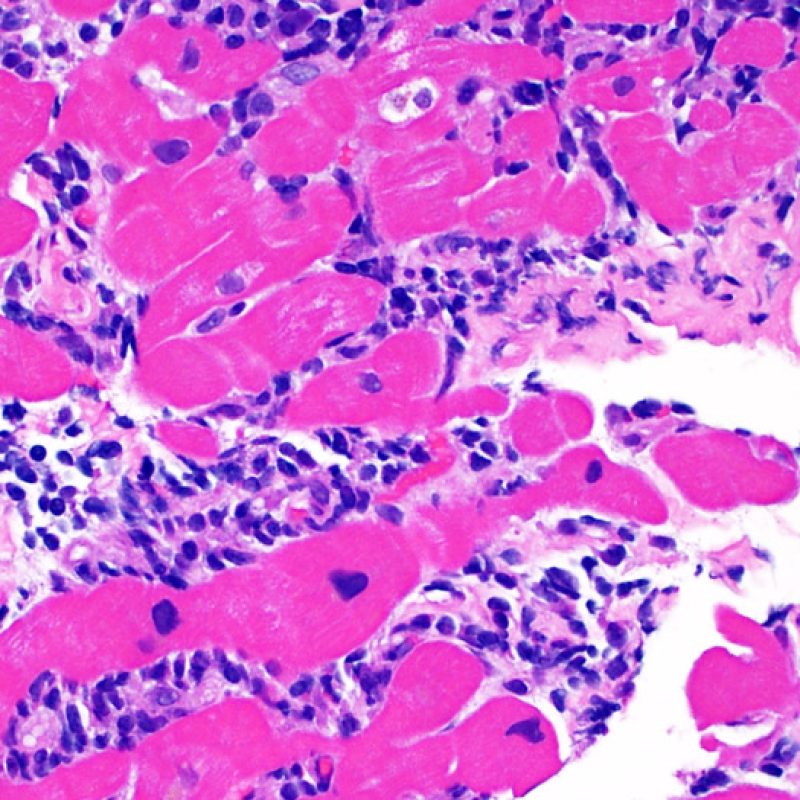
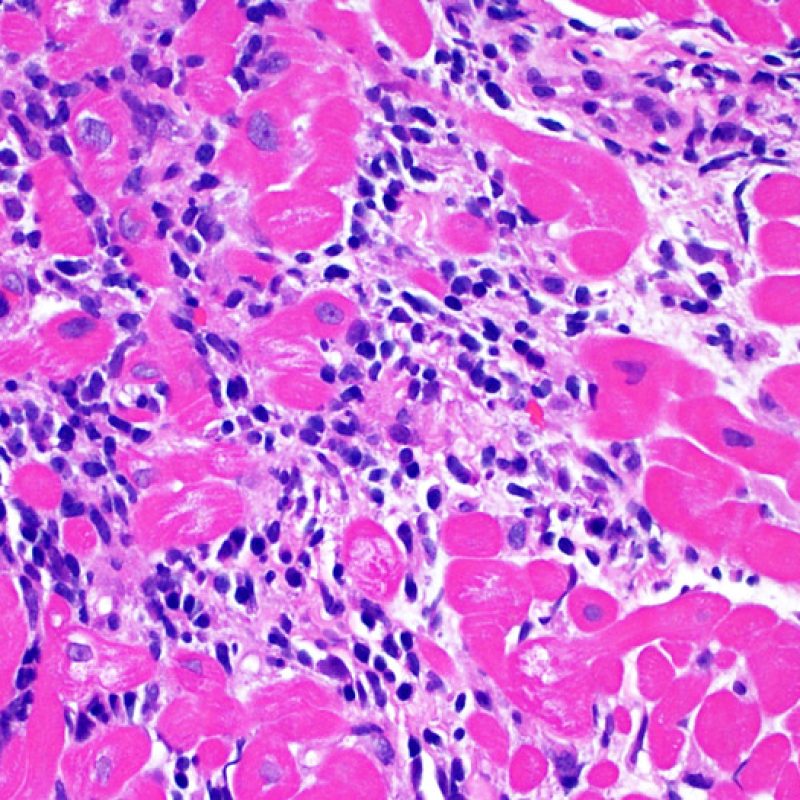
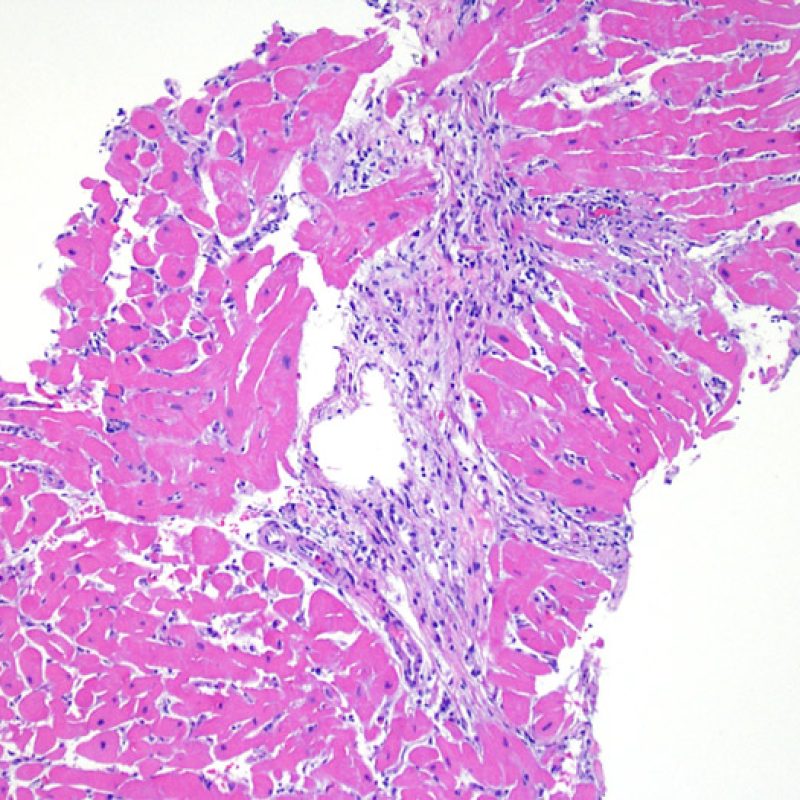
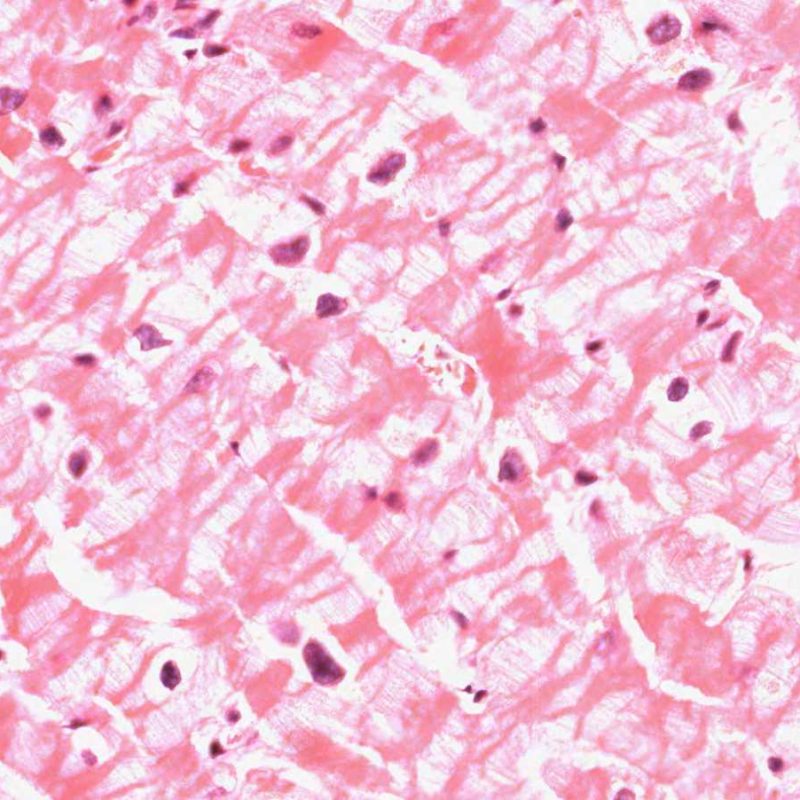
I due elementi cardine del rigetto cellulare acuto sono rappresentati dai linfociti e dal danno miocitario. Possono anche essere presenti altri reperti: alcuni mimano o sono indizio di rigetto, altri rappresentano degli artefatti, altri ancora sono indicativi di altre patologie. E’ importante comunque ribadire che gli elementi chiave per la diagnosi di rigetto sono solo gli infiltrati infiammatori ed il danno miocellulare.
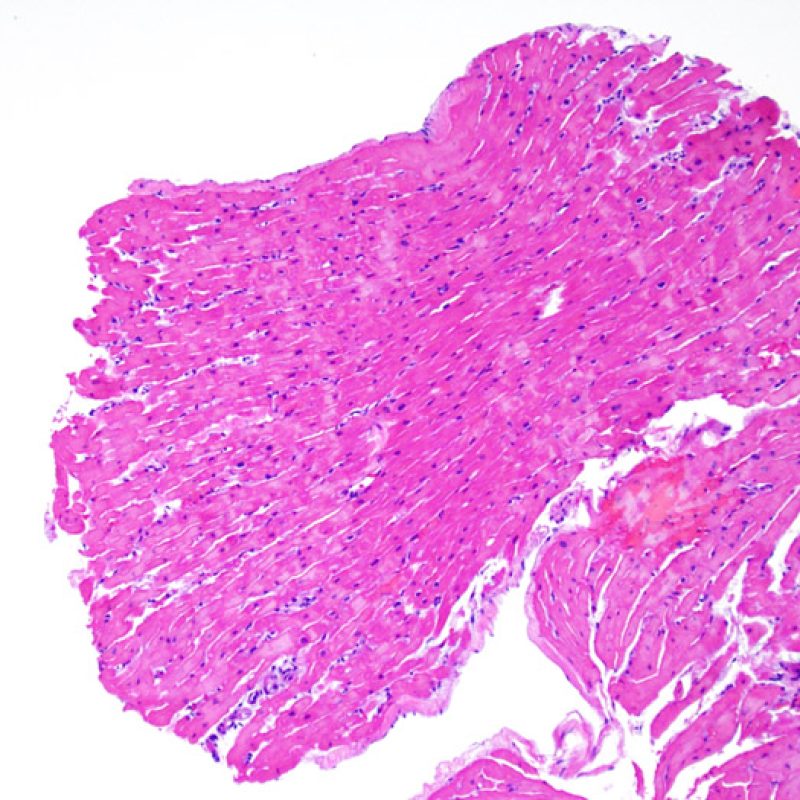
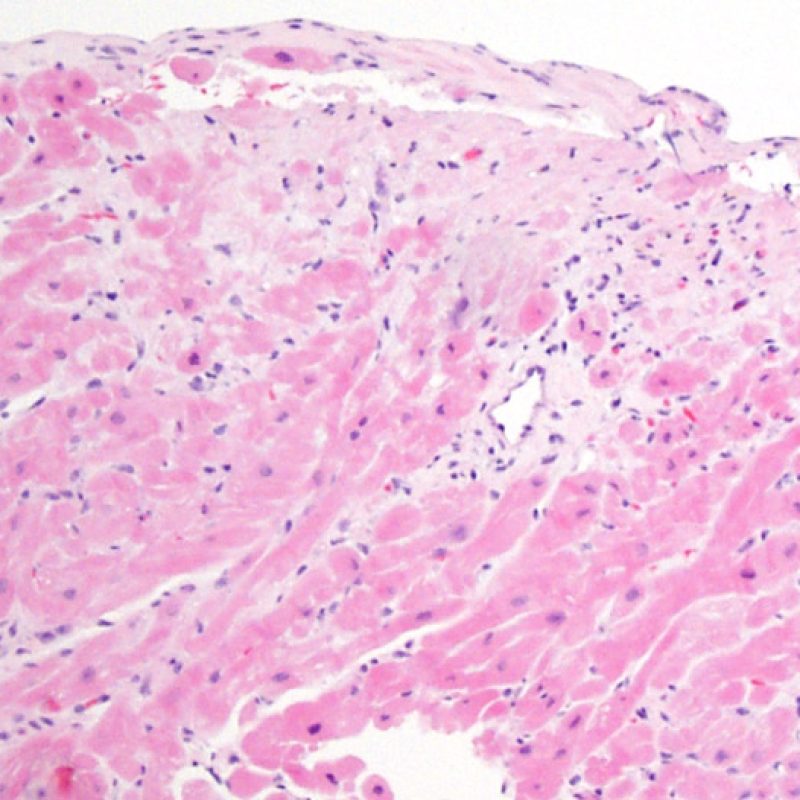
Assenza di rigetto (0R)
Il grado 0R – non evidenza di rigetto – è caratterizzato dall’assenza degli infiltrati infiammatori. Il quadro istologico corrisponde a quello di una biopsia pulita, con un endomiocardio non alterato. Altre lesioni eventualmente presenti, quali il cd effetto Quilty o le alterazioni da precedente sito bioptico, vanno segnalate separatamente, ma non intervengono nella definizione del grado di rigetto.
Rigetto lieve (1R)
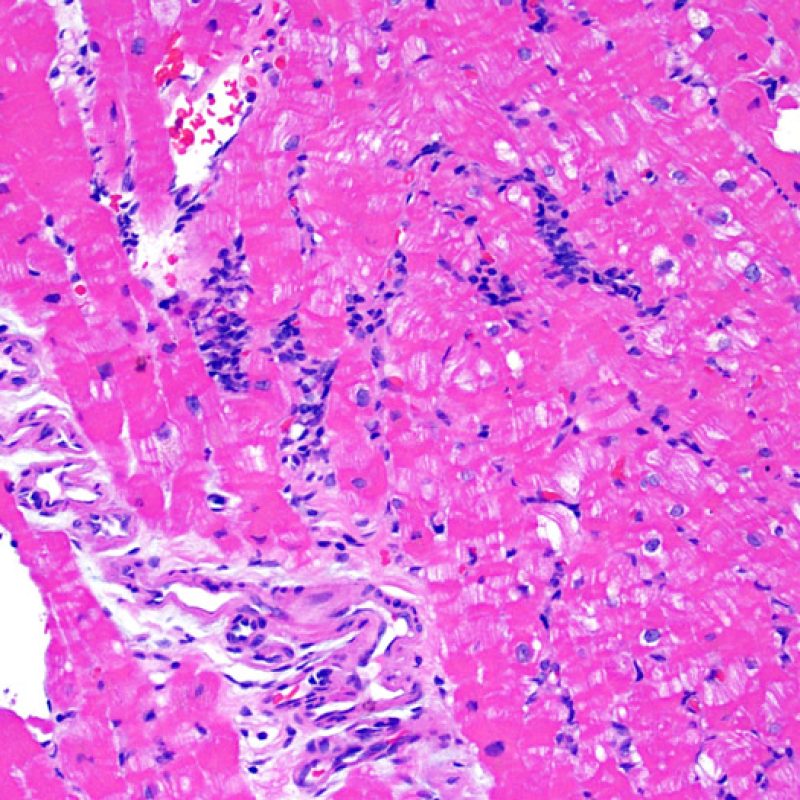
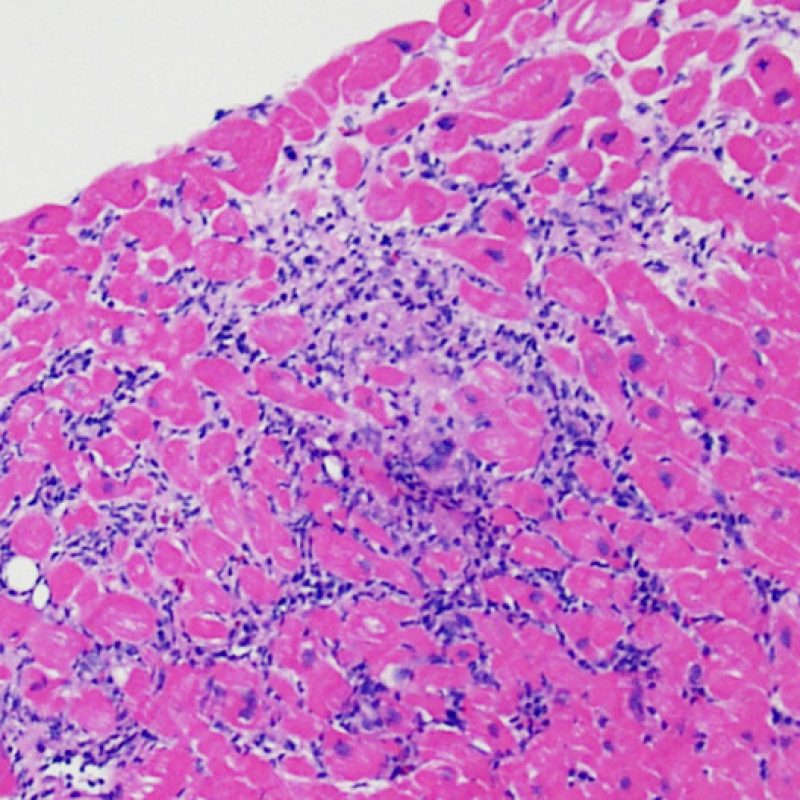
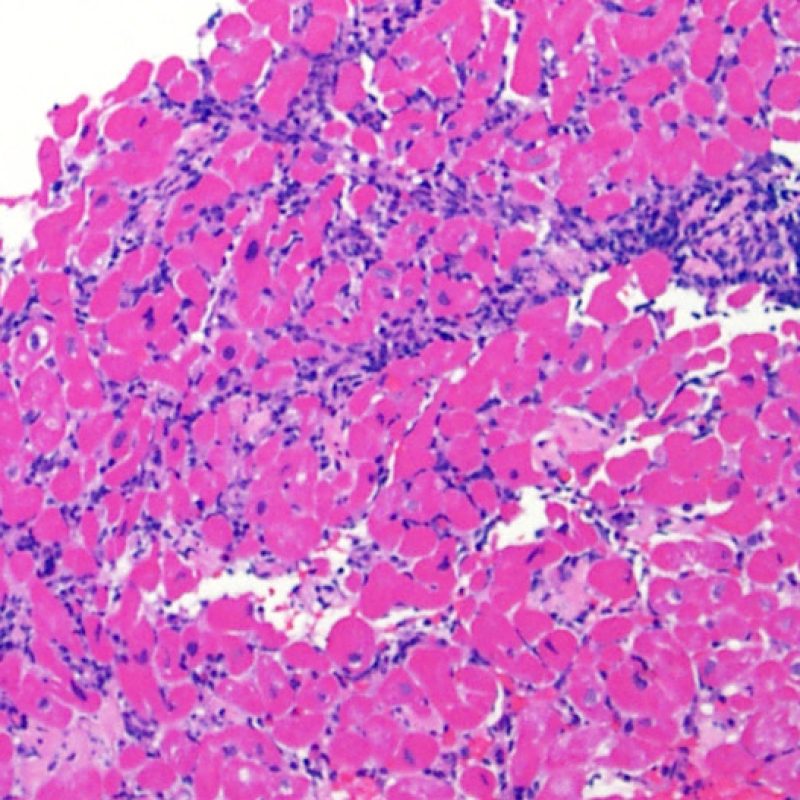
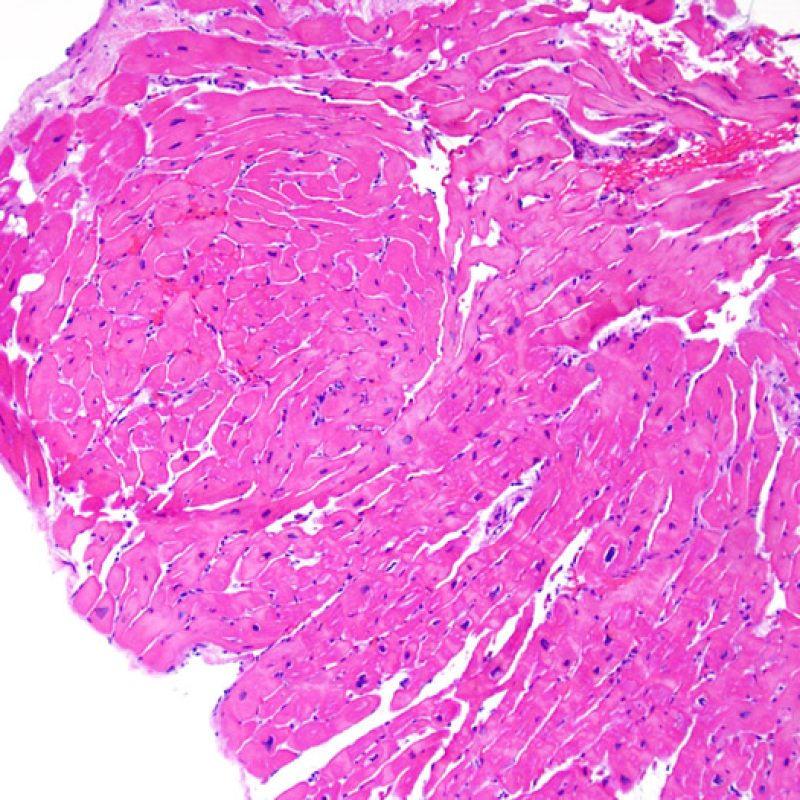
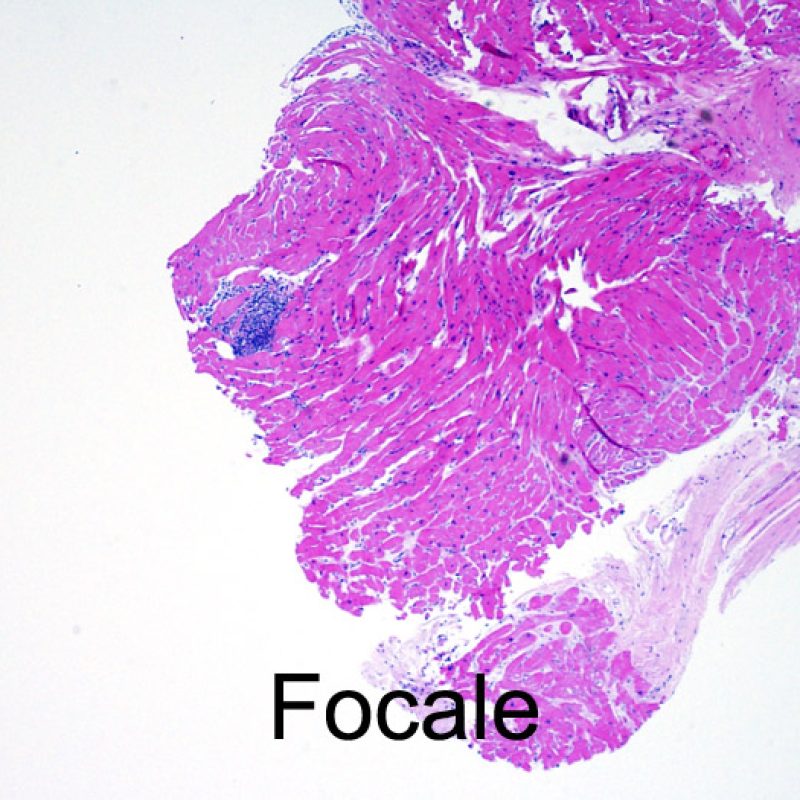
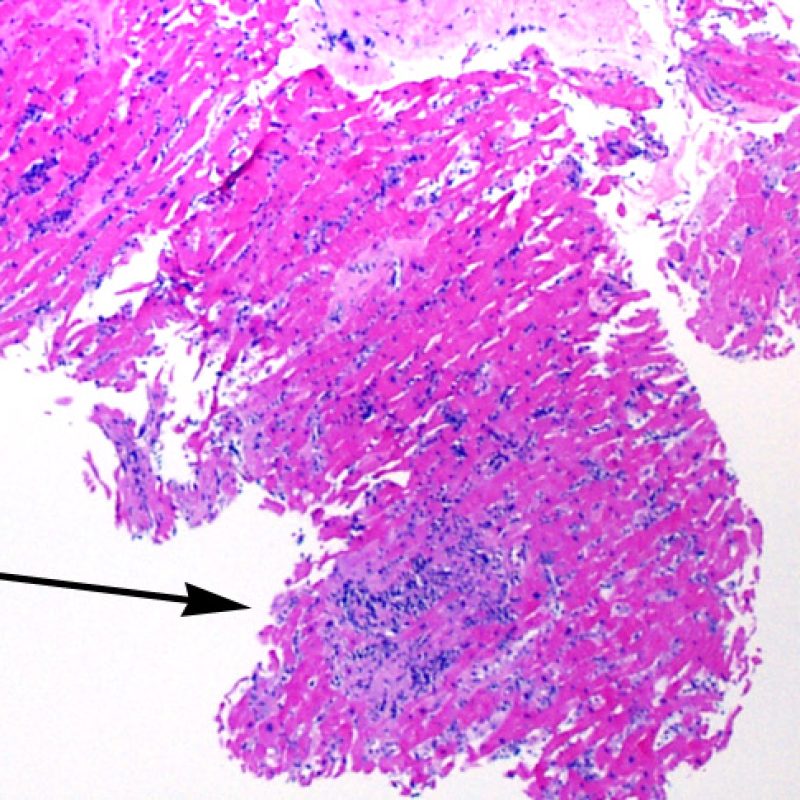
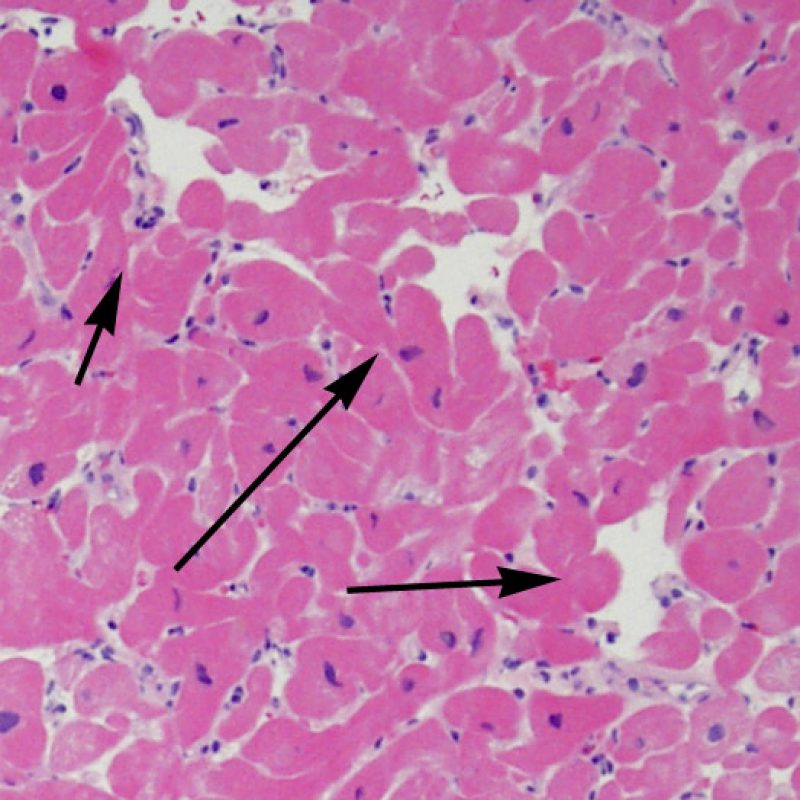
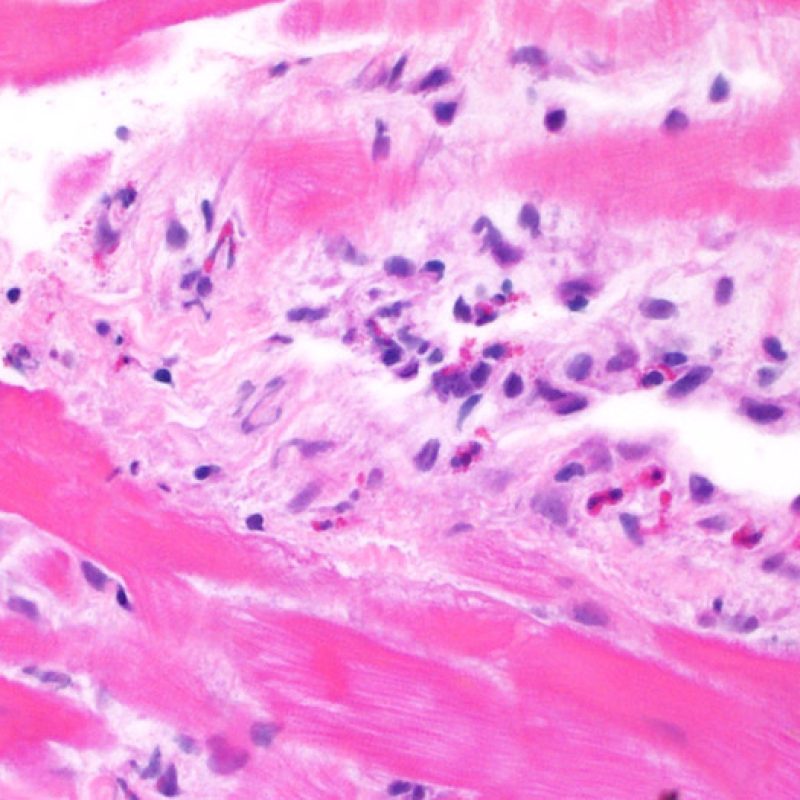
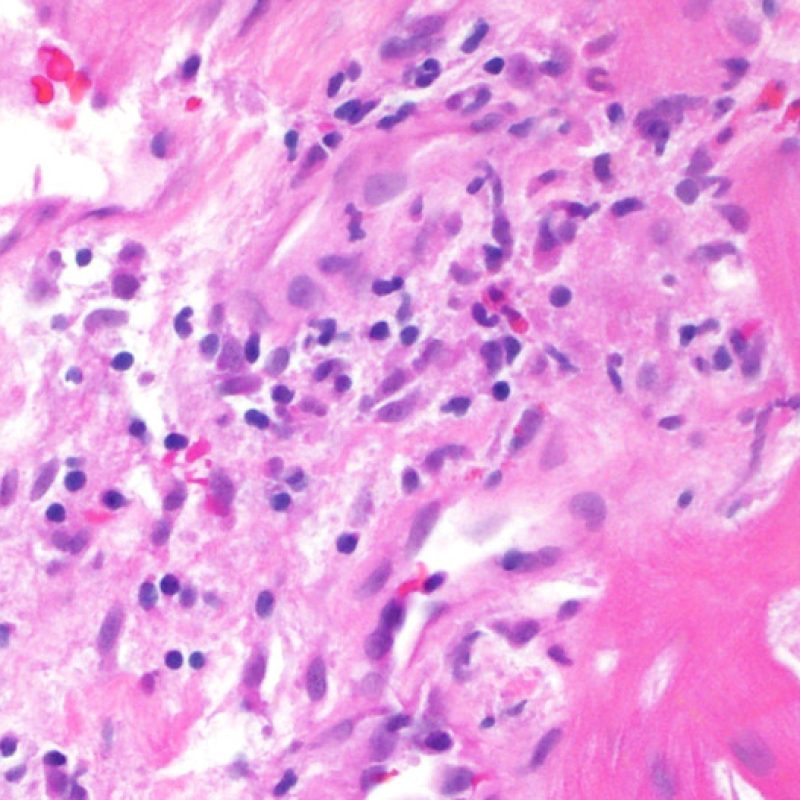
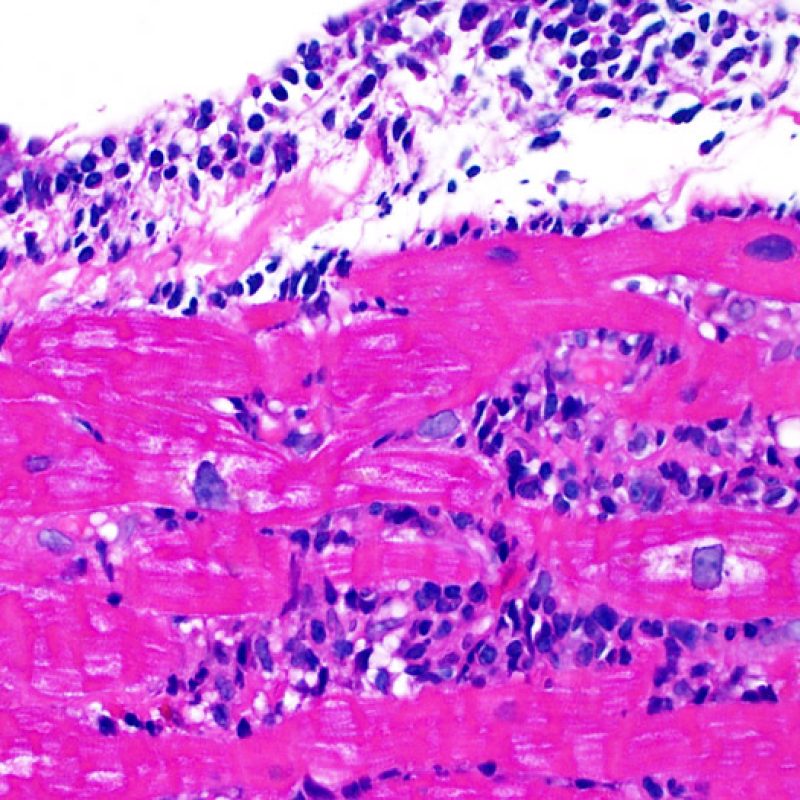
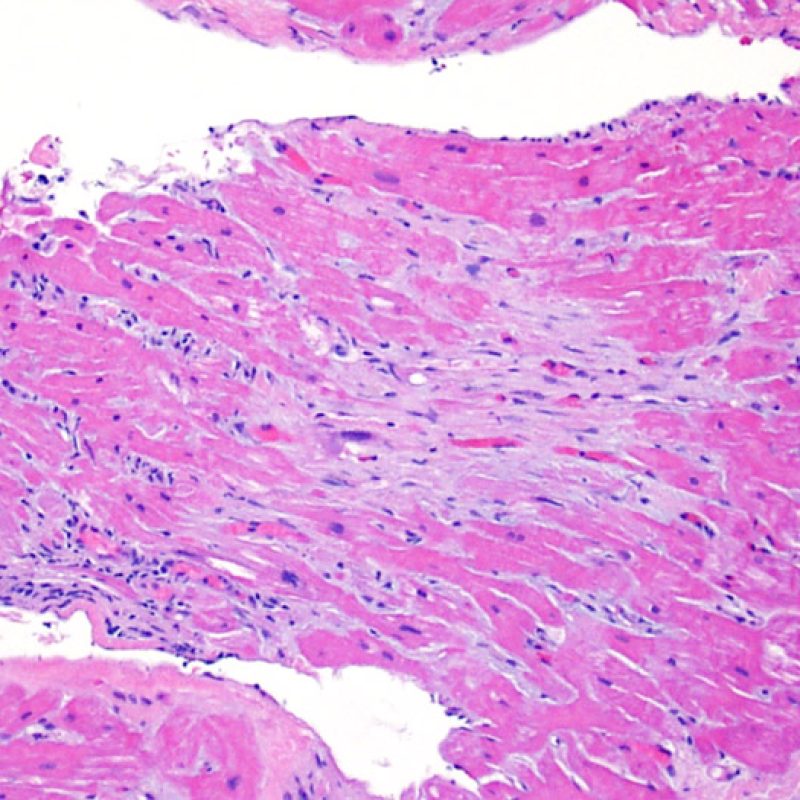
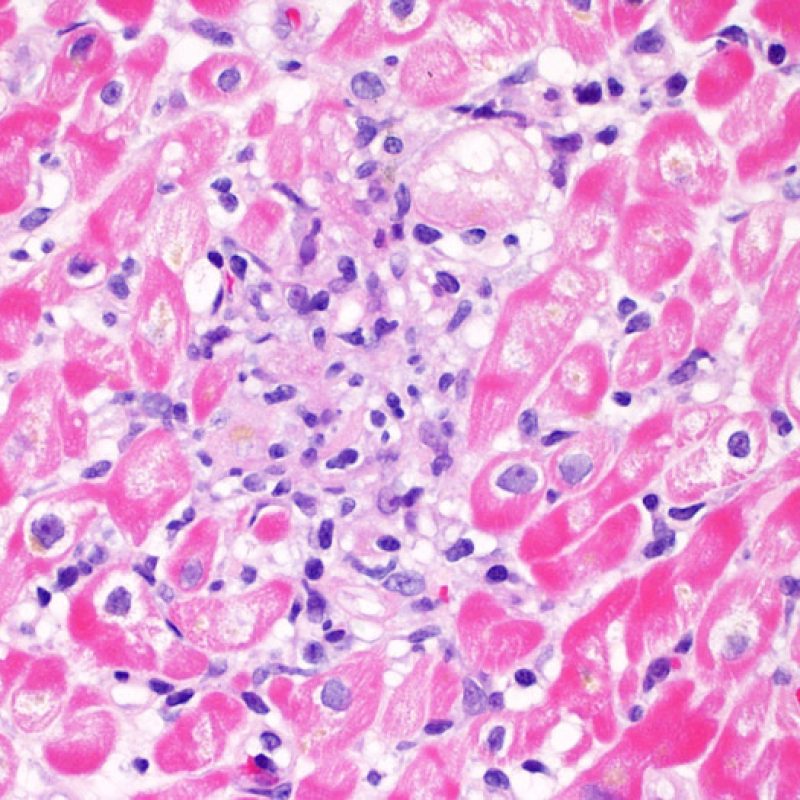
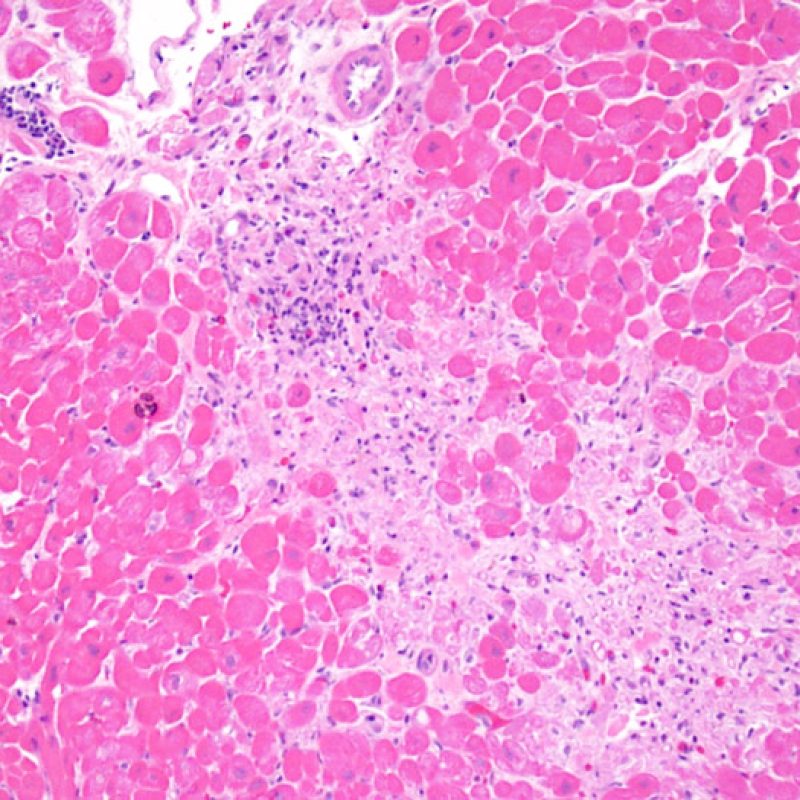
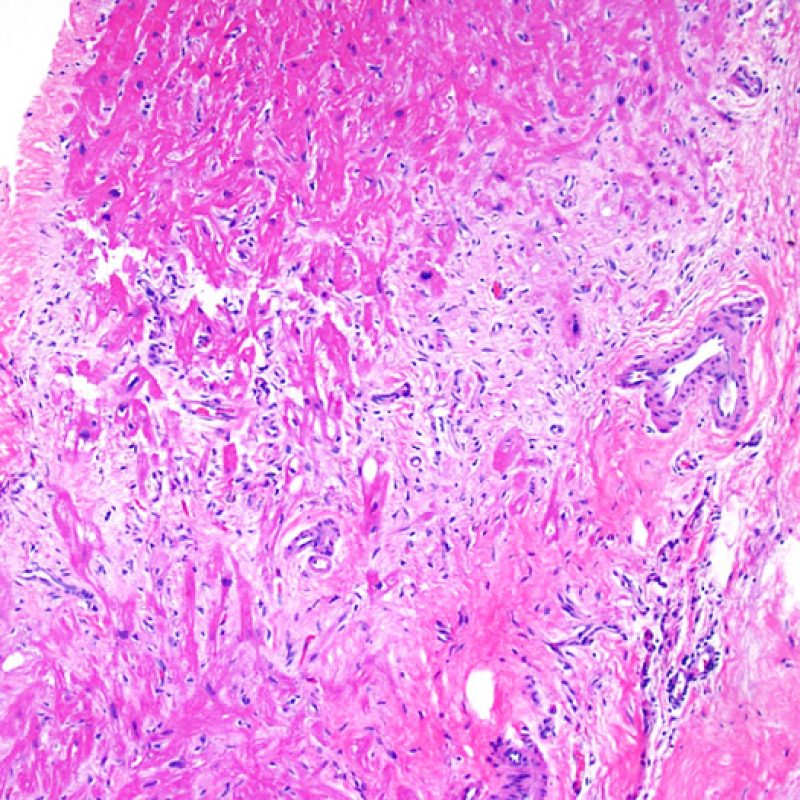
Il rigetto lieve (1R) è caratterizzato dalla presenza di infiltrati infiammatori interstiziali e/o perivascolari con un unico eventuale focolaio di danno miocitario associato. Questa definizione comprende un’ampia gamma di quadri bioptici, nei quali il numero dei linfociti ed il loro pattern di distribuzione può variare sensibilmente: si possono trovare pochi linfociti perivascolari o estesi infiltrati infiammatori, tipicamente non associati a danno miocitario, se non in un singolo focolaio. L’estensione dell’infiltrato flogistico può essere simile a quello del grado 2R, ma se ne distingue appunto per l’entità del danno miocitario. In genere, i leucociti polimorfonucleati eosinofili e neutrofili sono assenti. Le biopsie che contengono un solo focolaio di danno miocellulare sono particolarmente problematiche: tale focolaio può, infatti, essere espressione di un effetto Quilty che sta mimando il danno miocitario o anche di una biopsia scarsamente adeguata. E’ opportuno comunque che, in presenza di un quadro di rigetto 1R con un significativo infiltrato infiammatorio o con un singolo focolaio di danno miocellulare, il patologo discuta tali reperti con i clinici.
Rigetto moderato (2R)
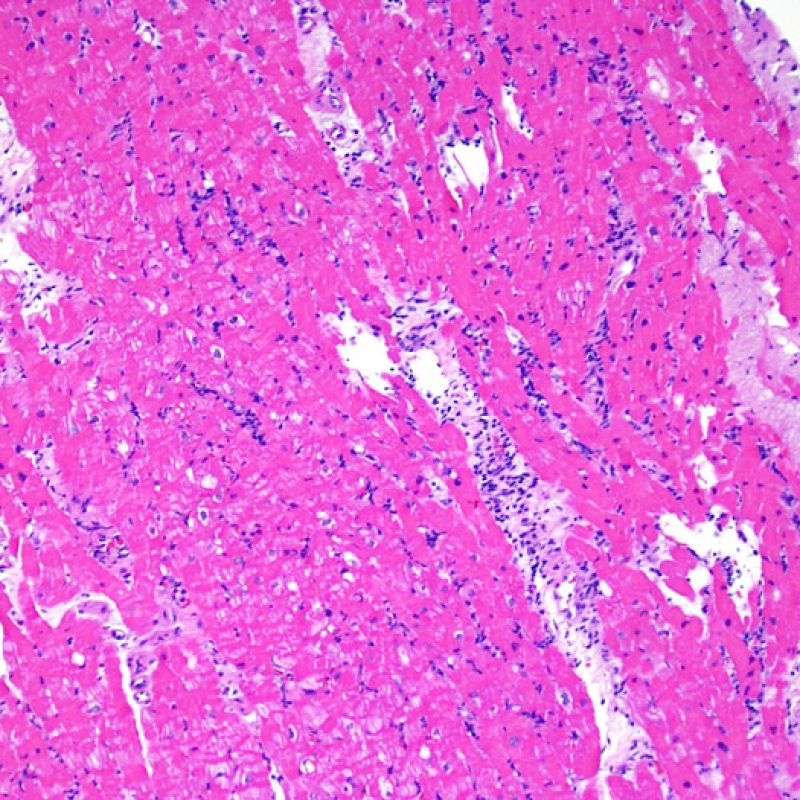
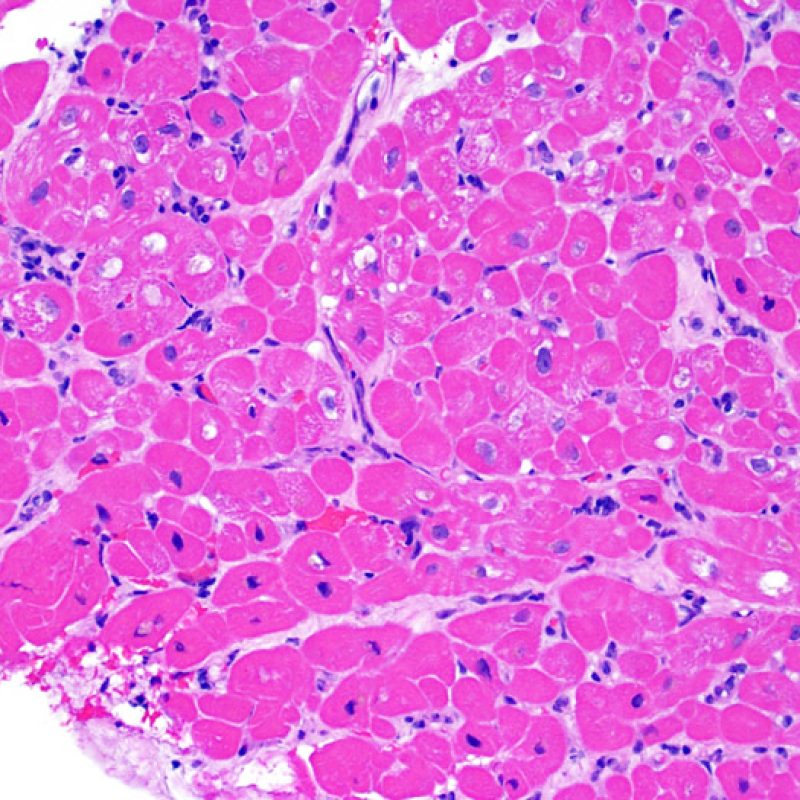
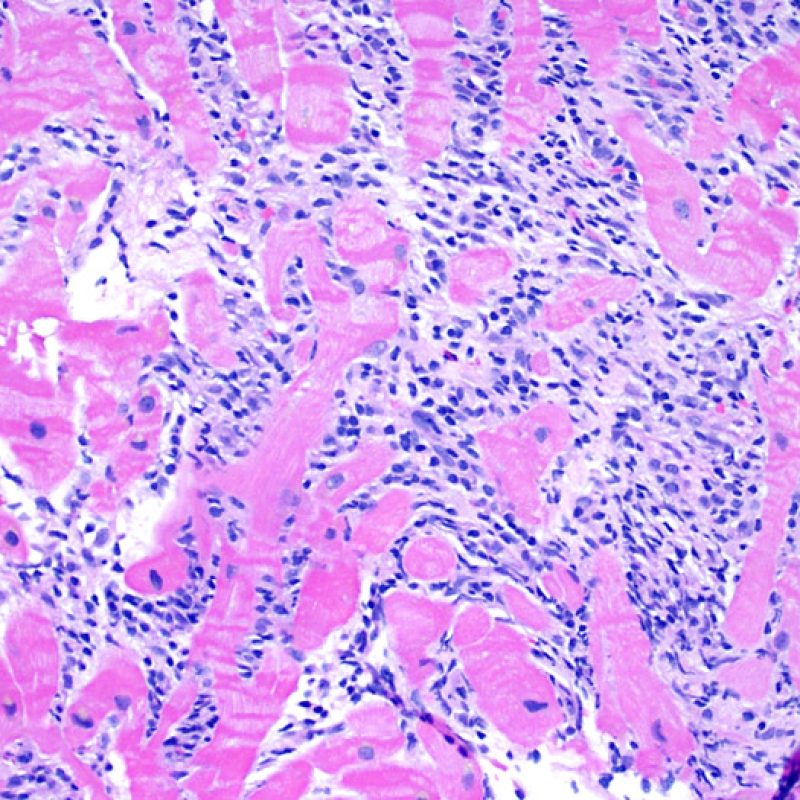
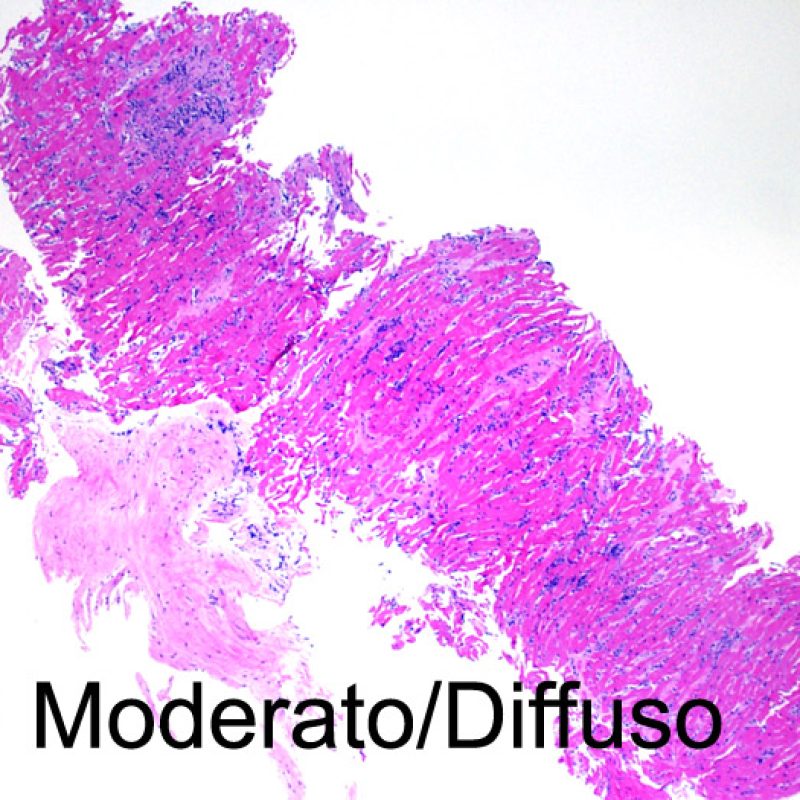
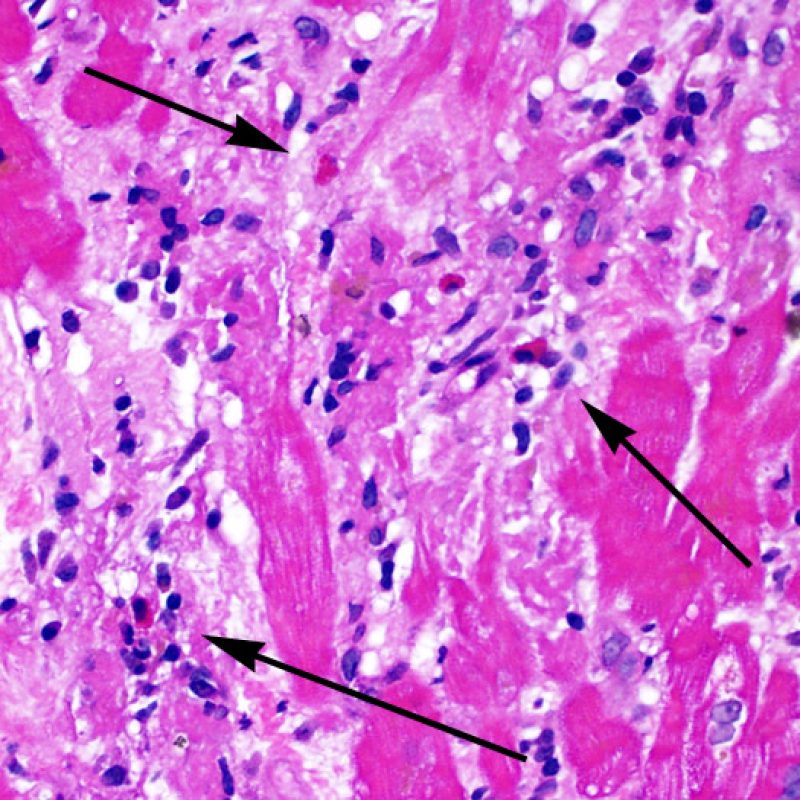
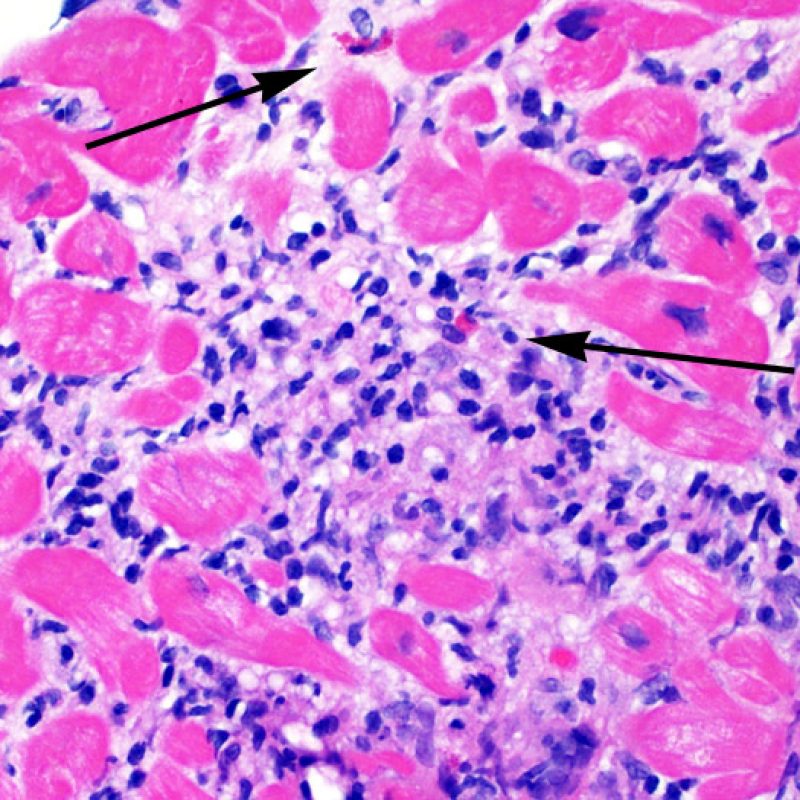
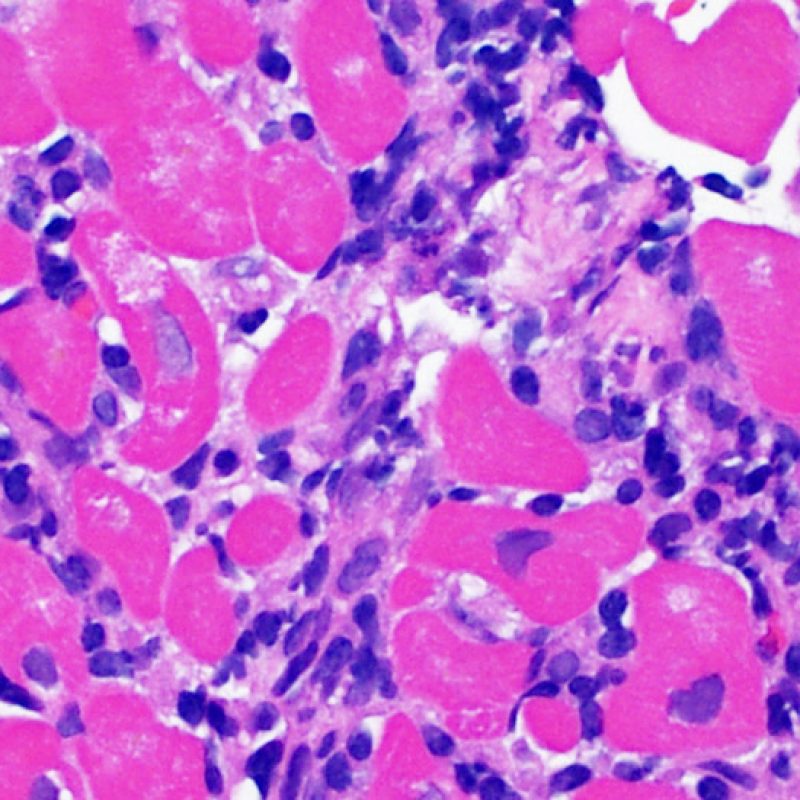
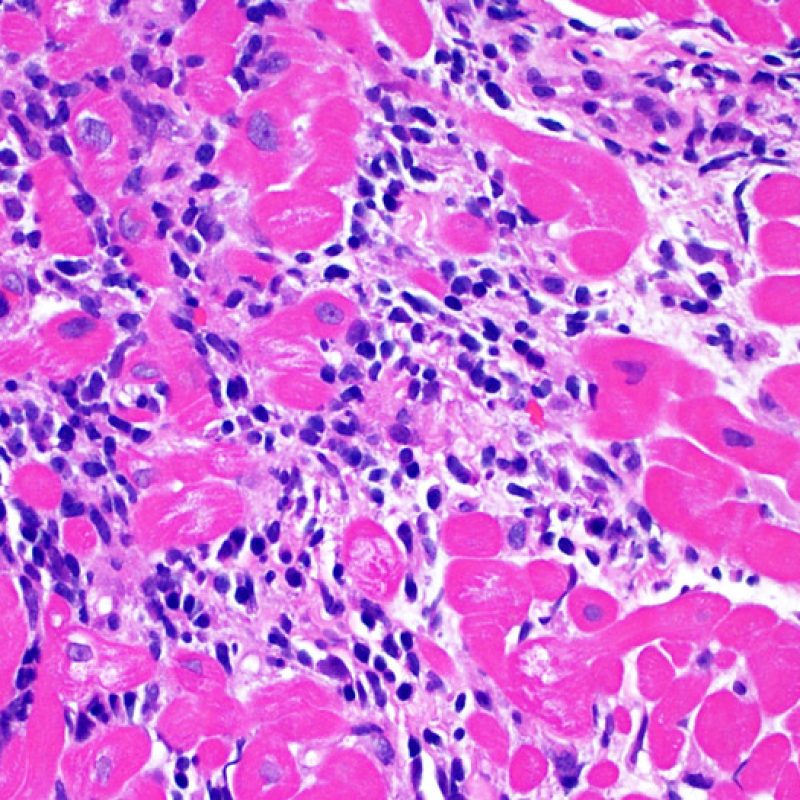
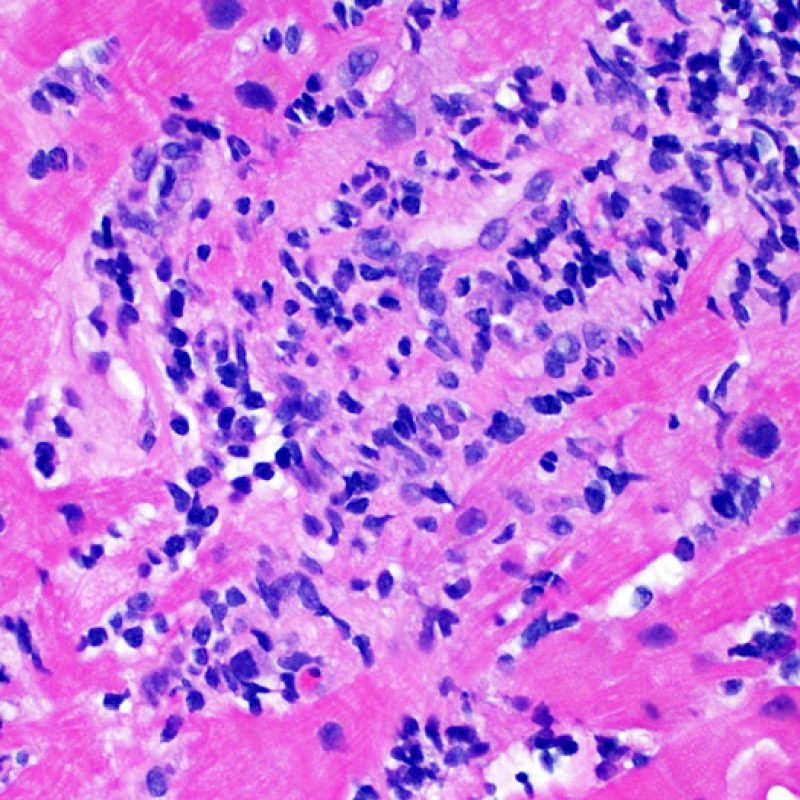
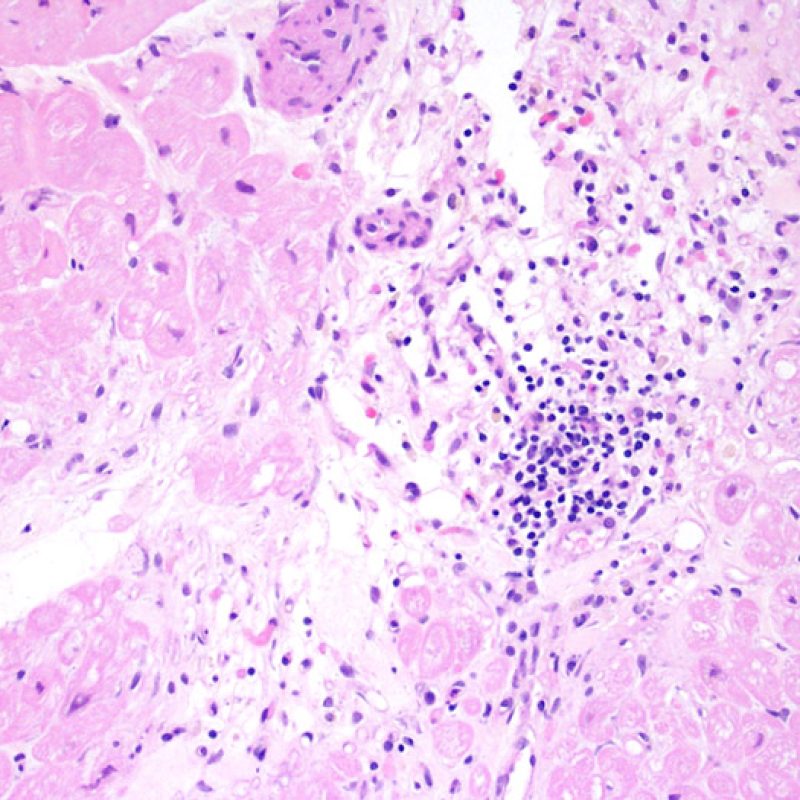
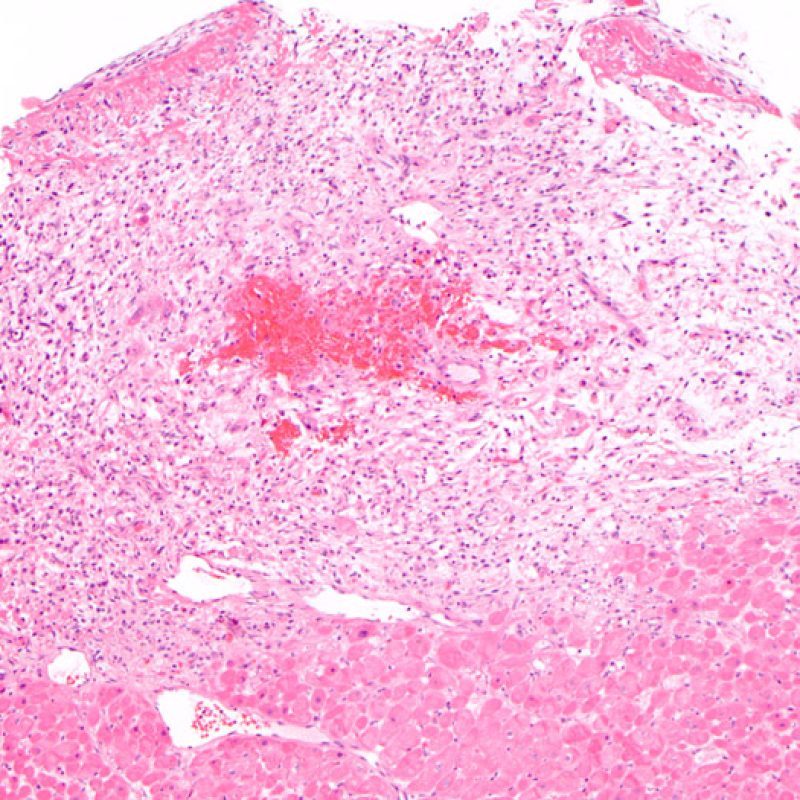
Il rigetto moderato (2R) è caratterizzato da due o più focolai infiammatori associati a danno miocellulare. Questi possono essere localizzati sia nello stesso frammento bioptico (a poca distanza l’uno dall’altro) che in diversi frammenti, o anche comparire su differenti livelli di taglio dei campioni. In tale grado di rigetto, deve essere presente almeno un infiltrato infiammatorio di moderata entità. In assenza di un significativo infiltrato infiammatorio, bisognerebbe chiedersi se non si stia sovrastimando il danno miocellulare e valutare la possibilità di altre lesioni che mimano il rigetto. In presenza di un rigetto 2R, è buona prassi comunicare personalmente con i clinici per assicurarne il tempestivo trattamento.
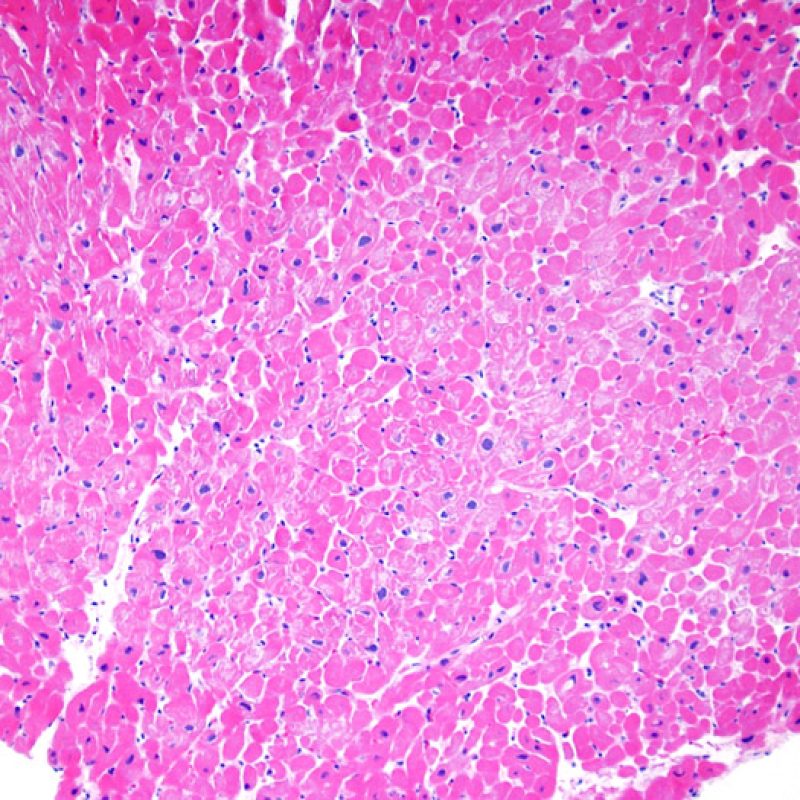
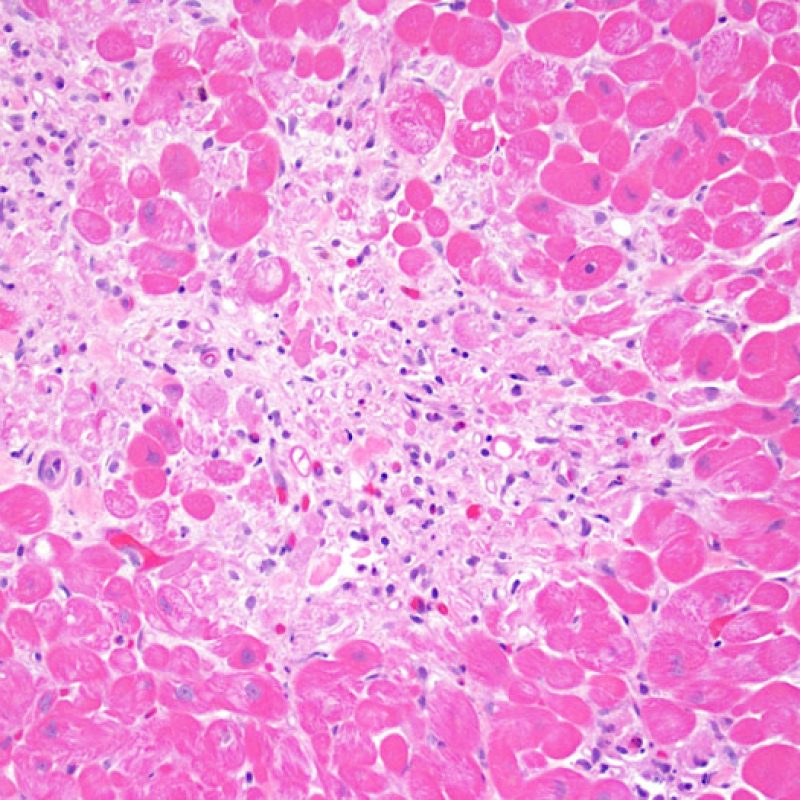
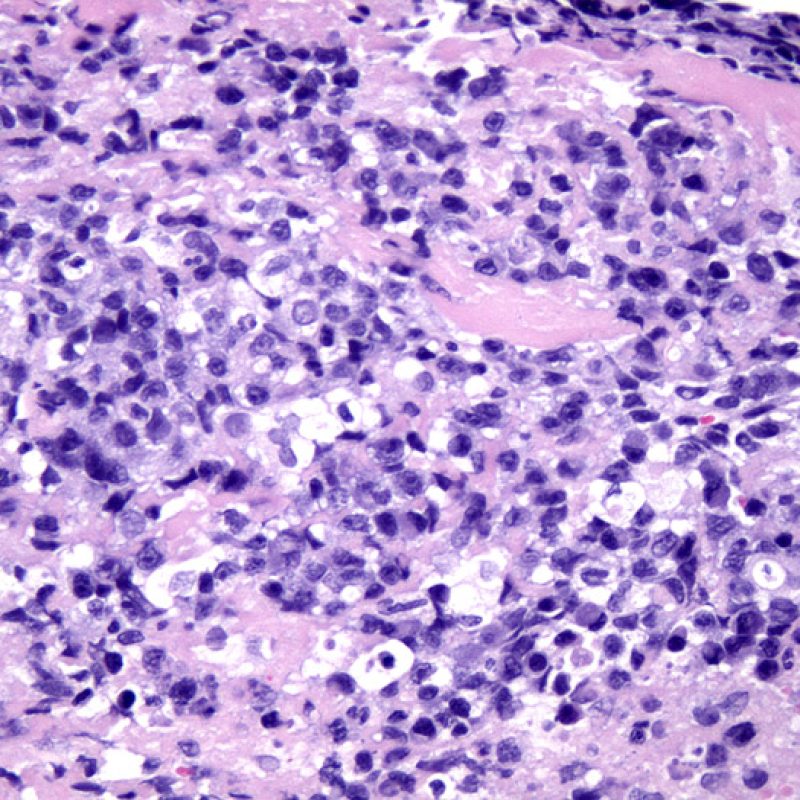
Rigetto severo (3R)
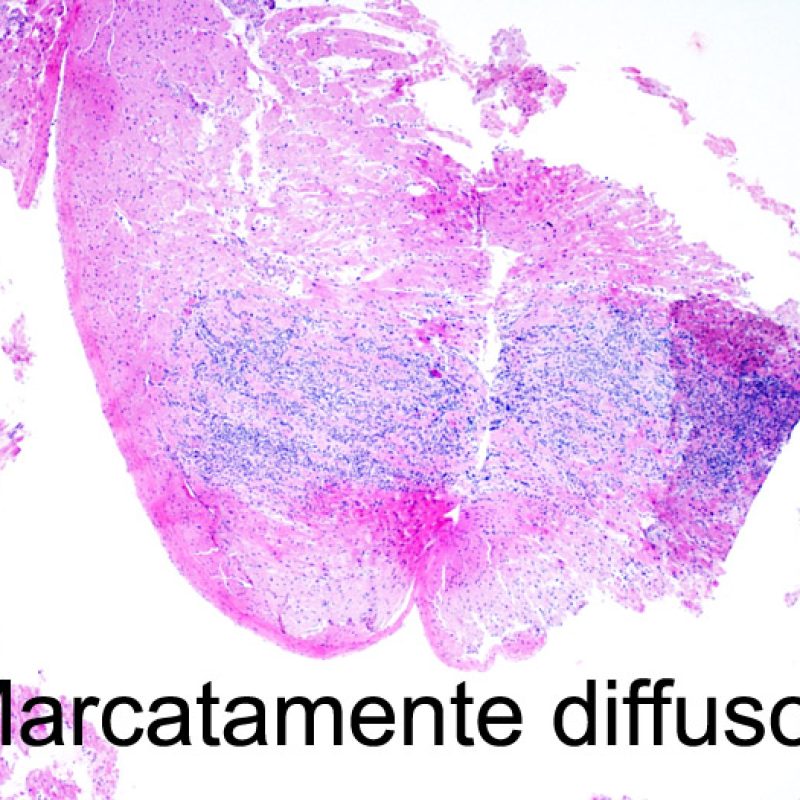
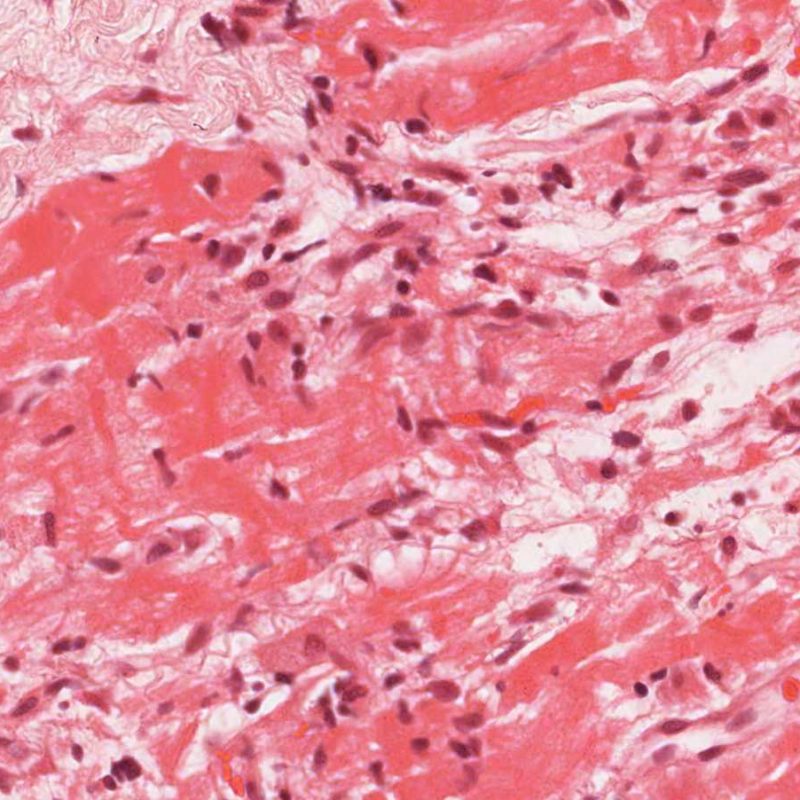
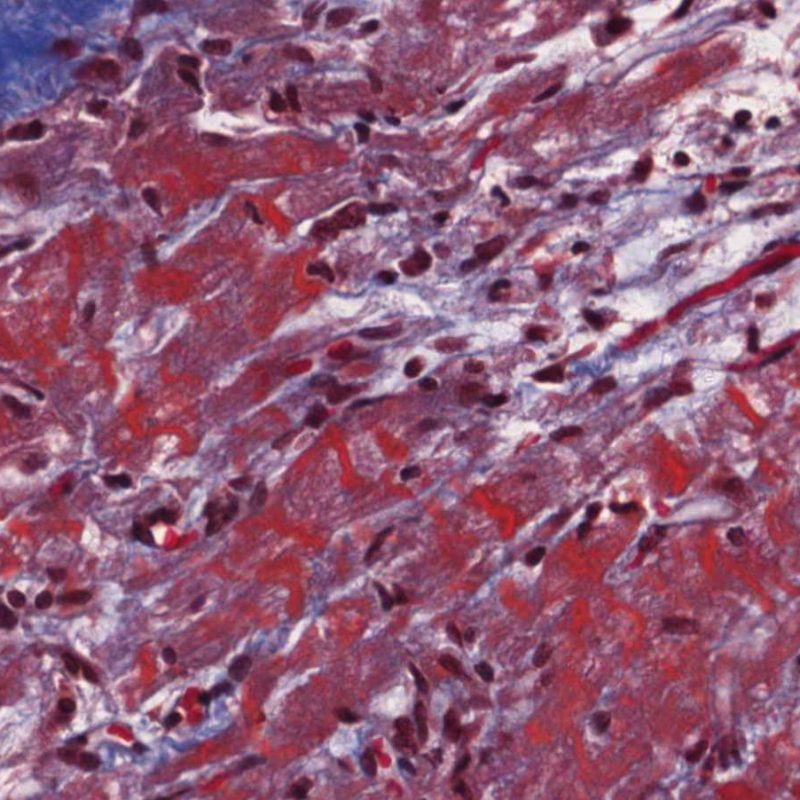
Nel rigetto severo (3R), il danno miocellulare è diffuso ed è difficile individuare singoli focolai di danno miocardico. Tipicamente, sono presenti numerosi granulociti eosinofili e una certa quota di neutrofili. In genere, l’infiltrato infiammatorio è marcato e ad esso possono associarsi edema, emorragia e vasculite. Con gli attuali protocolli immunosoppressivi, il rigetto 3R è oggi raro: può però verificarsi quando i pazienti interrompono la terapia di propria iniziativa. Questo grado di rigetto si accompagna spesso a disfunzione clinica. In ogni caso, è sempre opportuno comunicare direttamente con i clinici, perché è necessario intervenire prontamente con la terapia.
Rigetto anticorpo-mediato
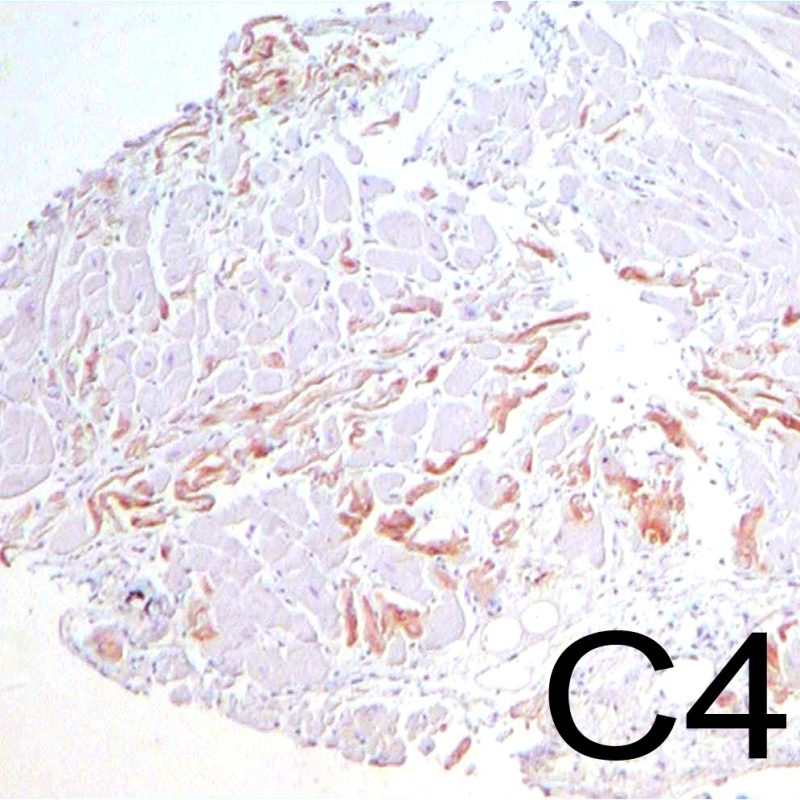
Il rigetto anticorpo-mediato (AMR, noto anche come rigetto umorale) si presenta con un quadro diverso da quello del rigetto cellulare, tranne che nelle forme severe, in cui i reperti istologici possono sovrapporsi. Le alterazioni istopatologiche sono costituite, al microscopio ottico, da rigonfiamento delle cellule endoteliali, da aggregati di macrofagi che affollano e spesso occludono il lume dei piccoli vasi e da edema. Per la diagnosi di tale forma di rigetto è necessario eseguire colorazioni immunoistochimiche per il fattore C4d del complemento. Sarà presto disponibile un secondo tutorial dedicato specificamente al rigetto anticorpo-mediato.
Differenze fra le classificazioni del rigetto formulate dall'ISHLT nel 1990 e nel 2004
Come già menzionato, la ISHLT ha formulato due differenti sistemi di gradazione del rigetto cellulare. La classificazione del 2004 ha semplificato i criteri adottati nel 1990, eliminando sostanzialmente quei gradi privi di rilevanza prognostica (gradi 1A vs 1B e gradi 3B vs 4) della classificazione ISHLT-1990. La decisione più controversa è stata quella di accomunare l’ex grado 2 (unico focolaio di danno miocitario) della classificazione ISHLT-1990 con la nuova categoria 1R. In molti centri, infatti, il grado 2 ISHLT-1990 viene trattato in modo differente dall’1R ISHLT-2004: alcuni programmano semplicemente un più stretto follow-up; altri intervengono con un incremento della terapia immunosoppressiva. E’ per questo motivo che, quando è presente un singolo focolaio di danno miocellulare, è importante concordare con i propri clinici il comportamento da seguire.
Osservazione a piccolo ingrandimento
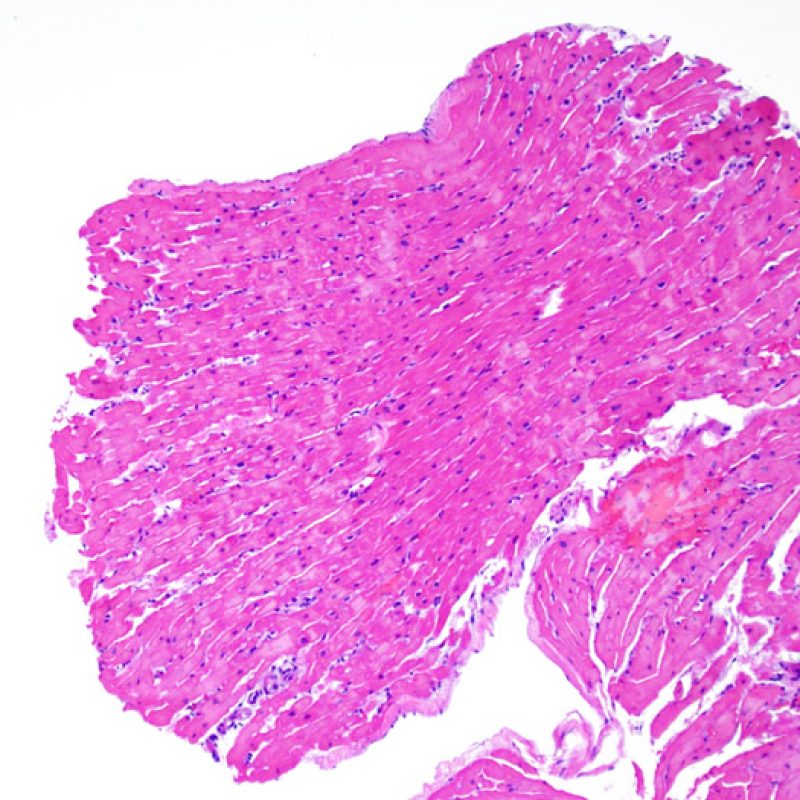
Questa parte del tutorial ti guiderà nell’osservazione a piccolo ingrandimento (da 2x a 10x) della cellularità, dell’interstizio, dei miociti e dei vasi.
Adeguatezza della biopsia
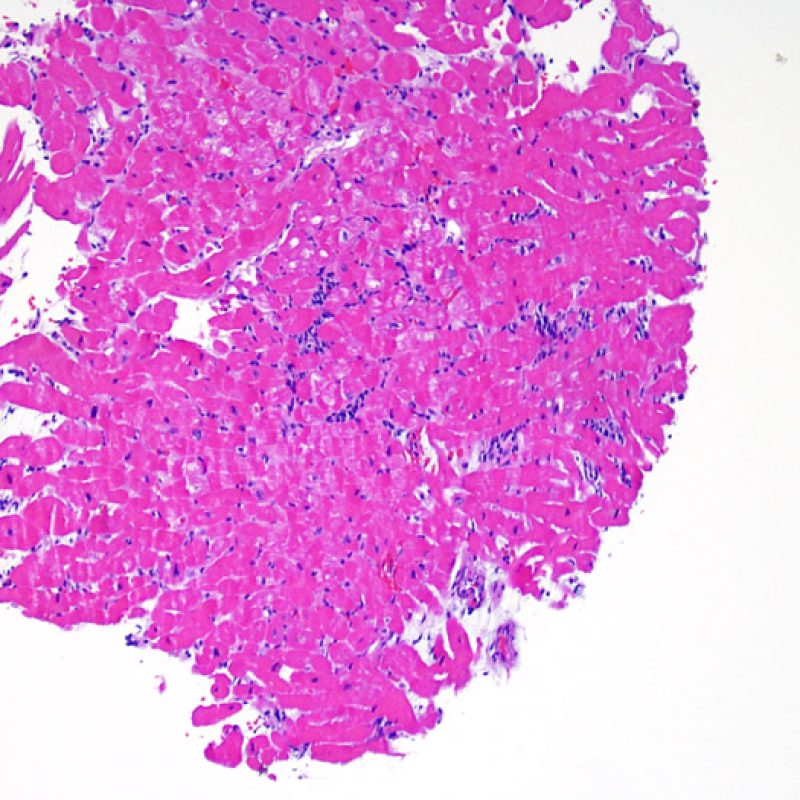
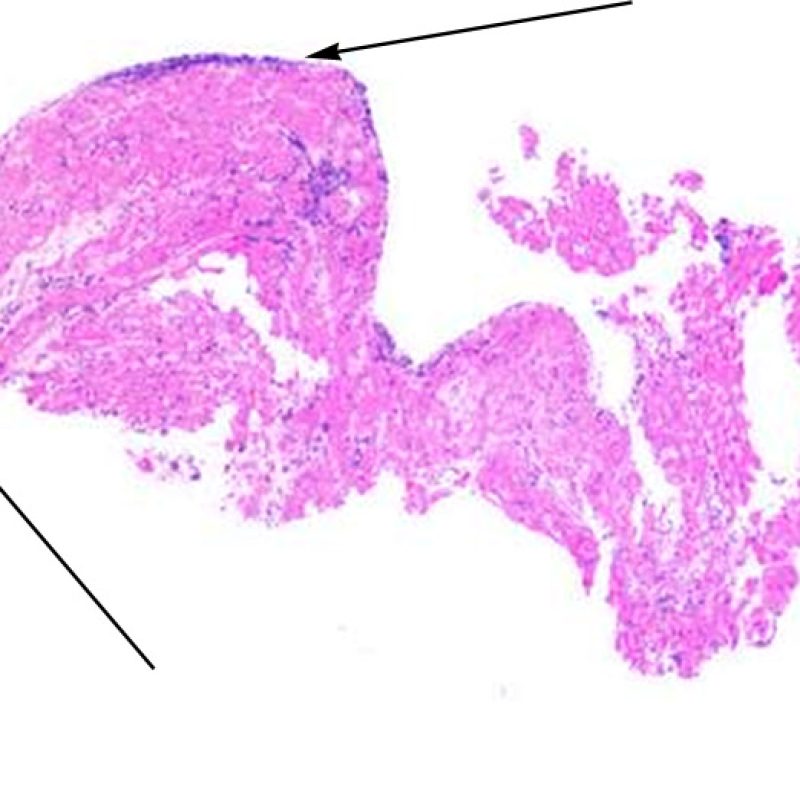
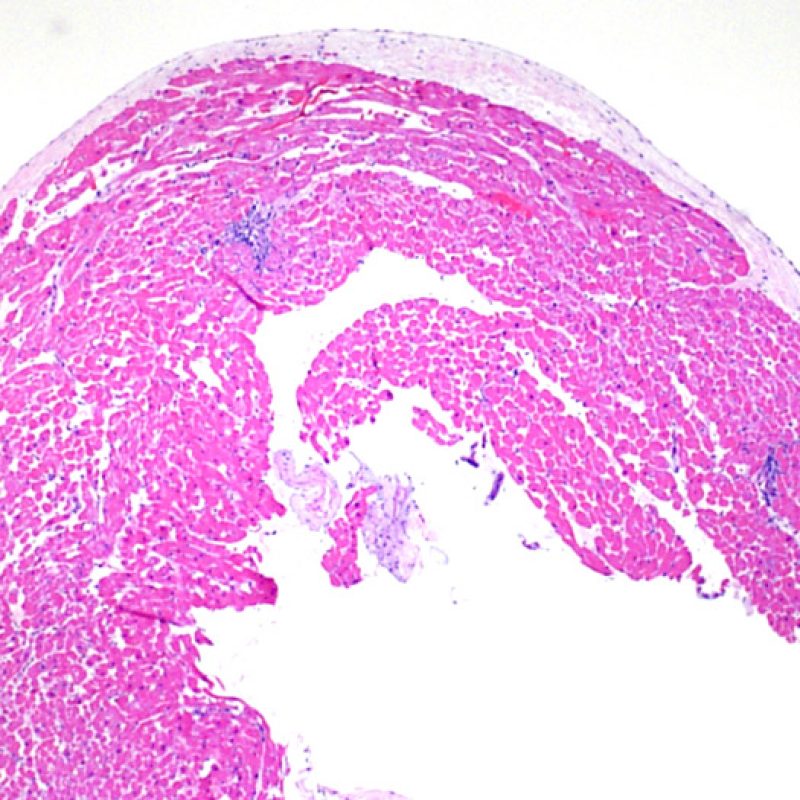
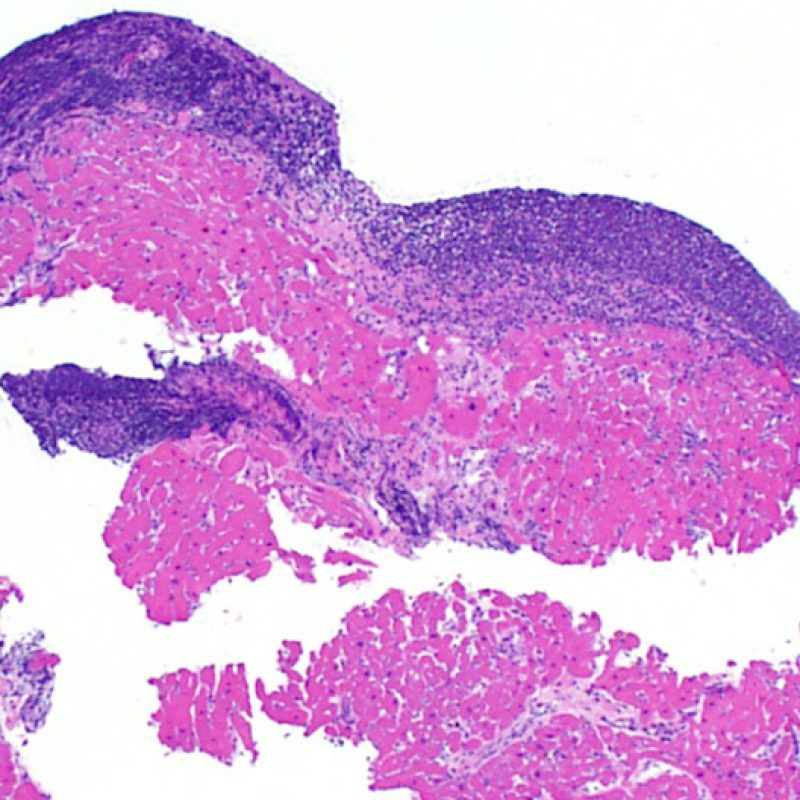
Il primo parametro da verificare a piccolo ingrandimento è se il miocardio è adeguatamente rappresentato per poter valutare il rigetto cellulare. Infatti, poiché molti pazienti trapiantati sono sottoposti a ripetuti controlli bioptici, può accadere che una parte o tutto il tessuto presente in un prelievo bioptico sia costituito da una sede di precedente biopsia. Se si rileva materiale trombotico organizzato, tessuto di granulazione o aree di fibrosi, con miociti assenti o distribuiti in modo disorganizzato, è probabile che si tratti di un precedente sito bioptico. Perché una biopsia possa essere considerata adeguata, dovrebbero essere presenti almeno 3 frammenti bioptici, ciascuno dei quali contenga miocardio non alterato da un precedente sito bioptico nel 50% della superficie. Dovrebbe anche essere segnalata l’eventuale presenza di tessuti diversi dal miocardio (lembi valvolari, corde tendinee, tessuto adiposo, ecc.).
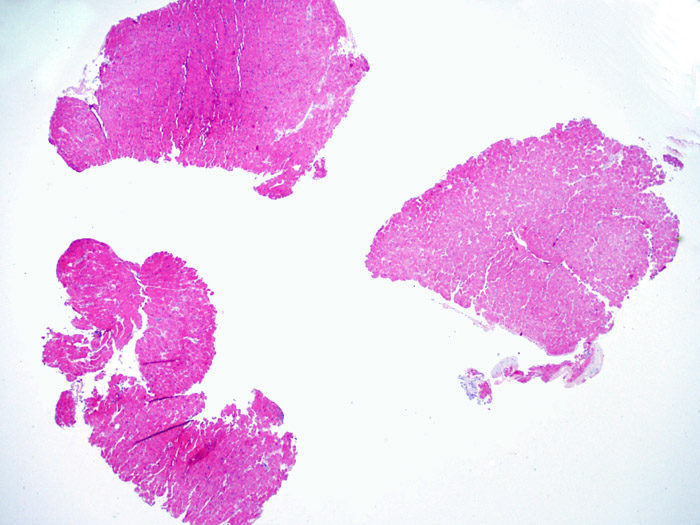
Cellularità complessiva della biopsia
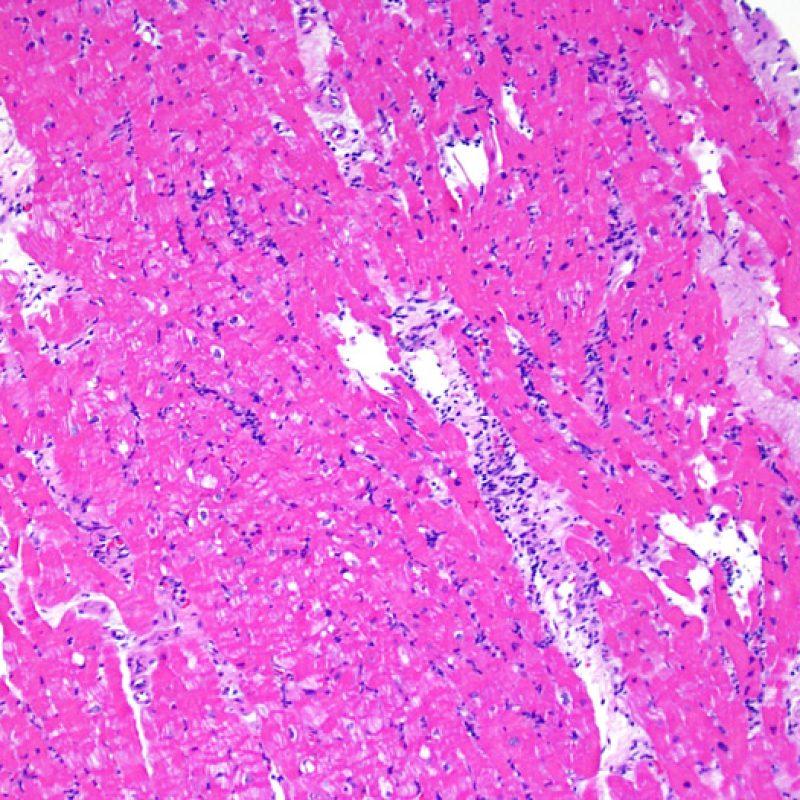
Dopo aver stabilito che la biopsia è adeguata, gli altri obiettivi principali sono: 1) rilevare la presenza di un’aumentata cellularità nei campioni; 2) definire la localizzazione ed il pattern di distribuzione degli infiltrati cellulari; 3) farsi un’idea generale sulla quantità dell’infiltrato infiammatorio e 4) identificare le specifiche aree con aumentata cellularità, da andare a valutare a maggiore ingrandimento. Poiché infatti le alterazioni istologiche del rigetto cellulare non sono distribuite in modo uniforme, uno sguardo generale d’insieme a piccolo ingrandimento è di aiuto per selezionare le aree maggiormente compromesse. Esaminare il tessuto a livelli differenti è decisivo per l’accuratezza diagnostica.
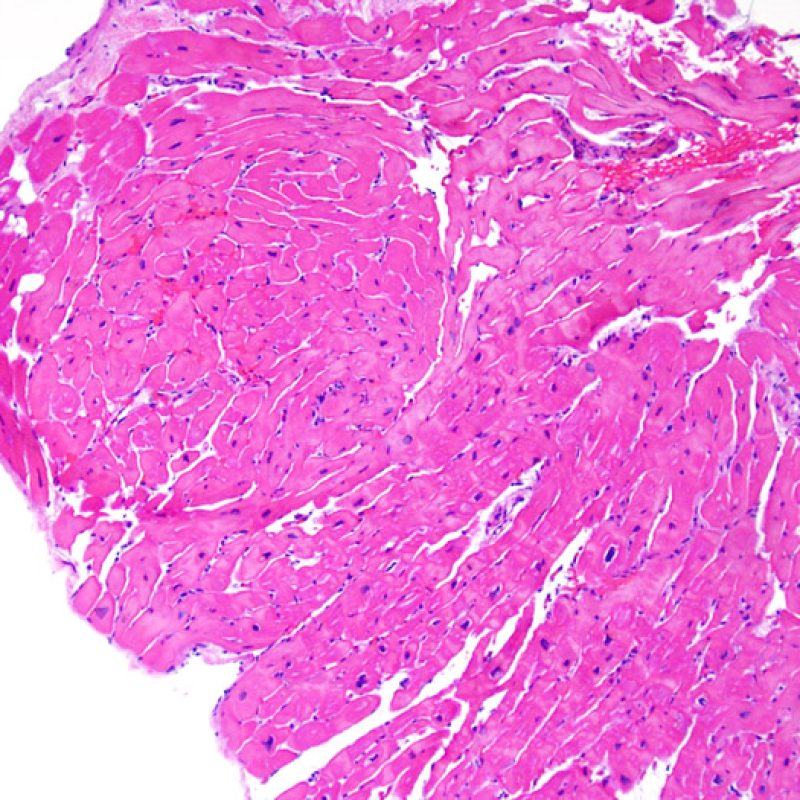
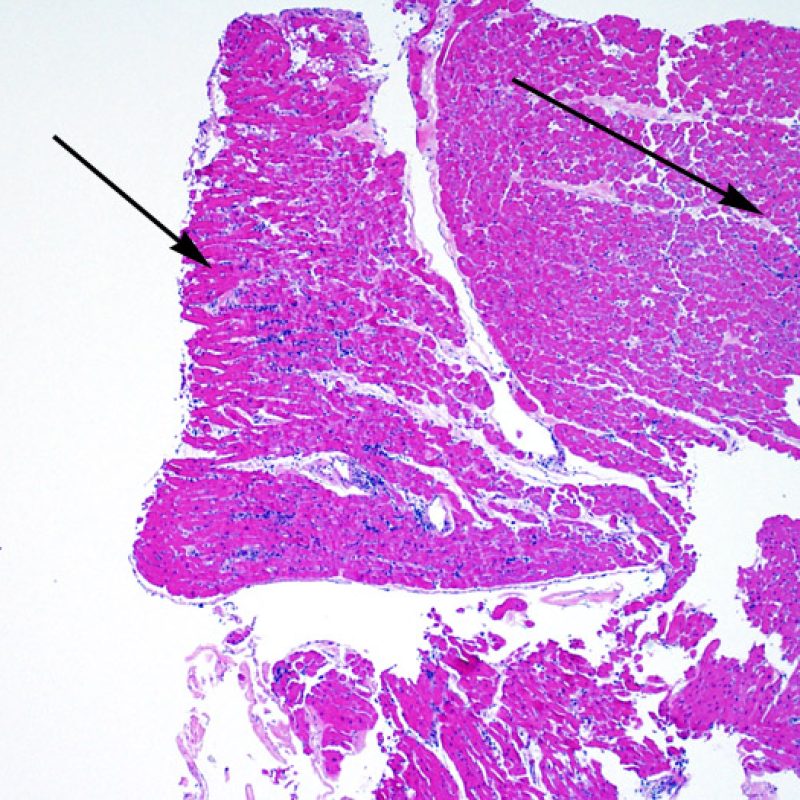
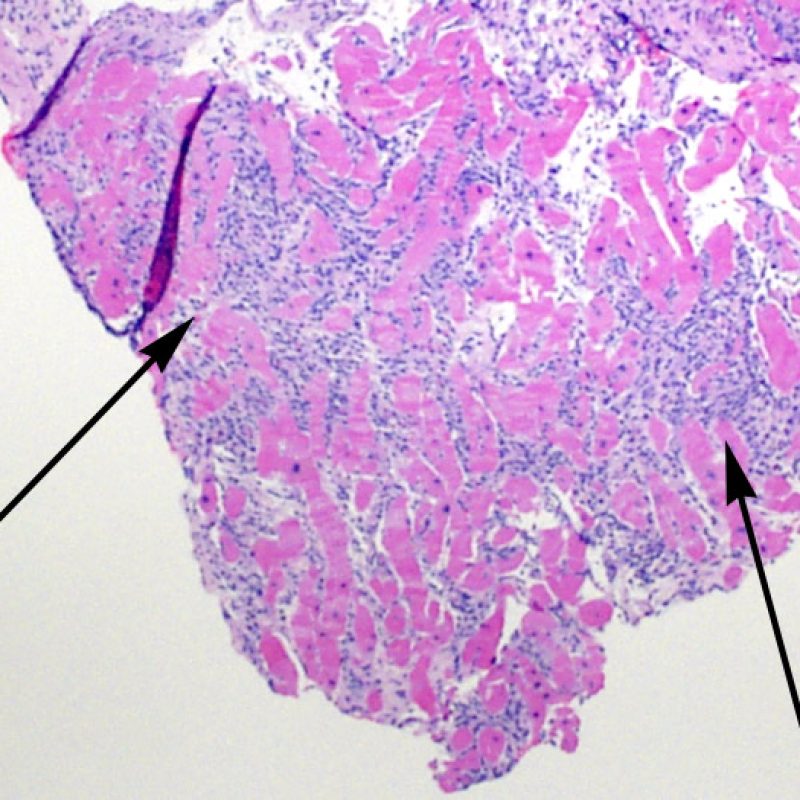
E’ in genere agevole identificare nella BEM le aree di aumentata cellularità. Il pattern di distribuzione degli infiltrati cellulari può essere focale o diffuso. Normalmente, è possibile valutare, a piccolo ingrandimento, se l’infiammazione è distribuita in sede perivascolare o attorno ai miociti (perimiocitaria) con il tipico pattern a “rete”. Tale distinzione è talora soggettiva, come accade per molte altre caratteristiche morfologiche.
La localizzazione degli infiltrati e il rapporto che questi contraggono con i miociti possono suggerire il tipo di patologia sottostante. Nel rigetto acuto cellulo-mediato (ACR), gli infiltrati linfocitari si distribuiscono intorno ai cardiomiociti (perimiocitari) o alle piccole arteriole (perivascolari). Se l’infiltrato è localizzato principalmente nel subendocardio o nel contesto di tessuto fibroso, bisognerebbe prendere in considerazione eziologie alternative, quali il danno ischemico, le lesioni Quilty o i precedenti siti bioptici. Può accadere che alcuni infiltrati linfocitari si distribuiscano, con una modalità lineare, lungo la superficie endocardica o vicino ad essa: in questi casi, sono difficilmente distinguibili da un effetto Quilty e compaiono in genere nei gradi più elevati di rigetto, in associazione con infiltrati perimiocitari.
Ampi aggregati nodulari di linfociti distribuiti lungo l’endocardio sono tipici degli effetti “Quilty”. Per quanto riguarda le lesioni Quilty intramiocardiche o quelle che dall’endocardio si estendono all’interno del miocardio, gli aspetti che a piccolo ingrandimento possono suggerirne la corretta interpretazione sono rappresentati da infiltrati linfocitari compatti, con margini espansivi e relativamente ben demarcati dagli adiacenti miociti. Tutti gli infiltrati perimiocitari dovrebbero comunque essere valutati a più alto ingrandimento, per verificare l’eventuale presenza di danno miocitario.
Miociti
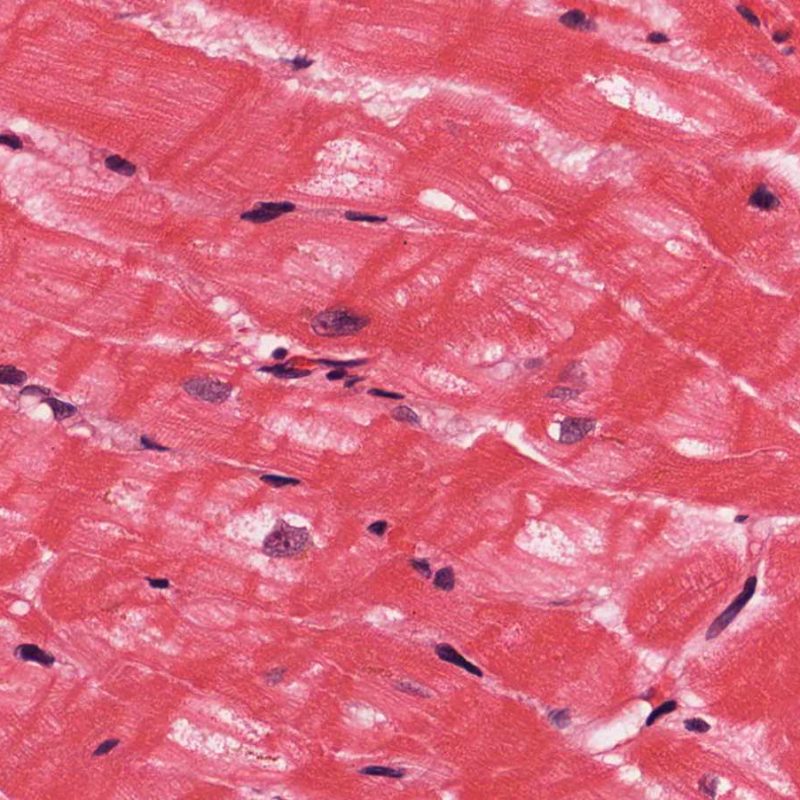
Identificare il “danno miocitario” nella BEM è a volte un compito impegnativo, perchè questo quadro comprende un ampio spettro di alterazioni, che va dalla morte cellulare ad alterazioni degenerative appena percepibili. Per garantirne l’accurata diagnosi, la maggior parte di queste alterazioni deve essere attentamente valutata a forte ingrandimento.
Un aspetto incontrovertibile di danno miocitario a piccolo ingrandimento è rappresentato dall’aggressione dei miociti da parte delle cellule infiammatorie: si può giungere ad immagini di franca sovrapposizione dei due tipi di cellule, con perdita della regolarità del contorno delle miocellule e distorsione della normale architettura miocardica. In pratica, la presenza di cellule infiammatorie all’interno dei miociti o in stretto rapporto spaziale con essi deve indurre ad approfondire la valutazione istologica. Massima cautela dovrebbe inoltre essere impiegata nel valutare la relazione fra linfociti e miociti nelle aree sede di artefatti da stiramento praticati dal biotomo.
Il danno ischemico (perioperatorio o da ischemia tardiva secondaria a vasculopatia del graft) può occasionalmente indurre la formazione di focolai di necrosi coagulativa dei cardiomiociti: i focolai di piccole dimensioni che coinvolgono pochi miociti possono essere indistinguibili, a piccolo ingrandimento, da quelli presenti nel ACR; i focolai più ampi vengono riconosciuti senza difficoltà, sulla base del tipico aspetto della necrosi coagulativa, caratterizzata da miociti privi di nucleo e da vari gradi di riassorbimento delle miocellule. Indipendentemente dalla dimensione, i focolai ischemici sono spesso circondati da uno scarso numero di macrofagi e linfociti e da più rari neutrofili. In alcuni casi, queste lesioni sono stellariformi e nettamente demarcate dal miocardio circostante. La colorazione tricromica può far risaltare ulteriormente i miociti necrotici, colorandoli in rosso porpora.
Miociti vacuolizzati possono essere riscontrati anche in presenza di miocitolisi secondaria ad ischemia cronica. Anche gli artefatti a bande di contrazione possono mimare le lesioni miocitolitiche, soprattutto quando le miocellule sono tagliate trasversalmente. Quando, ad un’attenta valutazione a piccolo ingrandimento, si individua un pattern miocitario a “scacchiera”, costituito dall’alternanza di aree con elementi contrattili addensati e di aree chiare con lisi miofibrillare, dovrebbe scattare il sospetto di un’ischemia cronica.
Interstizio
Oltre all’incremento della cellularità, che abbiamo già discusso, le altre principali alterazioni dell’interstizio miocardico che possono essere individuate a piccolo ingrandimento sono costituite dall’edema e dalla fibrosi. L’edema è in genere presente nei quadri di ACR severo (Grado 3R), di scompenso cardiaco e/o di danno vascolare da rigetto anticorpo-mediato. L’interstizio appare pallido e basofilo, sia in sede perivascolare che perimiocitaria. In questi casi, è opportuno andare a valutare il microcircolo ad alto ingrandimento, per escludere alterazioni da rigetto anticorpo-mediato. L’edema non va confuso con eventuali alterazioni artefattuali causate dalla procedura bioptica o dalla processazione: gli artefatti sono costituiti da spazi otticamente vuoti fra i miociti, di dimensioni piccole o ampie, privi di matrice extracellulare (presente invece nell’edema).
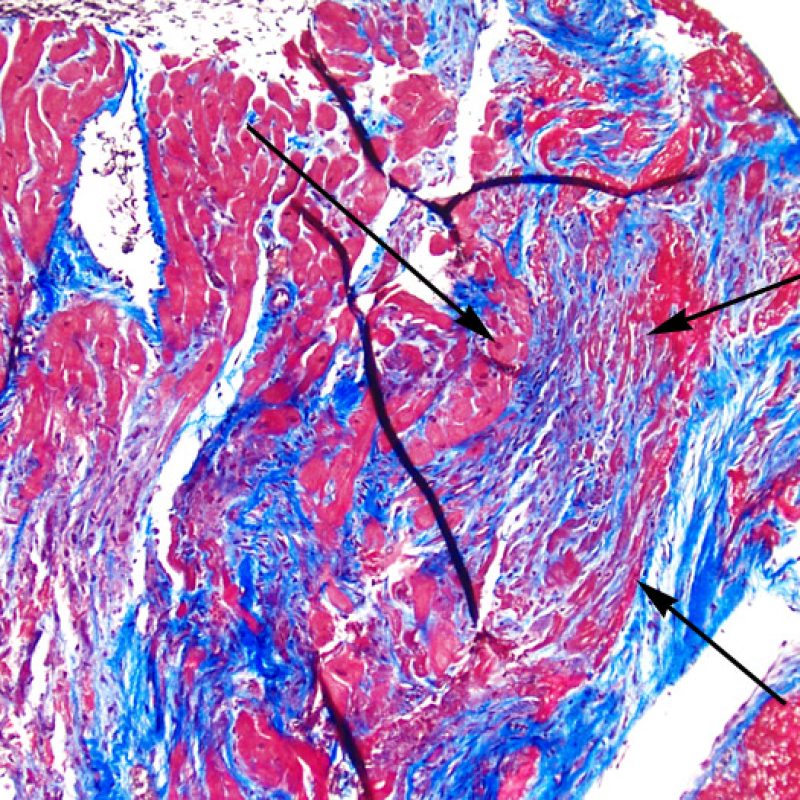
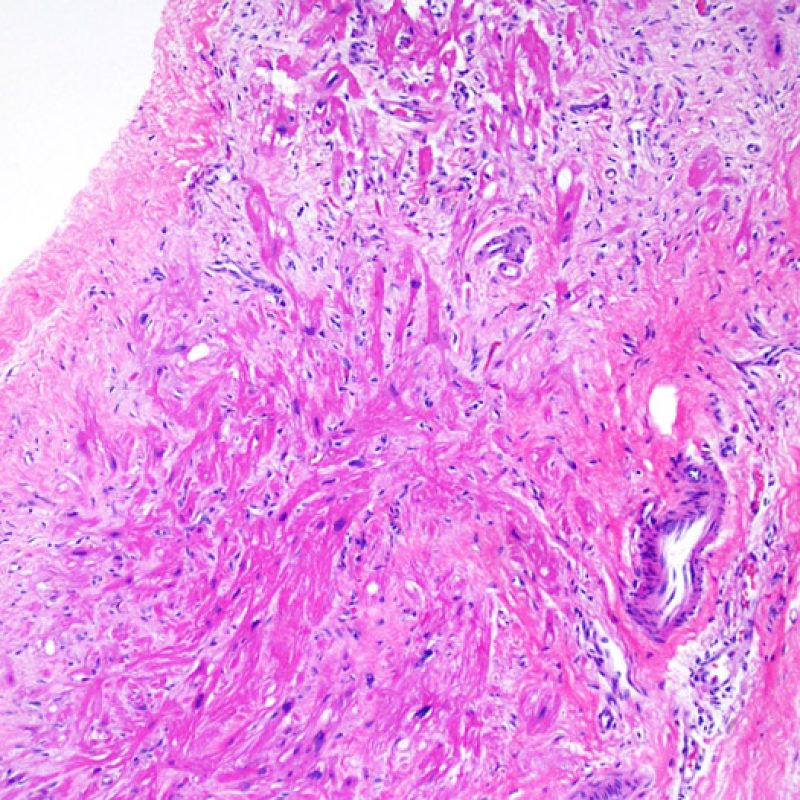
L’incremento del tessuto fibroso interstiziale si presenta generalmente sotto forma di estese aree di fibrosi sostitutiva con perdita dei miociti. Queste lesioni sono spesso legate a biopsie effettuate nel contesto o in stretta prossimità di precedenti siti bioptici. Le alterazioni istologiche caratteristiche dei siti bioptici saranno trattate altrove. Poiché può risultare problematico distinguere una sede di precedente biopsia da aree cicatriziali dovute ad ischemia miocardica cronica e/o guarita, se a piccolo ingrandimento sono evidenti lesioni cicatriziali stellariformi, bisogna ricercare a maggiore ingrandimento ulteriori aspetti di ischemia cronica. La fibrosi interstiziale comunque, al di là dei reperti descritti, non è una caratteristica del ACR.
Vasi
Anche a livello bioptico è possibile riscontrare alterazioni correlate alla vasculopatia del graft, che talora vengono confuse con il cd. effetto telescopico dei vasi sanguigni. di natura artefattuale. Se sono presenti vasi di maggiori dimensioni, soprattutto se accompagnati da tessuto adiposo o nervoso, si dovrebbe valutare la presenza di un’eventuale perforazione a maggiore ingrandimento. Le alterazioni patologiche vascolari sono più accuratamente valutabili ad alto ingrandimento.
Osservazione ad alto ingrandimento
Dopo aver esaminato un vetrino a piccolo ingrandimento (obiettivi 4x o 10x), il patologo va solitamente a valutare a maggiore ingrandimento le aree che contengono un infiltrato infiammatorio, utilizzando in genere un obiettivo 20x. Il primo elemento da ricercare con attenzione è la presenza di un eventuale danno miocitario associato agli infiltrati linfocitari. Non è particolarmente necessario riesaminare a maggiore ingrandimento le aree in cui non si erano evidenziate alterazioni dei miociti a piccolo ingrandimento. Questa parte del tutorial ti accompagnerà nell’osservazione ad alto ingrandimento, affrontando in specifico i seguenti argomenti: il danno miocitario, la composizione dell’interstizio e le cellule che lo infiltrano.
Conferma del danno miocitario
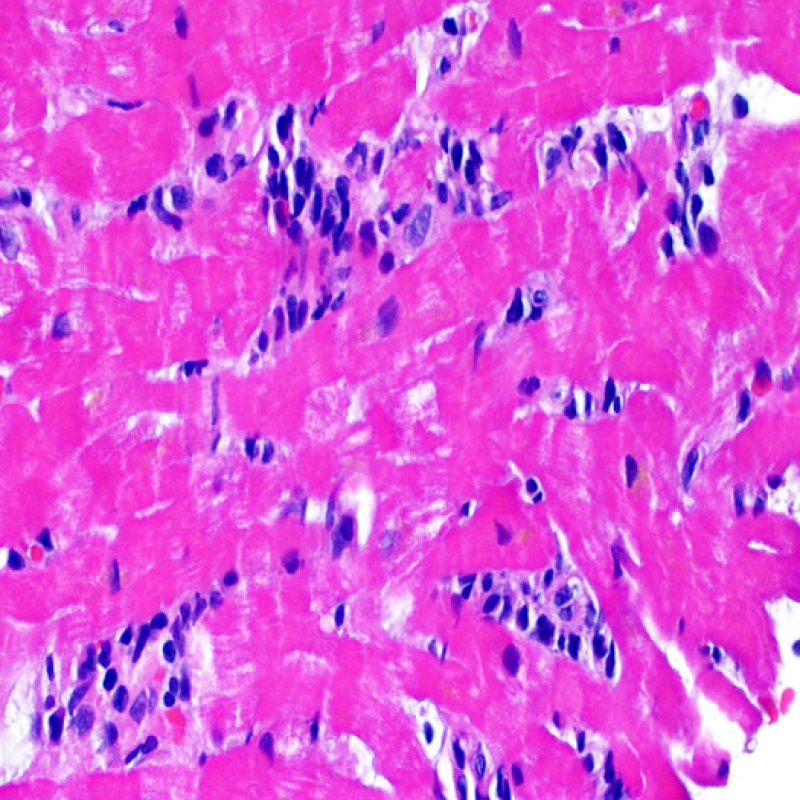
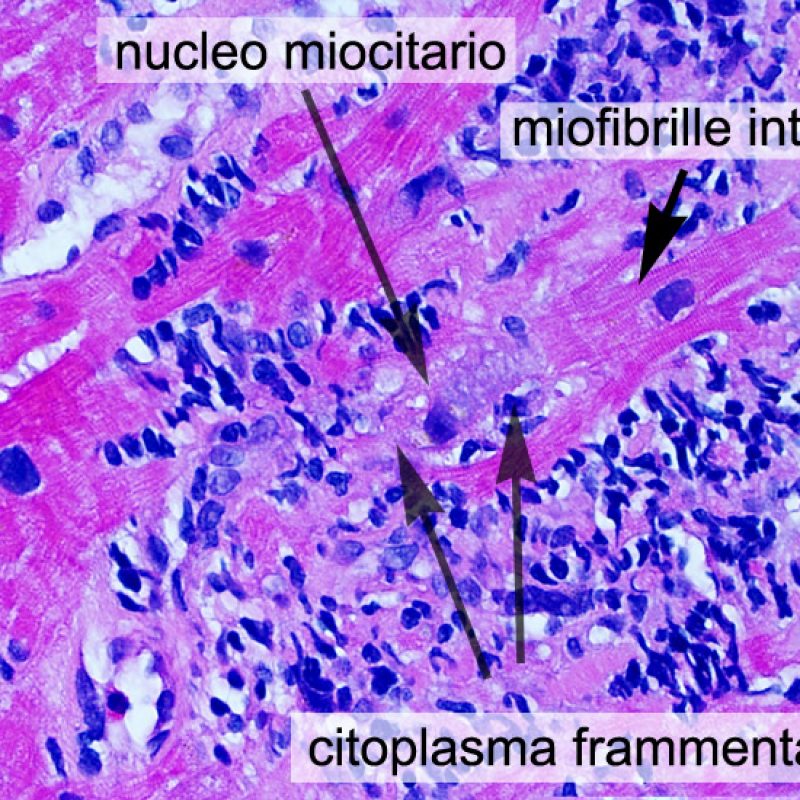
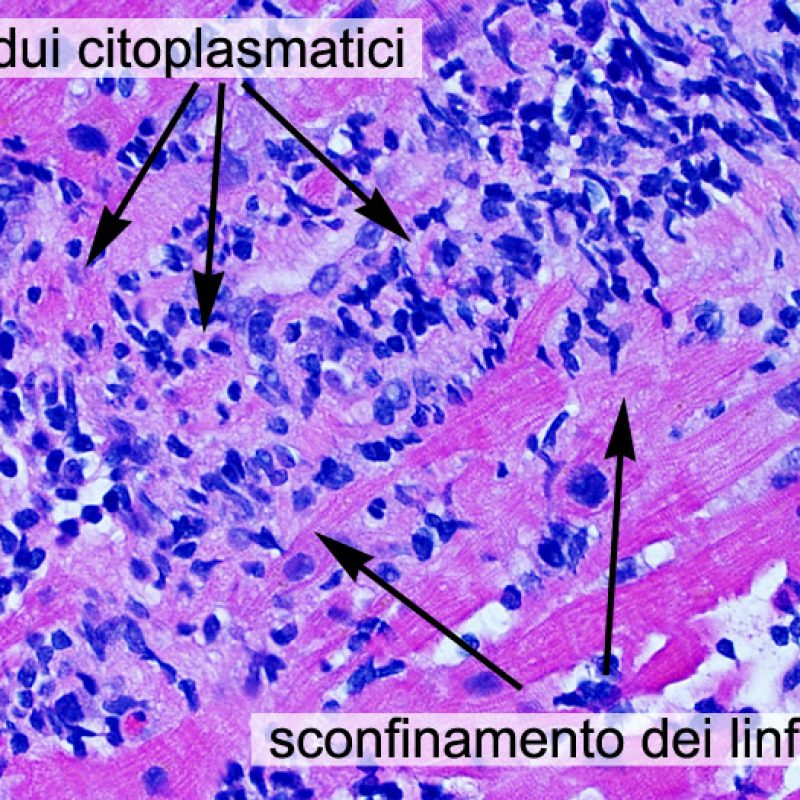
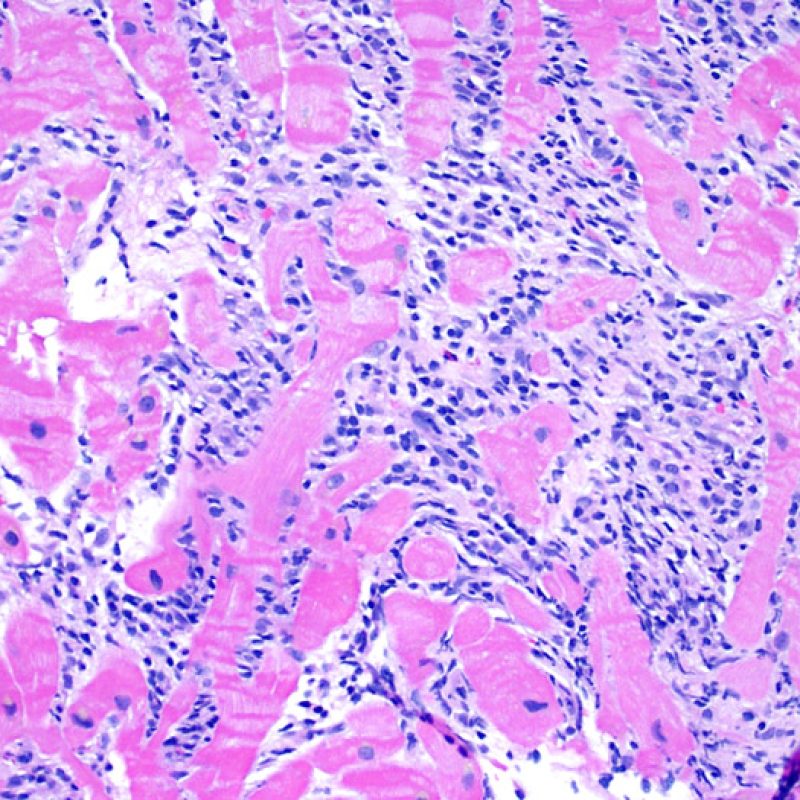
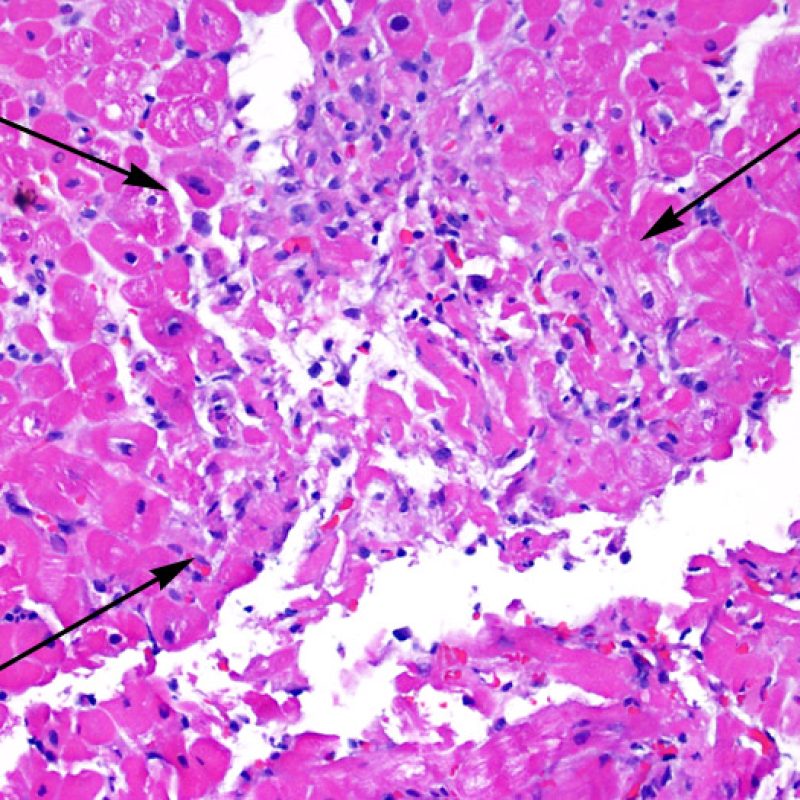
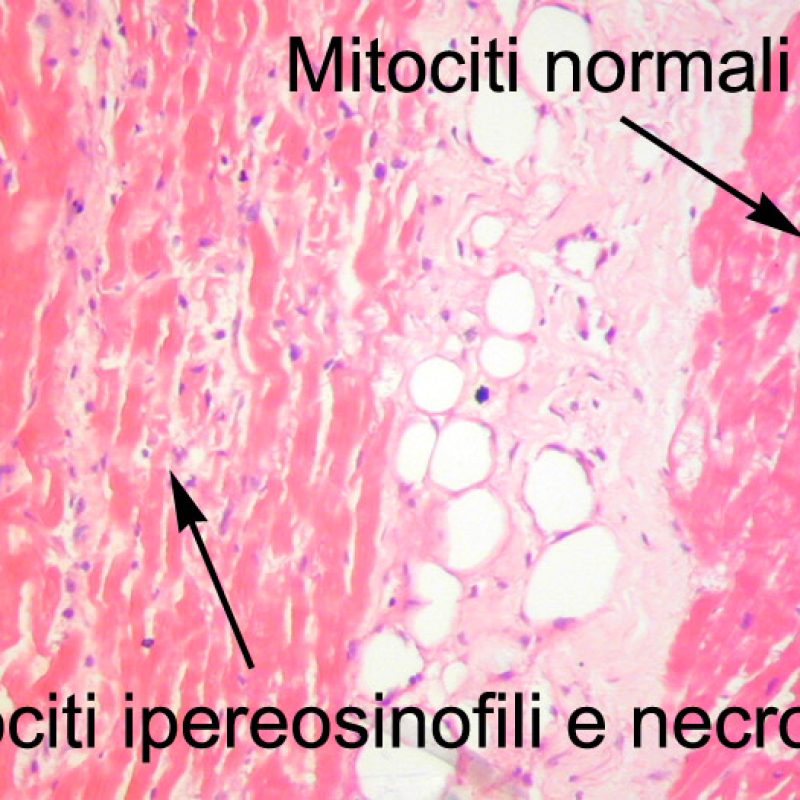
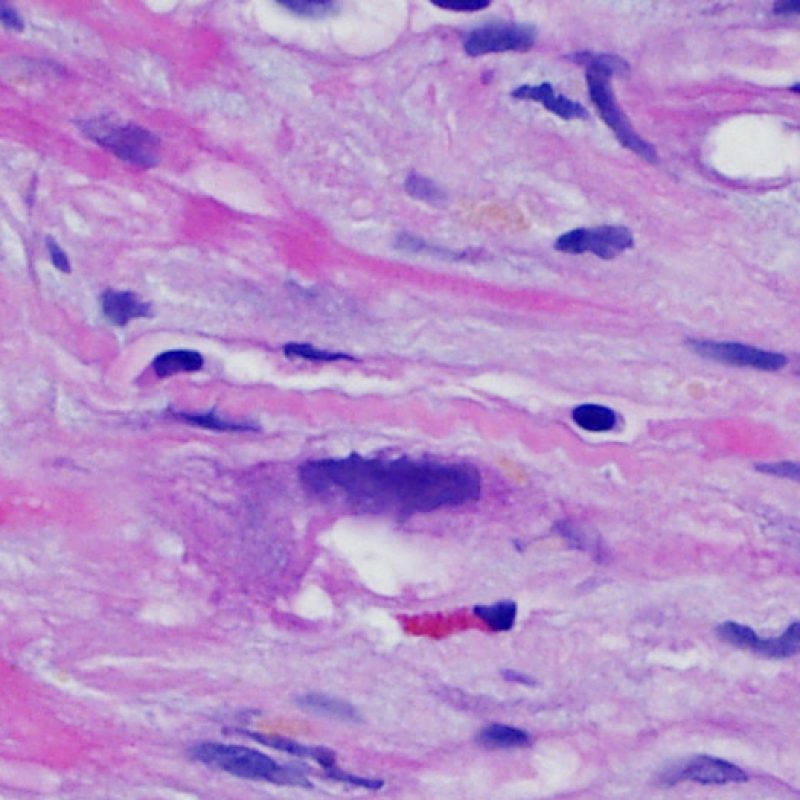
Dopo aver identificato la presenza di un infiltrato linfocitario, il passo successivo è la ricerca del danno miocitario. Non è facile riconoscere le lesioni dei miociti (cioè il danno/necrosi) associate a rigetto acuto o distinguerle da altre alterazioni, come ad es. quelle da scarsa fissazione. Il danno miocitario è spesso discreto e lo si apprezza più facilmente osservando la stessa area a differenti livelli. Alcune caratteristiche istologiche del danno miocitario sono costituite da: vacuolizzazione, alone perinucleare, nuclei non circondati da citoplasma, sconfinamento dei linfociti all’interno delle miocellule (che perdono la regolarità dei confini) ed aree in cui i miociti scomparsi sono sostituiti da marcata infiammazione e matrice extracellulare. Altri elementi caratteristici sono l’ipereosinofilia e la picnosi nucleare. Nella revisione della working formulation, anche la miocitolisi e la necrosi coagulativa sono stati accettati come criteri di danno miocitario.
Altro elemento indicativo di danno miocitario è la modificazione della struttura del sarcomero. Se il disegno miofibrillare è normale, il miocita non è verosimilmente danneggiato; se tale disegno non è più evidente ed il citoplasma si presenta ipereosinofilo e addensato, vi è un’alta probabilità che lo sia. Le colorazioni tricromiche (Masson o Mallory) possono essere di aiuto nell’evidenziare più precocemente il danno miocitario, nella fase in cui le miocellule hanno dimensioni ridotte, colore grigio-bluastro e perdono la normale eosinofilia.
Perché tutte queste alterazioni abbiano il significato di danno legato al rigetto devono essere osservate in prossimità di cellule linfocitarie: se queste sono assenti, le alterazioni sono più probabilmente dovute ad altre cause, come l’insulto ischemico, che può occorrere nelle prime settimane dopo il trapianto.
Per confermare la presenza del danno miocitario, è buona regola esaminare un’area potenzialmente danneggiata a vari livelli del frammento biotico, in quanto l’esame di una sola sezione istologica può indurre ad interpretazioni errate.
Identificazione delle cellule interstiziali
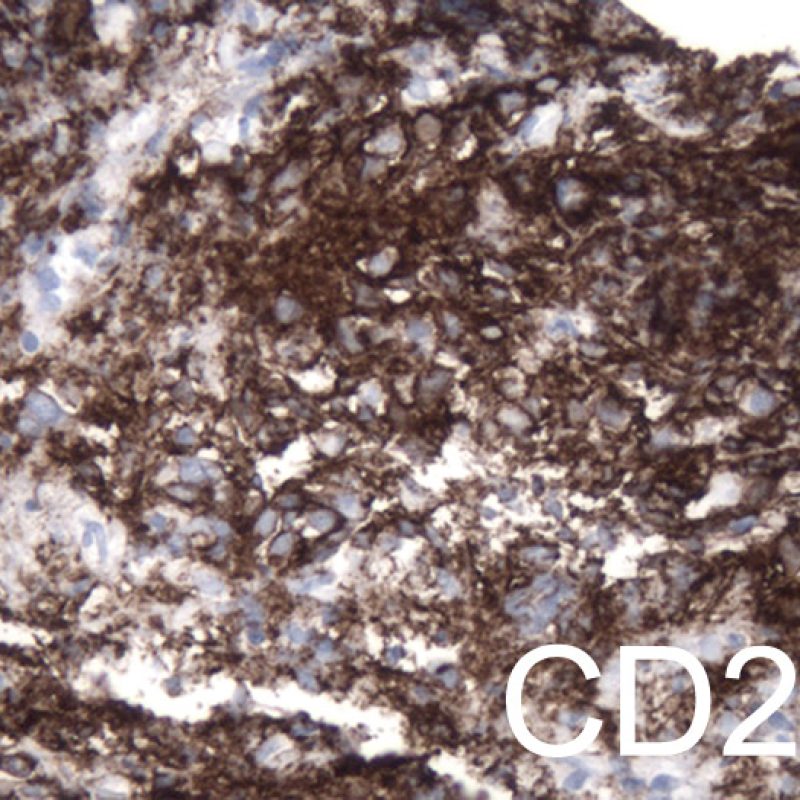
Numerose altre cellule possono essere presenti nella biopsia endomiocardica, oltre ai miociti. Le più importanti sono quelle dell’infiltrato cellulare del rigetto miocardico acuto, composto principalmente da linfociti T (CD4+ o CD8+), da un minor numero di macrofagi e da occasionali eosinofili. Nei rigetti moderati o severi, aumentano sensibilmente i linfociti B attivati o natural killer.
Ma non tutti i nuclei evidenziabili nell’interstizio corrispondono a linfociti: si rende quindi necessaria la valutazione ad alto ingrandimento per identificare l’esatta composizione “dell’infiltrato” ed escludere un rigetto cellulare. Altre componenti cellulari dell’interstizio miocardico sono costituite da fibroblasti e miofibroblasti, cellule mesenchimali primitive, cellule dendritiche, mastcellule, cellule endoteliali e periciti; nel miocardio normale, si rinvengono anche sparsi linfociti ed occasionali macrofagi. Nel miocardio, però, solo i linfociti formano in genere degli aggregati.
Composizione dell'infiltrato infiammatorio
Nelle biopsie endomiocardiche dei pazienti trapiantati, è importante identificare le specifiche cellule infiammatorie: ciò è di aiuto sia per capire se l’infiltrato è espressione di un rigetto o di altri processi patologici, sia per definire il grado stesso del rigetto. Il rigetto cellulare acuto è sempre caratterizzato dalla presenza di linfociti T. I linfociti attivati, che sono maggiormente rappresentati nei gradi più elevati di rigetto, hanno un citoplasma più ampio.
In un contesto appropriato, la presenza di un infiltrato infiammatorio misto, con neutrofili ed eosinofili, può essere indicativo di gradi elevati di rigetto (3R). I granulociti neutrofili si riscontrano anche in biopsie miocardiche con necrosi ischemica, lesione che può perdurare anche per diverse settimane dopo il trapianto.
Gli eosinofili, in genere in numero esiguo e distribuiti in modo sparso, compaiono nei gradi moderato (2R) e severo (3R), in associazione con necrosi dei miociti. Poiché queste cellule non si riscontrano quasi mai nel rigetto lieve (1R), la loro presenza deve indurre il sospetto che si abbia a che fare con un rigetto moderato o severo (2R & 3R).
Gli eosinofili fanno parte anche del quadro delle miocarditi da ipersensibilità da farmaci. In questa patologia, tali cellule sono tipicamente aggregate e costituiscono una cospicua percentuale dell’infiltrato infiammatorio misto, che comprende anche linfociti, plasmacellule e macrofagi. La necrosi miocellulare non è un reperto preminente di tale patologia, anche se è possibile riscontrare focolai di miocitolisi. Gli eosinofili sono caratteristici anche di alcune infezioni parassitarie del miocardio.
Esame dell'interstizio
L’interstizio dovrebbe essere esaminato ad alto ingrandimento per valutarne le componenti cellulari e l’edema. La presenza, nel contesto di un marcato infiltrato, di detriti nucleari o di altro materiale amorfo (“sporco”), basofilo o eosinofilo, è compatibile con danno miocitario o apoptosi cellulare. Nelle fasi precoci dopo il trapianto, tali reperti sono più spesso associati a danno ischemico peri-operatorio; nelle biopsie tardive, sono indubbiamente suggestivi di rigetto.
L’edema interstiziale può essere un segno di rigetto anticorpo-mediato. Tuttavia, la dissociazione artefattuale dei miociti, dovuta sia alla manipolazione dei frammenti bioptici che alla loro processazione, può simulare l’edema. Nell’edema vero, i miociti sono separati da matrice eosinofila. Inoltre, nel rigetto anticorpo-mediato, dovrebbero essere presenti anche altri reperti, come la prominenza delle cellule endoteliali dei capillari, macrofagi interstiziali e/o emorragia.
Miocitolisi (da coronaropatia del graft)
La vacuolizzazione miocitaria subendocardica, focale o diffusa, e la miocitolisi possono essere indicativi di danno ischemico reversibile. Nella miocitolisi, il citoplasma delle miocellule è chiarificato, i nuclei sono ingranditi e anch’essi chiarificati ed i nucleoli prominenti. Se la lesione è presente in una biopsia endomiocardica effettuata dopo un anno dal trapianto, potrebbe anche essere la spia di una coronaropatia stenosante del graft accelerata.
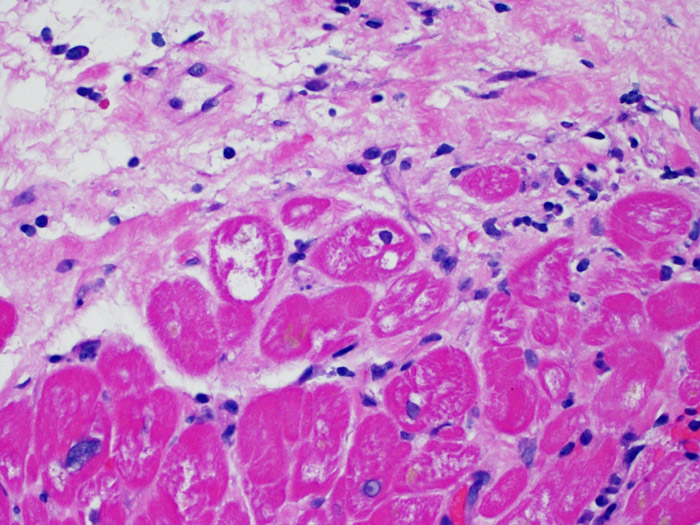
Alterazioni delle cellule endoteliali (nel rigetto anticorpo-mediato)
I criteri per la diagnosi di rigetto acuto anticorpo-mediato saranno presentati in un’altra sezione del tutorial. Uno dei reperti che può indurre il sospetto di AMR, osservando a piccolo ingrandimento sezioni colorate con ematossilina-eosina, è la prominenza dei capillari e delle venule che, a maggiore ingrandimento, mostrano cellule endoteliali di aumentate dimensioni e “rigonfie”, con nuclei ingranditi ed ipercromici. Tali reperti sono indicativi di AMR e richiedono ulteriori indagini per valutare la presenza di immunoglobuline e complemento.
Rigetto
Questa sezione del tutorial si occupa dei principali criteri istologici per la diagnosi di rigetto cellulare acuto ed ha lo scopo di consolidare i punti chiave già affrontati nelle parti dell’osservazione a piccolo e ad alto ingrandimento. Troverete anche degli accenni al rigetto anticorpo-mediato, che sarà tuttavia trattato in dettaglio in un prossimo tutorial.
Infiltrati linfocitari
L’infiltrato linfocitario è il reperto istologico di centrale importanza nel rigetto cellulare acuto. A piccolo ingrandimento, si presenta come un’area di aumentata cellularità; a maggiore ingrandimento, si potrà valutare la presenza o meno del danno miocitario provocato dai linfociti. I linfociti attivati associati a danno miocitario hanno in genere nucleo e citoplasma più grandi di quelli quiescenti.
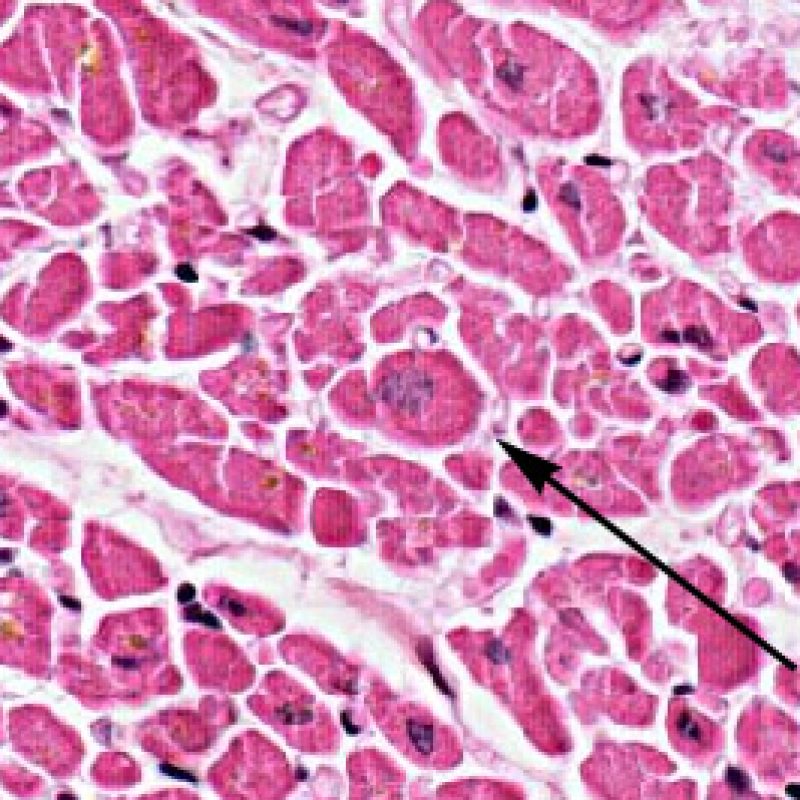
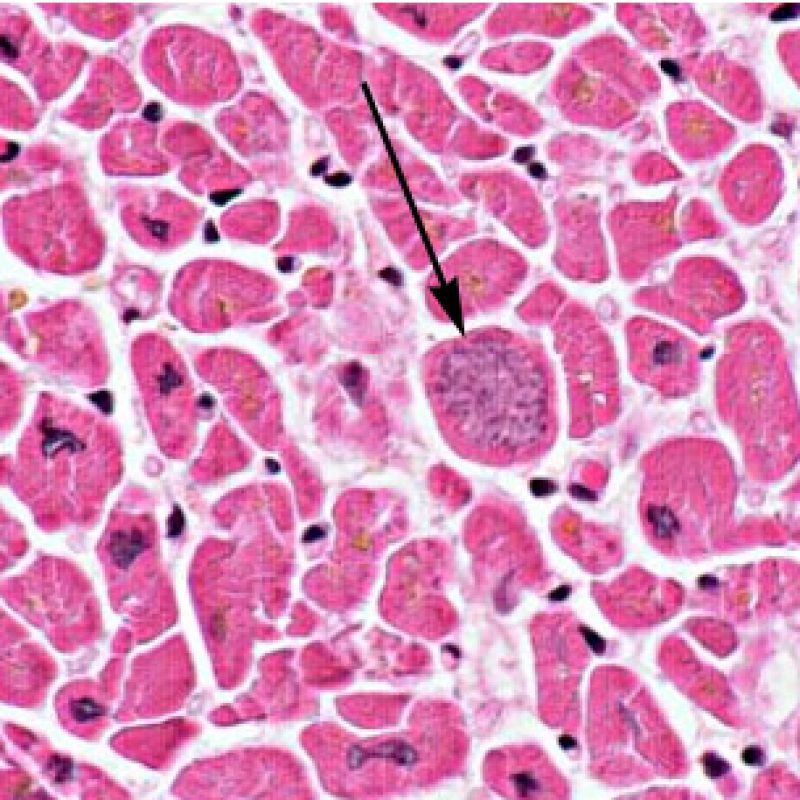
Danno miocitario
La caratteristica istologica principale che consente di discriminare fra rigetto a basso e ad alto (2R e 3R) grado è la presenza del danno miocitario. Per poterne studiare accuratamente le varie caratteristiche, tale lesione va valutata ad alto ingrandimento, che consente di rilevare l’ipereosinofilia, la picnosi nucleare, la miocitolisi, la necrosi coagulativa, le vacuolizzazioni citoplasmatiche o perinucleari e l’aggressione dei miociti da parte dei linfociti. Talora, il danno miocitario può manifestarsi come un’area di marcata infiammazione linfocitaria, che ha causato la distruzione dei miociti (sono presenti spazi vuoti laddove avrebbero dovuto essere i miociti) o la loro frammentazione.
Rigetto anticorpo-mediato
Il rigetto anticorpo-mediato (AMR, rigetto umorale AKA) ha caratteristiche diverse da quello cellulare, tranne che nei casi severi, nei quali i reperti istologici possono sovrapporsi. Le alterazioni istopatologiche del rigetto anticorpo-mediato sono costituite, al microscopio ottico, dal rigonfiamento delle cellule endoteliali vascolari, dalla presenza di aggregati di cellule mononucleate che riempiono il lume dei piccoli vasi e dall’edema. Per la valutazione di tale rigetto bisogna eseguire l’immunocolorazione per il fattore C4d del complemento. Sarà presto disponibile un secondo tutorial appositamente dedicato al rigetto anticorpo-mediato.
Reperti non legati al rigetto
Questa sezione del tutorial si occupa di diverse alterazioni non legate al rigetto, che possono essere riscontrate nei campioni bioptici. Alcuni reperti sono frequenti; altri estremamente rari. Poiché molti di essi vengono facilmente confusi con quelli del rigetto, è cruciale saperli individuare e distinguere, per non incorrere nel rischio di sovrastimare la diagnosi di rigetto.
Effetto Quilty
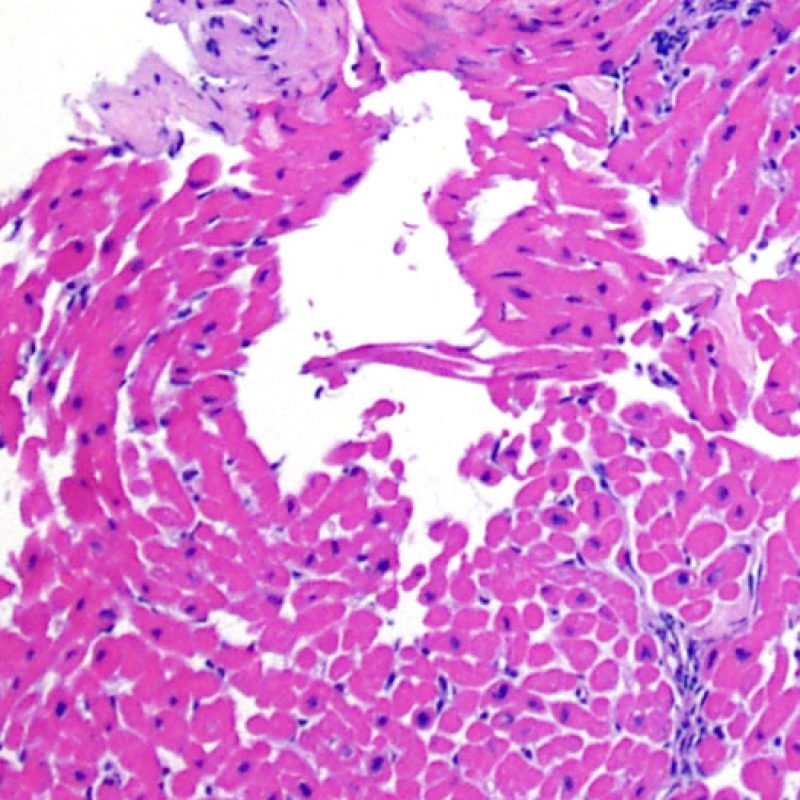
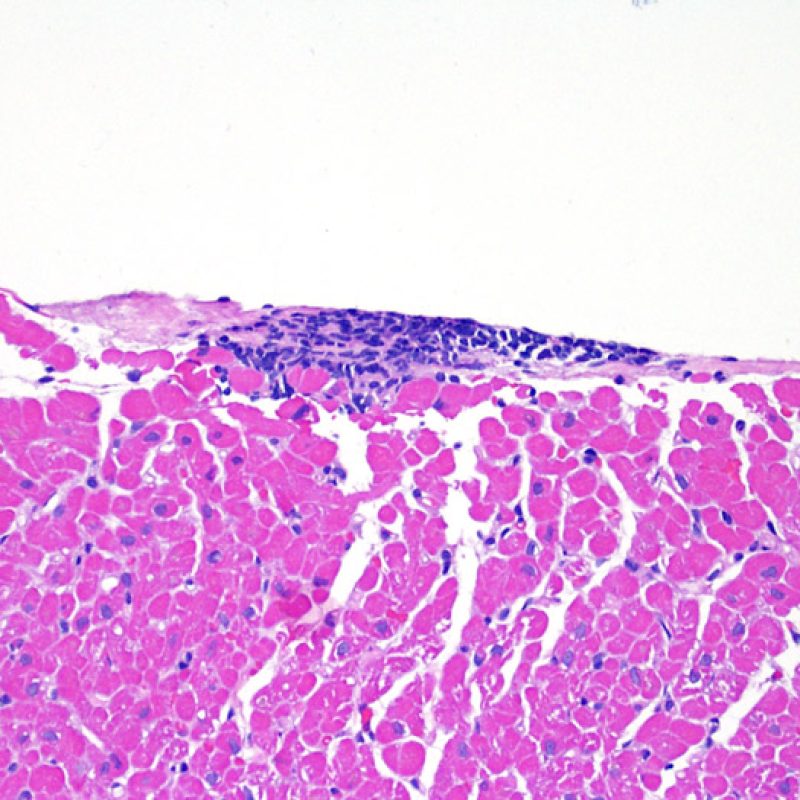
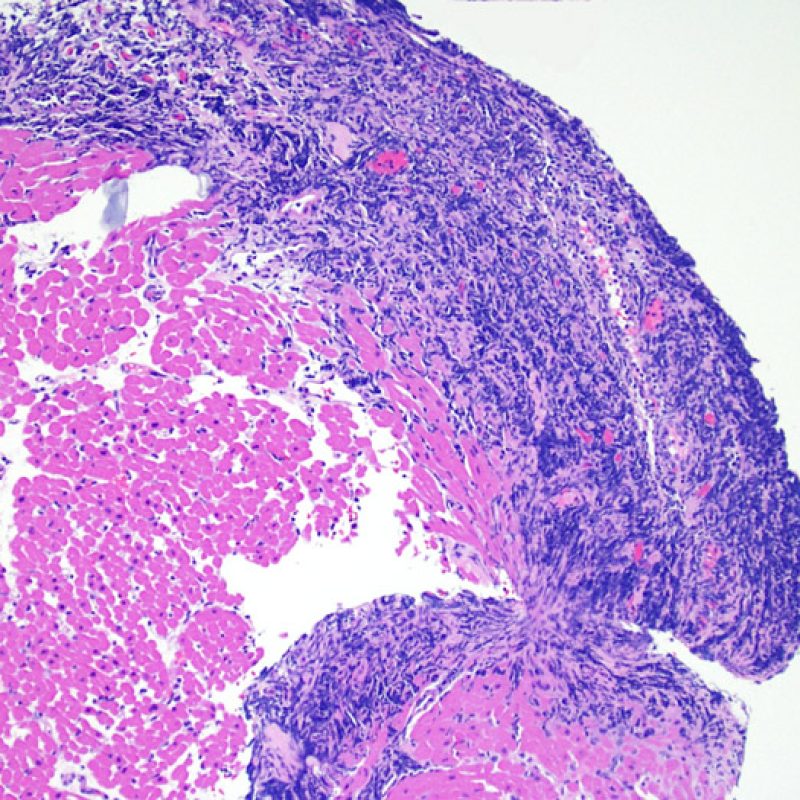
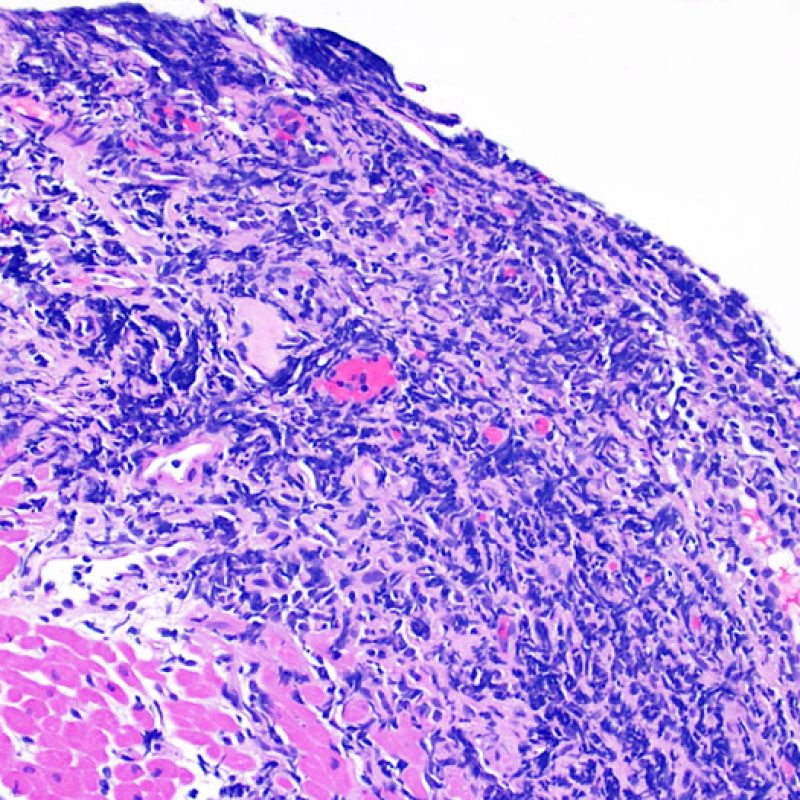
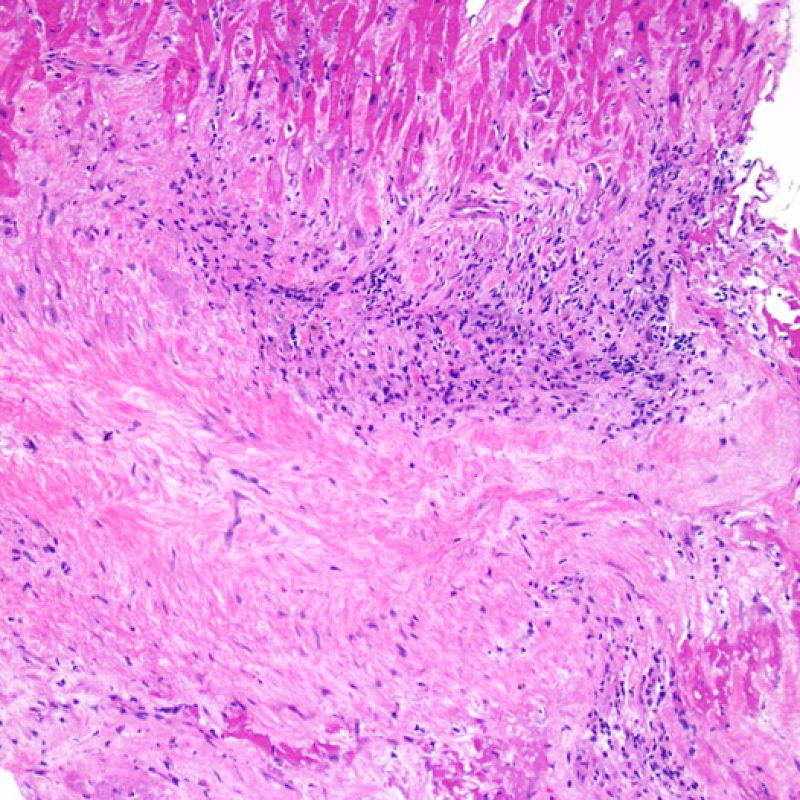
Nelle biopsie endomiocardiche del 50% circa dei pazienti trapiantati, possono essere presenti aggregati subendocardici di linfociti, focali e compatti, che talora si estendono all’adiacente miocardio. Questi reperti, di frequente riscontro, sono denominati “effetto Quilty” (in precedenza erano stati chiamati lesioni Quilty, dal nome dal primo paziente in cui furono descritti) e sono costituiti da linfociti B e T e da occasionali cellule dendritiche. Alcuni di tali infiltrati infiammatori possono contenere anche piccoli canali vascolari (capillari).
La patogenesi dell’effetto Quilty non è nota, ma alcune ipotesi chiamano in causa i protocolli immunosoppressivi a base di ciclosporina, le risposte idiosincrasiche alla ciclosporina A o una concomitante infezione da virus di Epstein-Barr. D’altra parte, l’effetto Quilty non compare nei cuori di pazienti che hanno assunto ciclosporina A per il trapianto di altri organi solidi (ad es. fegato o reni). Molti gruppi di ricerca hanno studiato le possibili relazioni fra l’effetto Quilty ed altre variabili, quali il grado di rigetto cellulare, le infezioni virali, il rigetto anticorpo-mediato e/o lo sviluppo della vasculopatia del graft: i risultati contrastanti di tali studi rendono tuttora interessante quest’area di ricerca. Nel complesso, comunque, non c’è accordo sulle possibili associazioni fra l’effetto Quilty ed altri reperti istopatologici o fattori predittivi di esito.
L’effetto Quilty può rimanere confinato all’endocardio o estendersi all’adiacente miocardio. I linfociti che compongono tali lesioni, soprattutto quando sono molto estese, possono andare a localizzarsi fra i miociti sottostanti, realizzando un danno miocitario peri-Quilty. Si pensa che questo fenomeno, mimando il rigetto, costituisca spesso il substrato istologico del grado 2 della classificazione ISHLT-1990. Quando ci si trova davanti ad un’eventualità di questo tipo, bisogna tentare di accertare se si tratta effettivamente di rigetto: per la diagnosi differenziale, vanno eseguite sezioni seriate multiple, alla ricerca di una componente subendocardica dell’infiltrato infiammatorio (anche il rigetto cellulare acuto può però avere una distribuzione endocardica). Piccoli vasi o capillari localizzati nel contesto dell’infiltrato infiammatorio possono, quando presenti, essere di estrema utilità nel far propendere per un effetto Quilty. In questa lesione, inoltre, lo stroma perimiocitario può essere più fibroso.
In alcuni casi, si rende opportuno tipizzare con indagini immunoistochimiche i linfociti, in quanto le lesioni Quilty sono in genere costituite da una mescolanza di cellule B e T e di macrofagi, reperto che le contraddistingue dal rigetto cellulare acuto, in cui prevalgono i linfociti T. Si può utilizzare anche la colorazione per il CD21 che, quando positiva, costituisce un marker fortemente suggestivo di effetto Quilty; la negatività per tale anticorpo non ha invece alcun significato.
Se gli effetti Quilty compaiono in più frammenti bioptici, è altamente probabile che un focolaio infiammatorio intramiocardico corrisponda anch’esso ad un effetto Quilty: la diagnosi di rigetto non può però essere esclusa su questa sola base. Quando le lesioni Quilty vanno incontro a guarigione, si formano delle piccole cicatrici, che talora sono interpretate come precedenti siti bioptici: in genere, le cicatrici conseguenti ai Quilty tendono ad avere margini più regolari e lineari di quelle dovute ad esiti di biopsia.
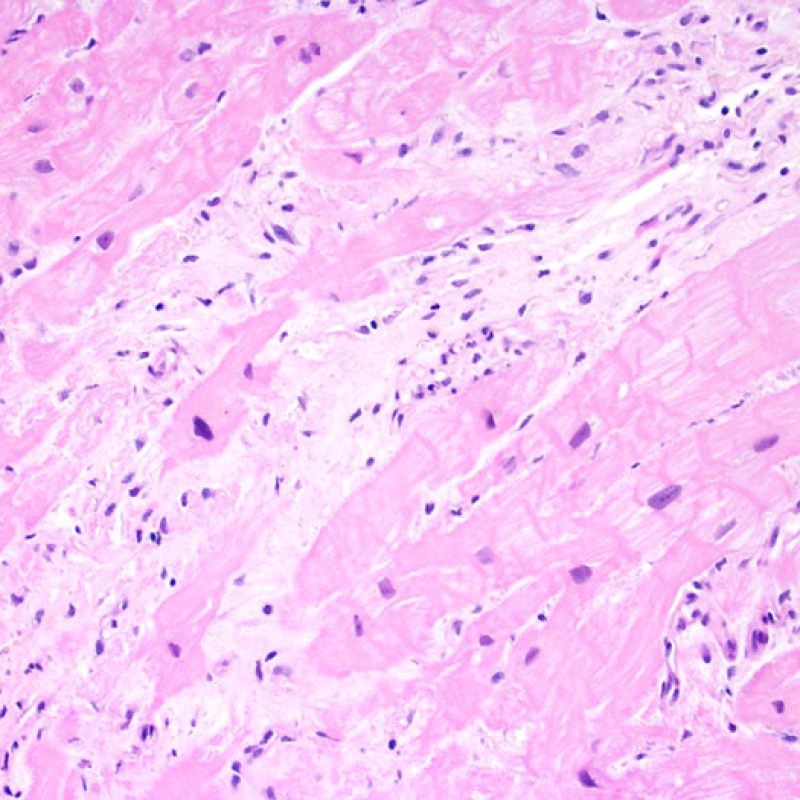
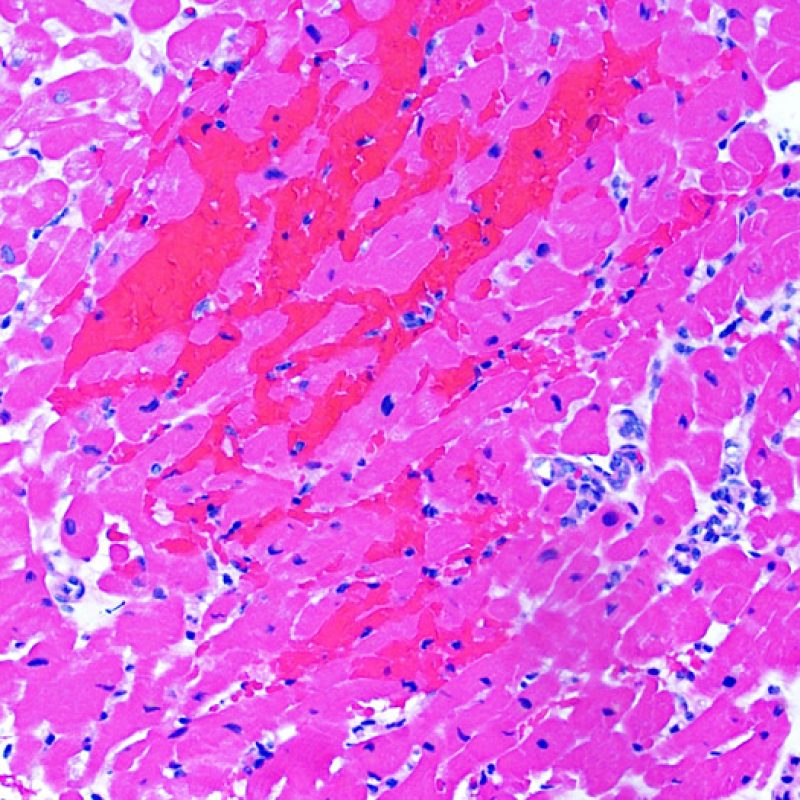
Danno ischemico (peri-operatorio)
Il danno ischemico (danno peri-operatorio) è più frequente nelle biopsie effettuate nelle 6 settimane successive al trapianto, anche se può perdurare fino a tre mesi: talora, è difficilmente distinguibile dal rigetto cellulare acuto. Durante il cd. periodo di ischemia, quando il cuore viene trasferito dal donatore al ricevente, aggregati più o meno ampi di miociti vanno incontro a morte. Nella prima biopsia dopo il trapianto, la morte dei miociti può essere quasi impercettibile ed evidenziarsi solo con un aumento dell’eosinofilia citoplasmatica e l’assenza dei nuclei. Le miocellule morte si colorano fortemente con il C4d, sia con tecniche di immunoperossidasi che di immunofluorescenza, reperto che non va ovviamente confuso con il rigetto anticorpo-mediato. E’ possibile che la morte dei miociti intervenga anche a distanza dal trapianto ma, in questi casi, l’assenza di infiltrato linfocitario consente agevolmente di distinguere tale reperto dal rigetto cellulare acuto. A causa della forte immunosoppressione, l’infiammazione può mancare anche nelle fasi precoci.
Il processo infiammatorio, dovuto principalmente ad una risposta mediata dai macrofagi, si evidenzia maggiormente fra le 2 e le 4 settimane dopo il trapianto, quando può essere molto esteso ed associato a danno miocitario. La composizione mista di tale infiltrato infiammatorio consente di distinguere il danno ischemico dal rigetto cellulare acuto, tipicamente caratterizzato da un infiltrato ricco in linfociti. Il danno ischemico è inoltre spesso associato ad un interstizio “sporco”. Quando il rigetto cellulare ed il danno ischemico coesistono nella stessa biopsia, può essere davvero difficile differenziarli: in questi casi, per quanto si abbia la tendenza a sopravvalutare l’entità del rigetto, bisognerebbe essere prudenti, tanto più che la maggior parte di tali pazienti ripeterà il controllo bioptico entro una settimana o due.
La maggior parte delle lesioni ischemiche assume, dopo il primo mese, l’aspetto di piccoli infarti in risoluzione, che sono caratterizzati da macrofagi carichi di pigmento, da tessuto connettivo lasso e da perdita localizzata dei miociti: in questa fase, è facile distinguere il danno ischemico dal rigetto cellulare, anche se c’è il rischio di interpretarlo come un precedente sito bioptico.
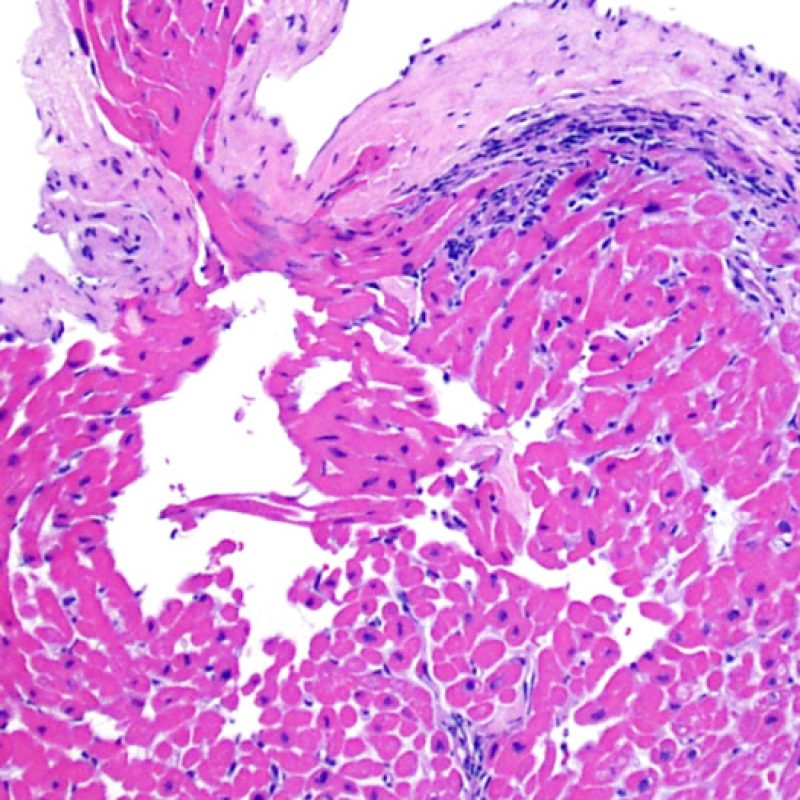
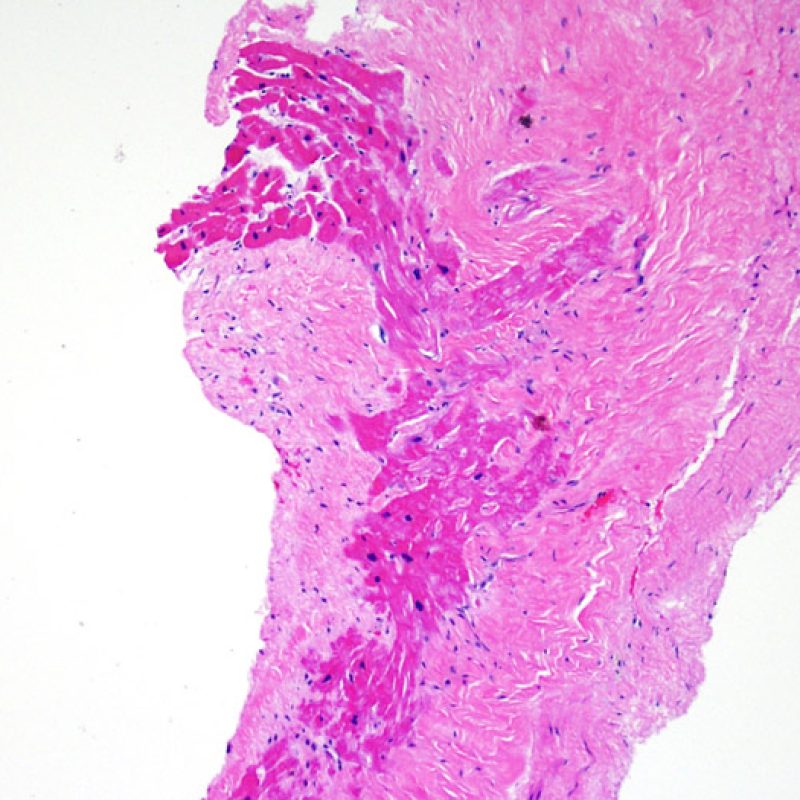
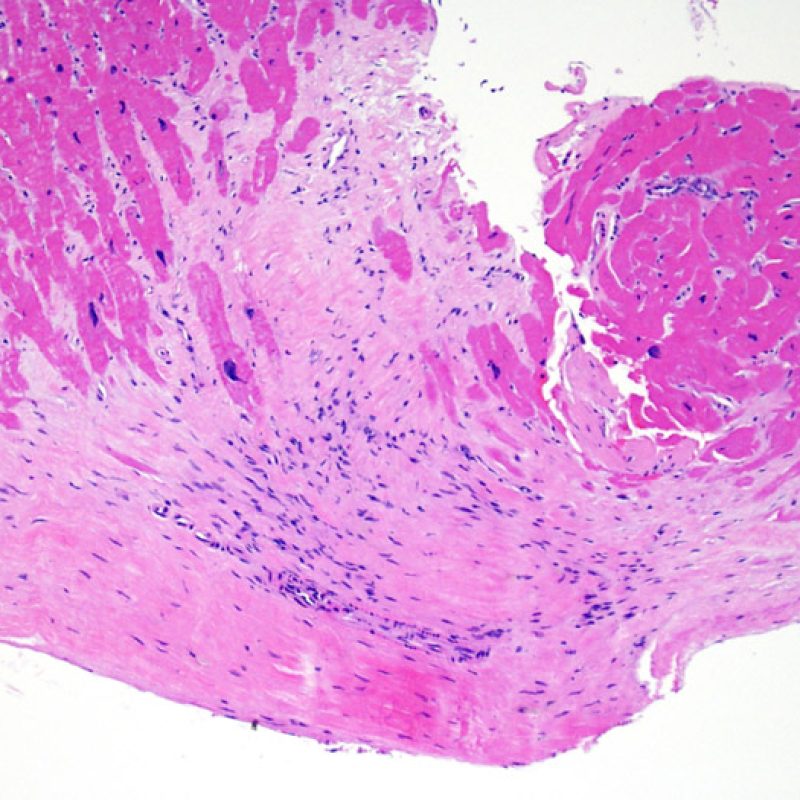
Alterazioni da sito bioptico e materiale trombotico
Poiché la conformazione del ventricolo destro fa sì che il biotomo si indirizzi frequentemente nelle medesime aree, è necessario saper riconoscere, nei pazienti trapiantati, le alterazioni istologiche causate da precedenti biopsie. Tali alterazioni cambiano in rapporto all’intervallo che intercorre fra le biopsie. Un sito bioptico recente si presenta come un’alterazione endomiocardica focale, associata ad alcune cellule infiammatorie (macrofagi, linfociti T e B) e rivestita da materiale fibrino-piastrinico o da un trombo in organizzazione. Nella fase riparativa, interviene la formazione di tessuto di granulazione, che esiterà in una cicatrice endocardica focale. I miociti adiacenti all’area cicatriziale potranno mostrare focali alterazioni architetturali e/o irregolare ipertrofia o essere francamente disorganizzati (myocyte disarray). La probabilità di prelevare un precedente sito bioptico nei pazienti sottoposti a ripetute biopsie endomiocardiche varia da 1 su 7 fino al 70% dei casi.
L’infiammazione presente nelle aree di precedente biopsia non ha quindi il significato di rigetto cellulare e non va di conseguenza gradata. In conclusione, una biopsia può essere negativa per rigetto (0R), ma presentare ugualmente un’area di infiammazione legata ad un sito bioptico.
Linfociti intravascolari
In alcuni pazienti, possono comparire raccolte di linfociti che zaffano un canale linfatico. Tale reperto, la cui eziologia non è nota, non è comunque correlato al rigetto e non va segnalato.
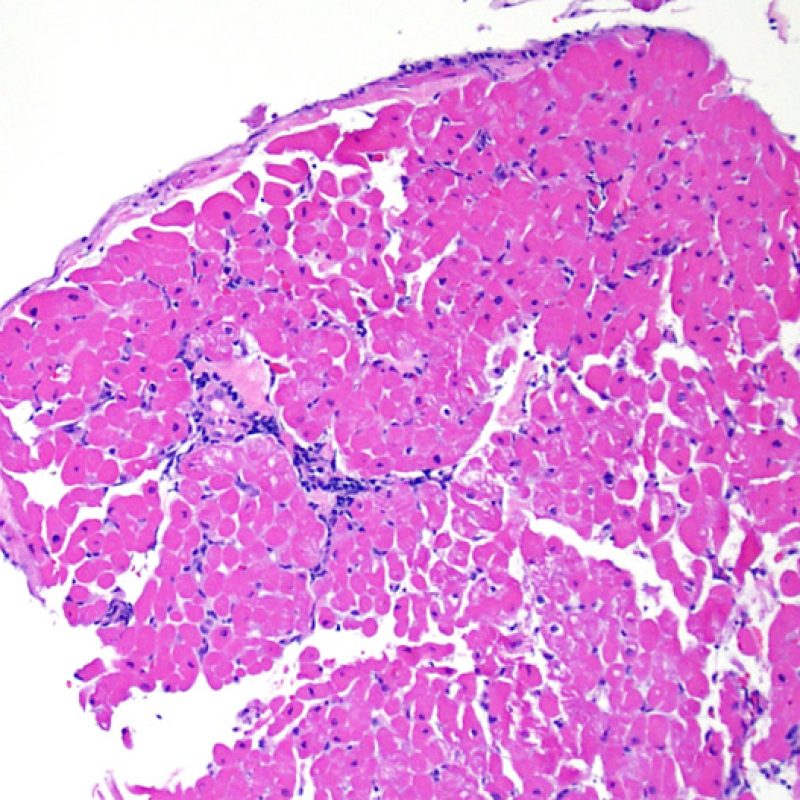
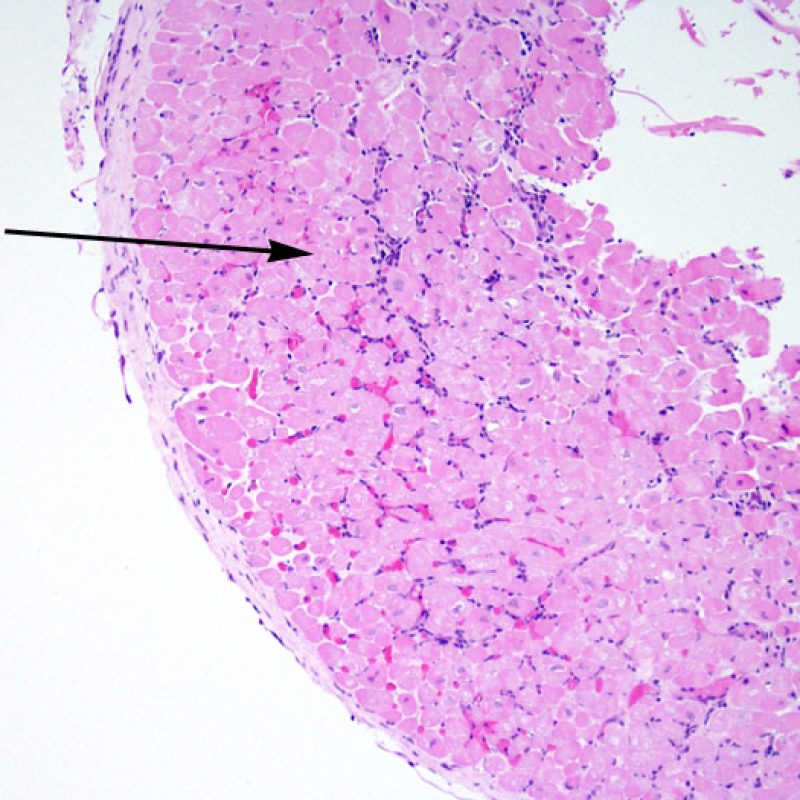
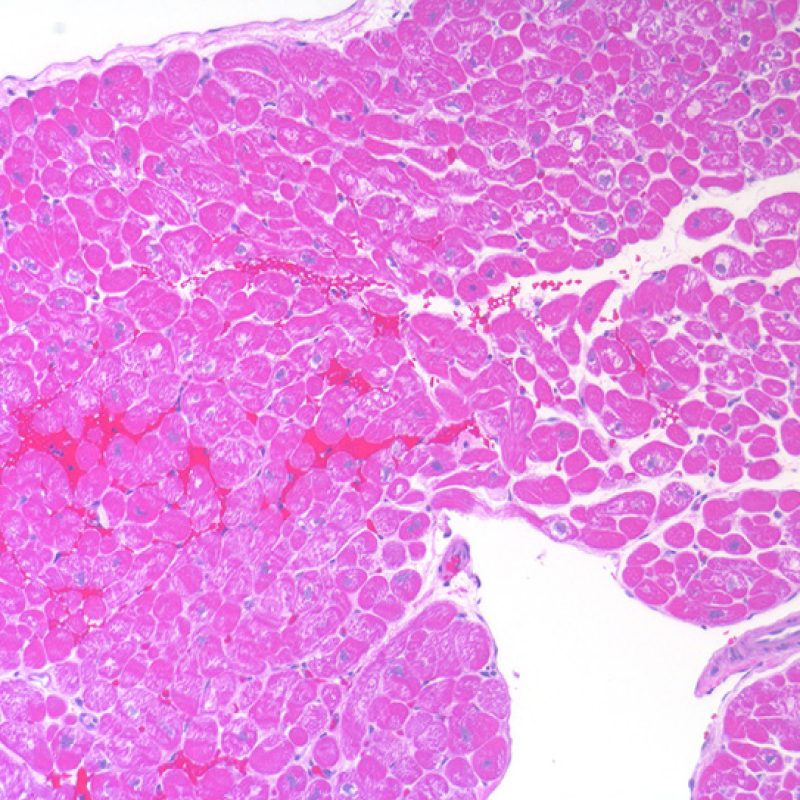
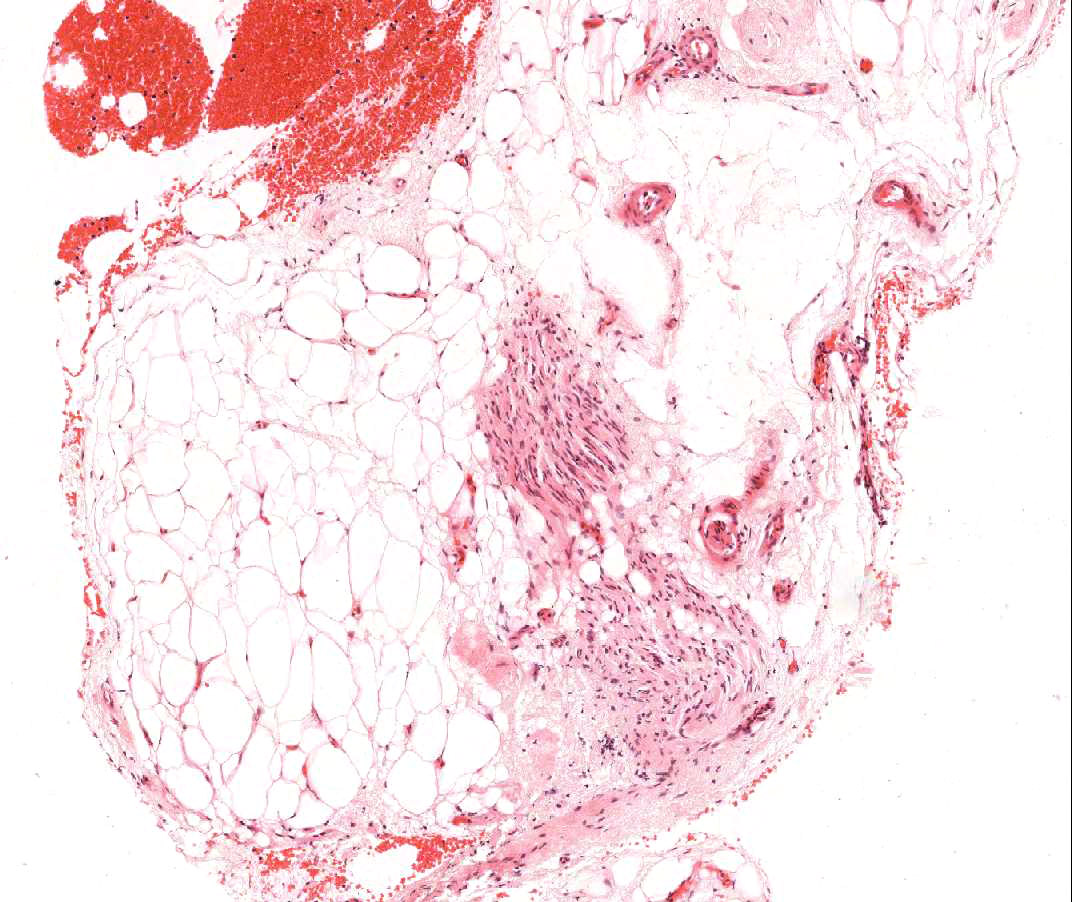
Cellule adipose e mesoteliali
Il tessuto adiposo, per quanto scarso, è un normale componente del miocardio e spesso lo si reperta in prossimità di arteriole di maggiori dimensioni. Occasionalmente, i campioni bioptici comprendono gruppi di adipociti o vero e proprio tessuto adiposo, nel cui contesto si rinvengono talora piccole aree di miocardio non compatto. Questi frammenti provengono dalla parete libera del ventricolo destro e, oltre a non essere idonei per la valutazione del rigetto, hanno scarso significato. In alcuni casi, però, la presenza di cellule adipose può essere preoccupante: questo accade quando si evidenziano lembi di mesotelio attaccati al tessuto adiposo, o anche semplicemente sparsi nell’inclusione, o quando il tessuto adiposo contiene piccoli nervi. Tali reperti indicano che è stato prelevato grasso epicardico e che può essersi verificata una perforazione: è necessario, quindi, comunicare urgentemente con il clinico per informarlo di tale evenienza e del rischio che possa svilupparsi un significativo emopericardio. Nella maggior parte dei pazienti trapiantati, comunque, il rischio di un emopericardio fatale è significativamente ridotto rispetto ai pazienti non trapiantati, perché si realizzano aderenze post-operatorie.
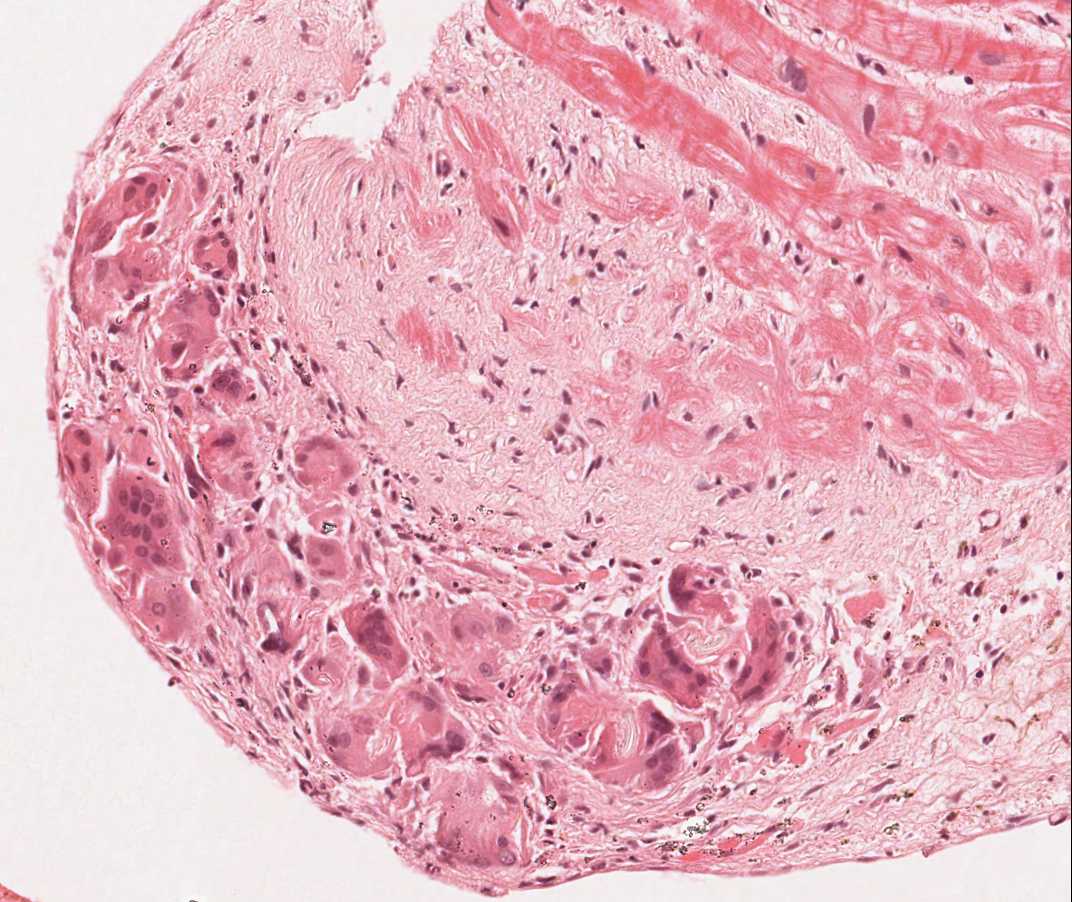
Calcificazioni dei miociti
La presenza di calcificazioni intramiocitarie è un reperto estremamente raro nel trapianto cardiaco ed è verosimilmente correlato allo sviluppo di un’ipercalcemia transitoria durante l’intervento chirurgico del trapianto. E’ possibile riscontrarle anche in concomitanza di quadri d’insufficienza renale acuta o cronica o nei siti bioptici di vecchia data. Le calcificazioni possono interessare singoli miociti o gruppi di essi, che spesso risultano circondati da fibrosi; in genere, non si associa infiammazione. Per quanto la presenza di estese calcificazioni possa ripercuotersi negativamente sulla funzionalità cardiaca, questo reperto non è in alcun modo correlato al rigetto cellulare acuto.
Recidiva della malattia di base
E’ noto che alcune patologie che causano scompenso cardiaco possono recidivare nel cuore trapiantato: fra queste, la sarcoidosi, la miocardite a cellule giganti, l’amiloidosi, la malattia di Chagas e quella da depositi di catene leggere. E’ quindi importante che Il patologo sia sempre informato sulla patologia di base che ha portato al trapianto il paziente, in modo da poterne monitorare l’eventuale recidiva. In particolare, va sottolineato che la sarcoidosi e la miocardite a cellule giganti possono simulare il rigetto cellulare acuto.
Infezioni
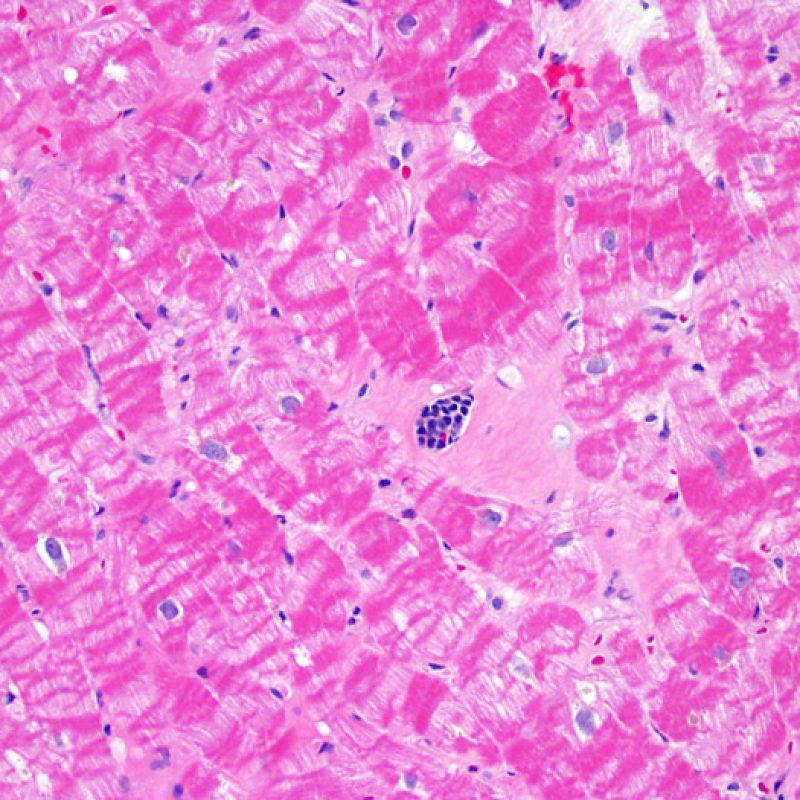
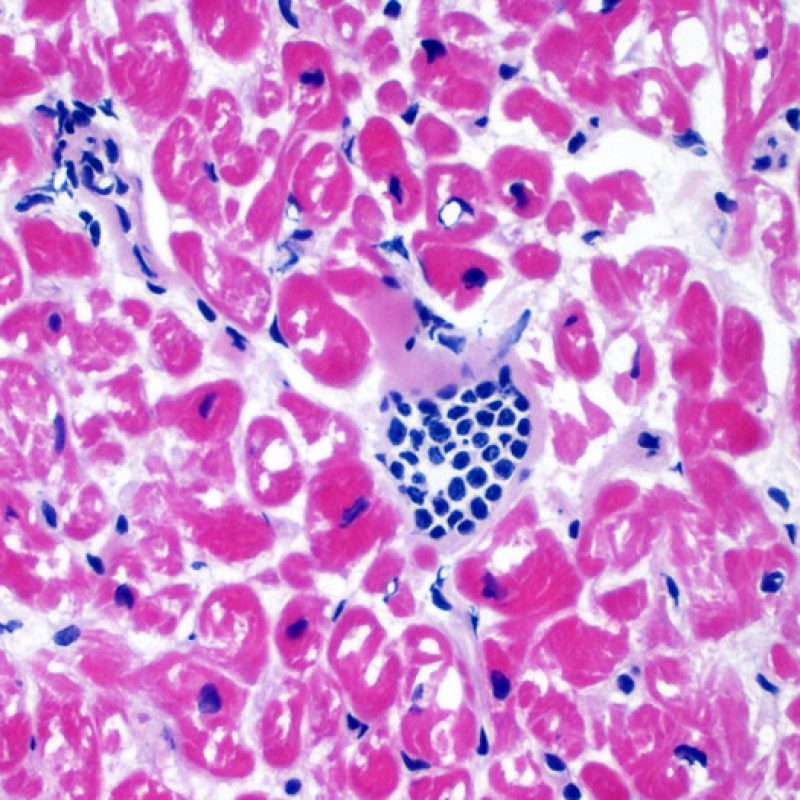
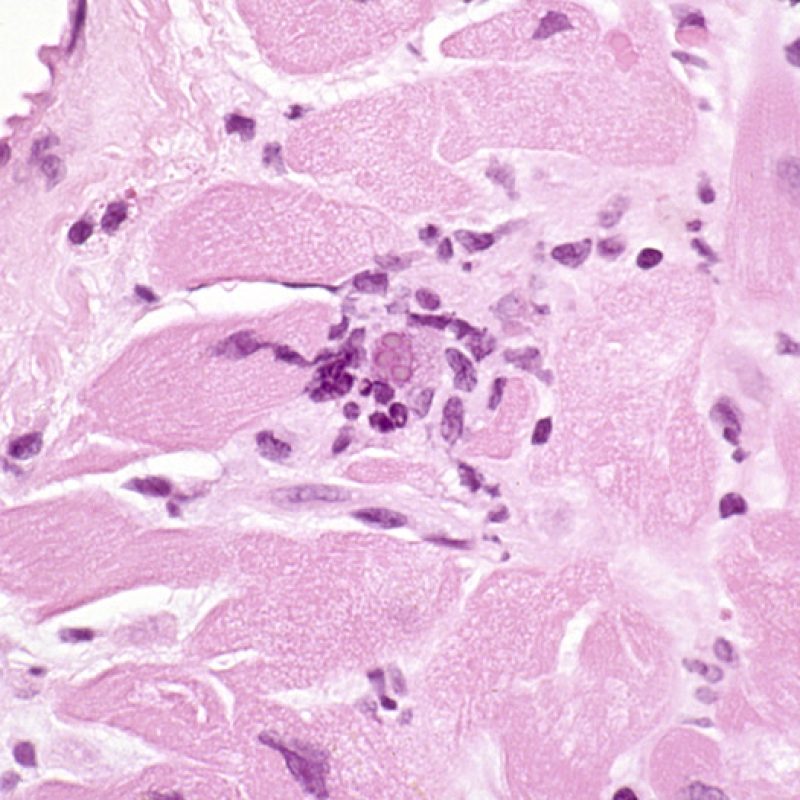
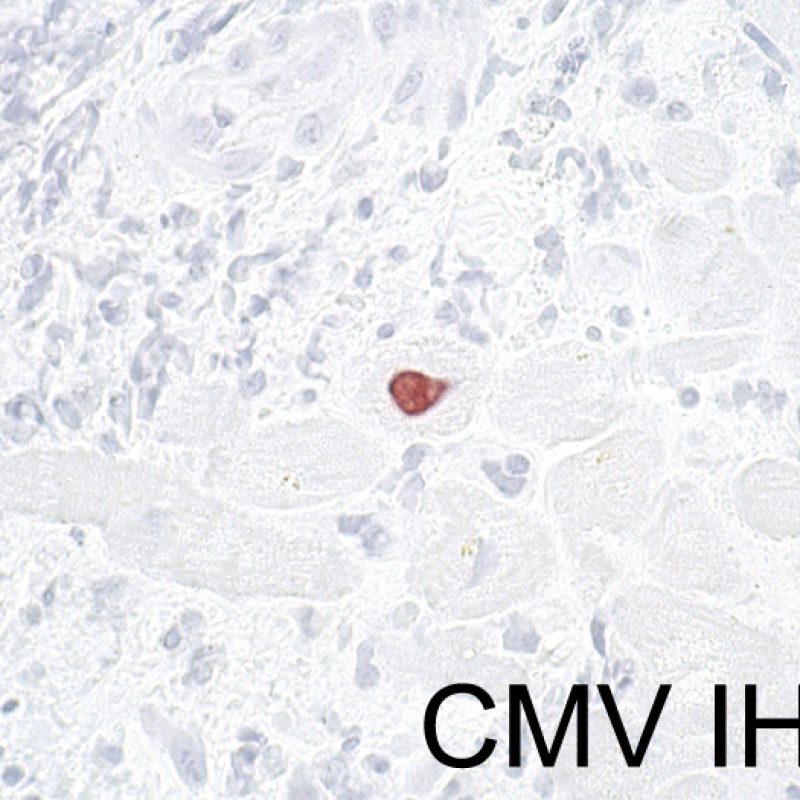
Anche se i pazienti trapiantati hanno un elevato rischio di sviluppare infezioni, in quanto farmacologicamente immunodepressi, è davvero infrequente riscontrarle in una biopsia endomiocardica. La presenza del citomegalovirus (CMV) è stata ad esempio documentata nel materiale bioptico, ma tale infezione viene più opportunamente monitorata con indagini sierologiche (solo quando il ricevente era negativo per il CMV prima del trapianto) o tramite il prelievo di altri tessuti (ad es. l’esofago). In ogni caso, è possibile identificare nel materiale bioptico inclusioni virali, che vanno ulteriormente caratterizzate con colorazioni immunoistochimiche, sia per il CMV che per altri virus. Anche l’infezione da Toxoplasma è stata descritta nei cuori trapiantati: i bradizoiti si localizzano nel citoplasma delle miocellule senza evocare una significativa reazione infiammatoria; quando sussiste un sospetto in tal senso, si può procedere allo studio immunoistochimico. La presenza di un’infezione va comunicata al clinico, ma bisogna prestare particolare attenzione a non scambiare un quadro di rigetto cellulare acuto con un’infezione.
Disordini linfo-proliferativi post-trapianto (PTLD)
Per quanto i disordini linfo-proliferativi post-trapianto (PTLD) intervengano in una discreta percentuale (più del 6%) dei pazienti trapiantati, è estremamente insolito diagnosticarli su BEM. Istologicamente, sono costituiti da infiltrati di linfociti B che simulano il rigetto cellulare acuto. Sono in genere positivi per il virus di Epstein-Barr (EBV), per cui, nei casi sospetti, bisogna procedere all’ibridazione in situ per l’EBV e alla caratterizzazione immunoistochimica dei linfociti B (anticorpo anti-CD20). La diagnosi di PTLD va talora presa in considerazione quando un paziente non risponde alla terapia di quello che era stato interpretato come un rigetto cellulare acuto. Nei casi in cui si evidenzia un numero significativo di plasmacellule, reperto insolito in una BEM, può essere opportuno valutare un eventuale PTLD plasmacitoide. Raramente, anche linfomi a cellule T possono causare un PTLD.
Materiale estraneo
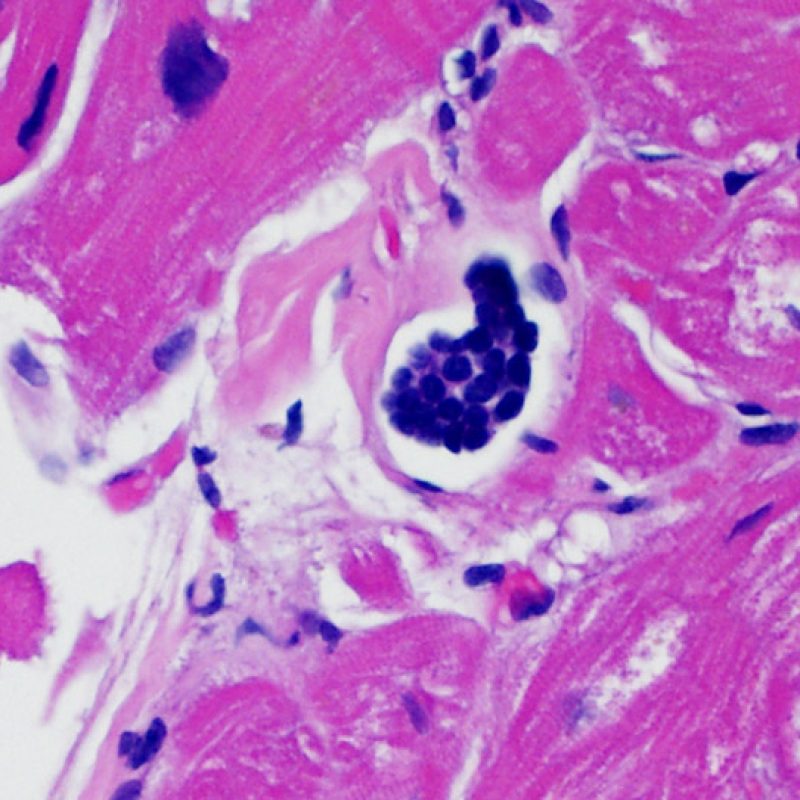
Nell’endocardio di pazienti trapiantati che abbiano eseguito biopsie ripetute, è possibile riscontrare piccoli aggregati di cellule giganti da corpo estraneo, contenenti talora materiale rifrangente. Questo materiale corrisponde probabilmente a microscopici frammenti di cotone, provenienti dalle garze che sono state utilizzate per pulire il biotomo fra un prelievo e l’altro.
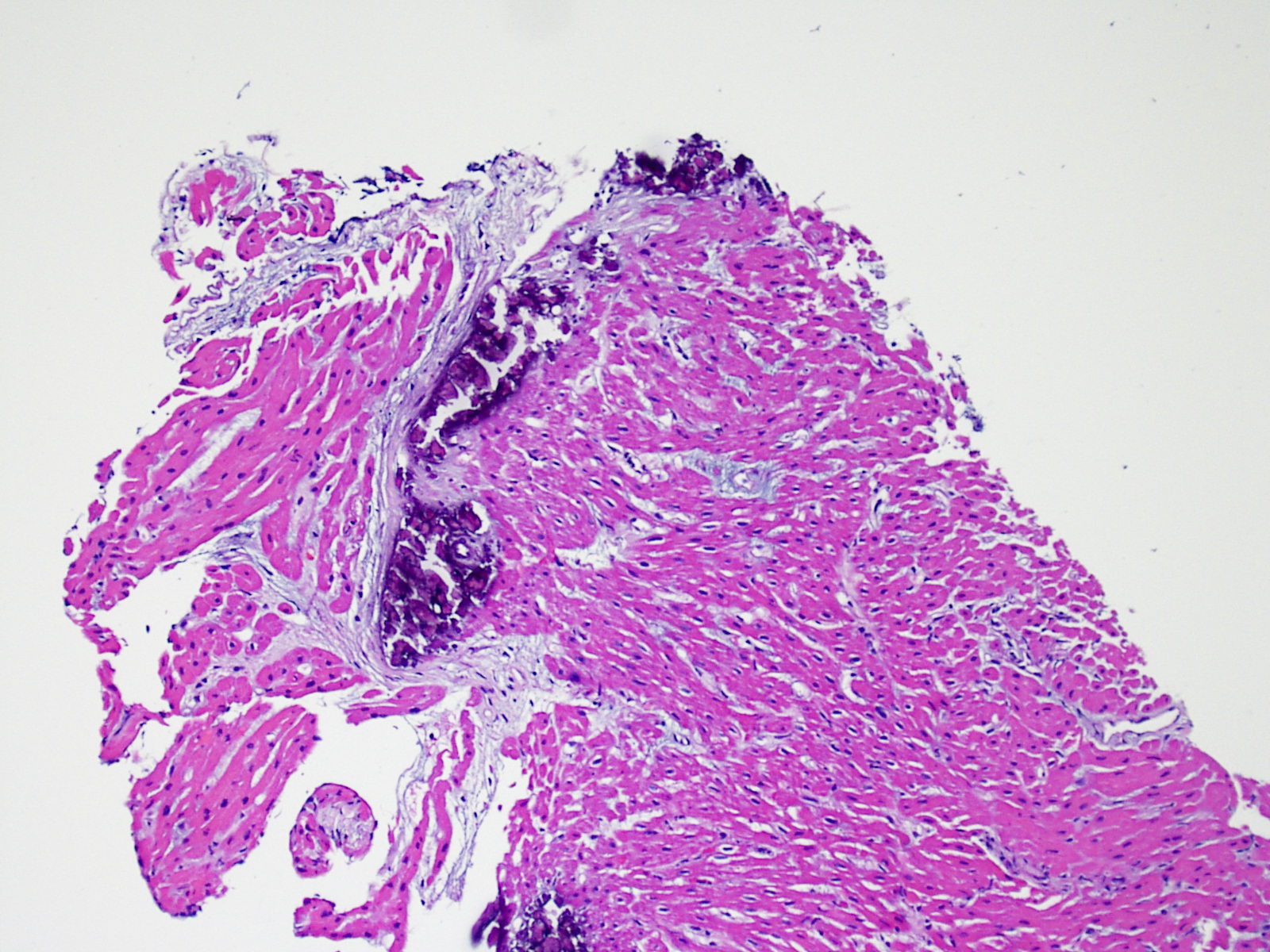
Frammenti di valvola tricuspide e frammenti di tessuto epatico
Il 12% circa dei pazienti trapiantati sviluppa, negli anni successivi al trapianto, un soffio tricuspidalico, che più frequentemente è causato dallo scompenso cardiaco congestizio, dalla dilatazione dell’annulus valvolare o dall’ipertensione polmonare. Più raramente, la causa è rappresentata dalla lacerazione accidentale della cuspide valvolare o dal sezionamento di una corda tendinea da parte del biotomo che attraversa la valvola tricuspide. Quando si rinvengono frammenti di tessuto valvolare o delle corde tendinee, è comunque opportuno informare il clinico. Se la biopsia di una corda tendinea è in genere ben tollerata, una lacerazione sufficientemente ampia di un lembo valvolare può incidere in modo significativo sulla funzione del graft. Un frammento di valvola o di corda tendinea si presenta come un esile frustolo di tessuto fibroso, le cui fibre sono allineate parallelamente all’asse longitudinale del frammento, rivestito da cellule endoteliali da ambo i lati: quest’ultimo reperto lo contraddistingue da un frammento di endocardio inspessito, anche se tale distinzione può non essere sempre facile.
Anche se molto raramente, può accadere che il biotomo passi dalla vena cava superiore in quella inferiore senza che il clinico se ne accorga: in questo caso, verranno prelevati dei frustoli di tessuto epatico invece che campioni di miocardio. Oltre a questa eventualità, la presenza di tessuto epatico in un vetrino può essere dovuta ad una possibile contaminazione avvenuta nel laboratorio di istopatologia.
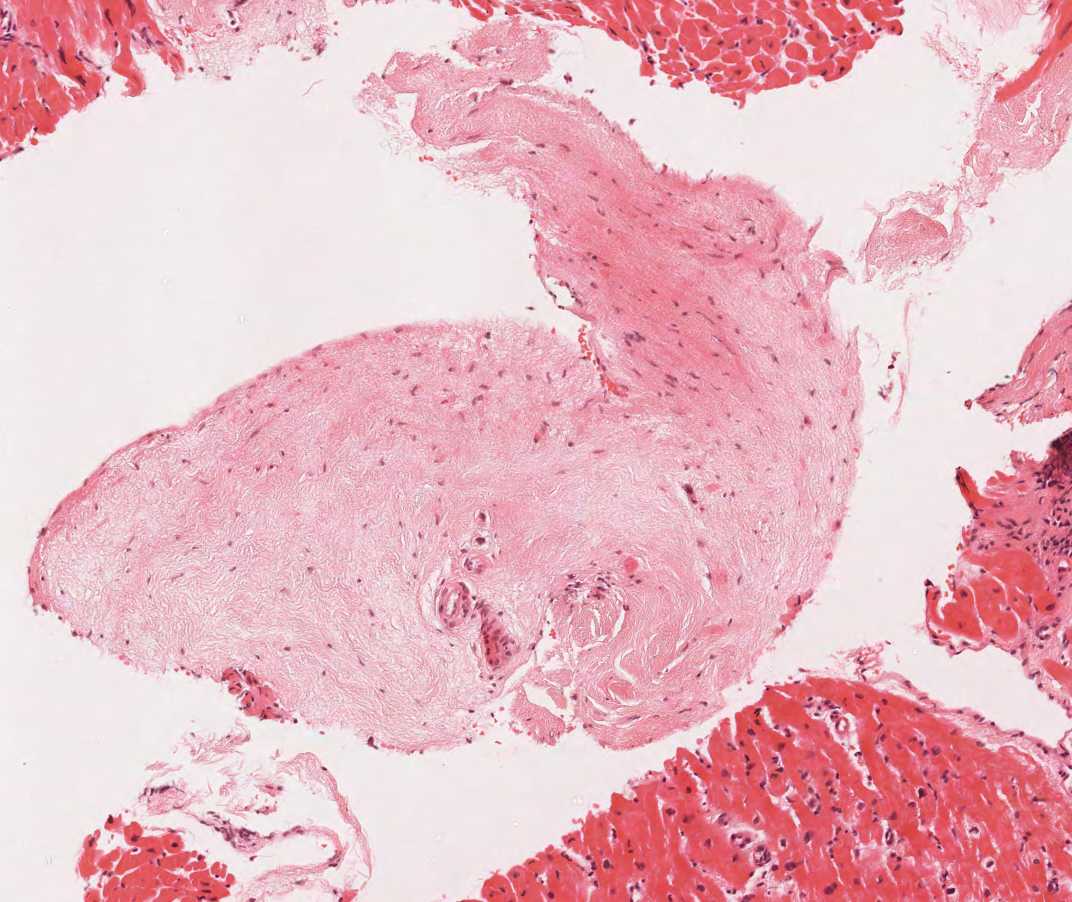
Artefatti
Questa sezione si occupa dei principali artefatti che possono comparire nelle biopsie endomiocardiche e che rischiano, talora, di essere erroneamente interpretati come aspetti patologici.
Bande di contrazione
Quando le biopsie miocardiche vengono prelevate e poste in formalina, devono essere maneggiate con delicatezza, al fine di prevenire il realizzarsi di artefatti da schiacciamento. Ma, per quanto siano manipolate con accuratezza, è inevitabile che si verifichi la retrazione dei miociti, perché la biopsia è per definizione una piccola ferita praticata nel miocardio. La formazione di bande è più accentuata se il fissativo è refrigerato invece che conservato a temperatura ambiente. Le bande Z si inspessiscono, i sarcomeri diventano ipercontratti, ma le miofibrille restano intatte. Il risultato è il costituirsi di bande di contrazione che, per quanto possano essere estese e di frequente riscontro, non hanno alcun significato patologico.
Le bande di contrazione vanno distinte dalla necrosi a bande di contrazione/miocitolisi, che può comparire in varie condizioni: a seguito del danno da riperfusione post-operatorio, nei pazienti sottoposti a terapie con inotropi ad alto dosaggio, in numerose altre circostante cliniche e nei cuori di donatori deceduti per emorragia cerebrale. Questo tipo di necrosi può colpire miociti singoli o in piccoli gruppi ed è circondata da miocardio normale. Le bande Z fra i miociti sono interrotte; le miofibrille dei sarcomeri vanno incontro a frammentazione e mostrano una granularità di tonalità basofila, dovuta alla mineralizzazione conseguente ai depositi intracellulari di calcio.
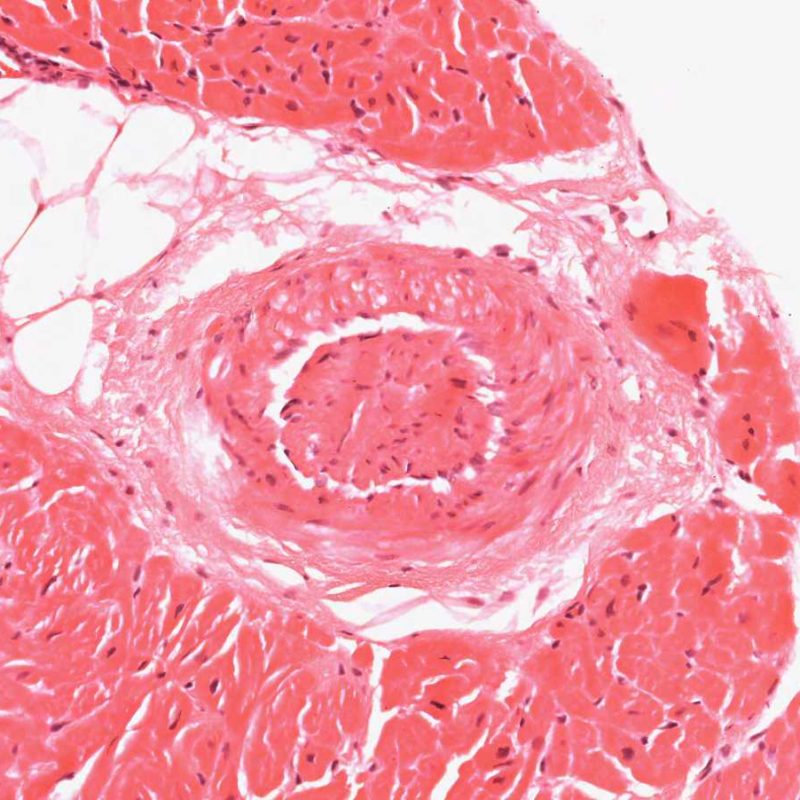
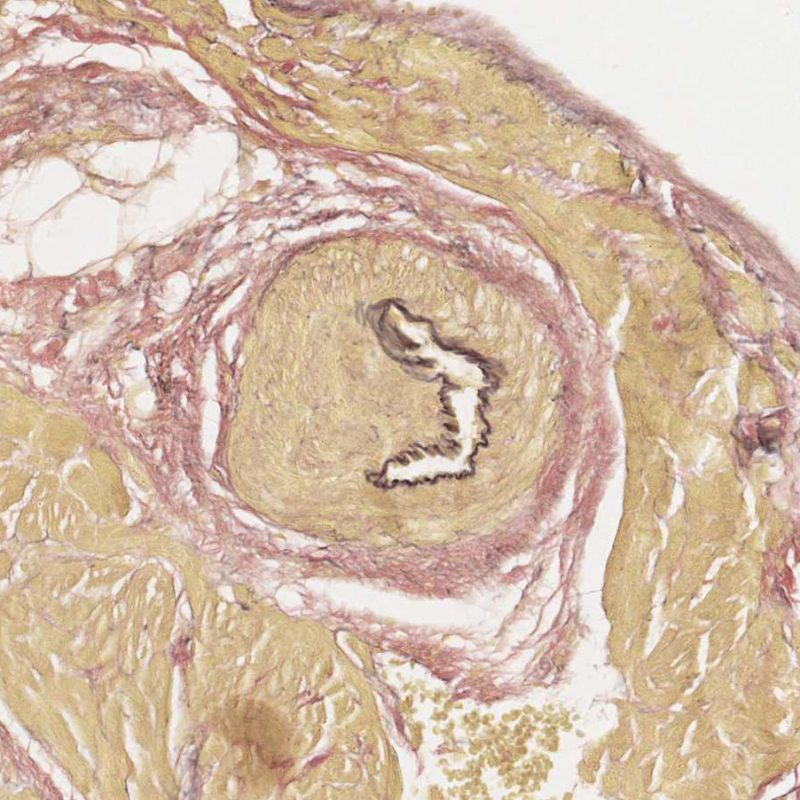
Effetto telescopico dei vasi sanguigni
Un aspetto artefattuale di comune riscontro è “l’effetto telescopico” delle arteriole, dovuto alla retrazione elastica della media vasale, che può verificarsi quando il biotomo seziona e strappa il frammento bioptico dal setto. Il vaso si retrae al suo interno e questo aspetto può ingenuamente essere interpretato in modo erroneo come vasculopatia cardiaca del graft (CAV), dal momento che il lume appare occluso. Un’analisi attenta, affiancata da una colorazione per le fibre elastiche, come quella di Miller-Van Gieson, consente comunque di evidenziare un’intima normale ed un profilo regolare delle lamine elastiche interna ed esterna della parete vasale.
L’effetto telescopico non ha alcun significato clinico, ma indica semplicemente che la sede della biopsia è prossima al setto interventricolare, dove può accadere che vengano biopsiati inavvertitamente piccoli rami penetranti della coronaria discendente anteriore sinistra. Poiché è però possibile che una CAV venga diagnosticata in questo modo, è sempre opportuno studiare l’architettura del vaso in modo approfondito.
Emorragie provocate dalla biopsia
Il prelievo dei frammenti bioptici può sporadicamente provocare fenomeni emorragici. In questi casi non si associano infiammazione e edema tissutale, a differenza di quanto accade nell’emorragia presente nel rigetto severo (Grado 3R).
Considerazioni sulle biopsie pediatriche
Le biopsie per il monitoraggio del trapianto cardiaco pediatrico vengono generalmente esaminate in ospedali pediatrici o in istituzioni che portano avanti programmi combinati di trapianto pediatrico e per adulti. Le BEM di controllo nei trapianti pediatrici sono molto meno frequenti di quelle eseguite negli adulti. Sebbene tutte le informazioni che abbiamo riportato per gli adulti si applichino anche ai casi pediatrici, vogliamo segnalare alcune particolarità di cui è bene essere al corrente.
Dimensione della biopsia
I frammenti bioptici possono essere sensibilmente più piccoli, specialmente nei neonati, in quanto vengono utilizzati biotomi di dimensioni inferiori, in considerazione del più angusto accesso vascolare e delle minori dimensioni del cuore. Anche nei casi pediatrici, comunque, andrebbero esaminati almeno tre prelievi tissutali.
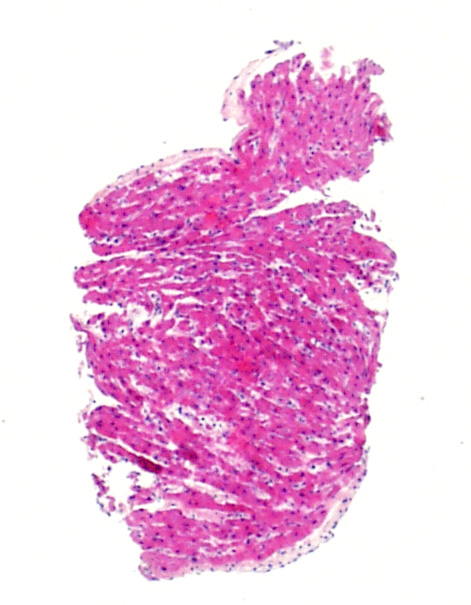
Sensazione di un'aumentata cellularità
I miociti dei neonati e dei bambini sono sensibilmente più piccoli di quelli degli adolescenti o degli adulti. Di conseguenza, il rapporto nucleo/citoplasmatico (N/C) complessivo è tale da far apparire le biopsie molto più cellulate. Questa particolarità va tenuta presente se si è abituati a valutare biopsie di pazienti adulti: bisognerà ricercare specificamente i linfociti e non basarsi semplicemente sul più elevato rapporto N/C. Si deve inoltre essere consapevoli del fatto che le cellule endoteliali dei bambini possono apparire più rigonfie e risaltare, quindi, maggiormente nella biopsia.
Frequenza del rigetto
L’esperienza in una delle nostre Istituzioni è che la percentuale di rigetto nella popolazione pediatrica (da 1 a 18 anni di età) sia circa doppia di quella degli adulti. La prima ragione va individuata nel fatto che i pazienti trapiantati adolescenti si adattano con maggiore difficoltà alle cure mediche; il secondo motivo risiede verosimilmente nel sistema immunitario, molto più energico nella popolazione infantile. E’ ragionevole, quindi, che nei bambini venga diagnosticato un numero più elevato di rigetti.